Начало третьего тысячелетия ознаменовалось настоящей пандемией неинфекционного заболевания – сахарного диабета типа 2 (СД2). По данным IDF Diabetes Atlas fourth edition, в 2010 г. в мире зарегистрировано 285 млн больных СД2 (6,4 % населения земного шара), кроме того, имеется 344 млн человек с нарушенной толерантностью к глюкозе – 7,8 % населения.
Официально в Российской Федерации ежегодно выявляется около четверти миллиона новых больных СД, но на самом деле их количество в 2–3 раза превышает этот показатель.
Основную массу пациентов составляют люди трудоспособного возраста от 40 до 60 лет. По прогнозам IDF, к 2030 г. в мире будет 188 млн человек с СД в возрасте 40–59 лет; в возрастной группе 60–79 лет ожидаемое число больных приблизится к 196 млн, что превысит нынешний показатель приблизительно в 2 раза. В 2010 г. общее количество смертельных исходов, связанных с СД, оценивается во всем мире в 3,96 млн в возрастной группе 20–79 лет, что составляет 6,8 % глобальной смертности. СД налагает большое экономическое бремя на национальные системы здравоохранения: расходы на него составят в 2010 г. 11,6 % бюджета мирового здравоохранения.
Около 95 % стран потратят более 5 %, а 80 % стран – от 5 до 13 % бюджета здравоохранения на лечение СД и его осложнений. Глобальные расходы на предотвращение и лечение СД и его осложнений составят в 2010 г. 376 млрд долл. США, а к 2030 г. они превысят 490 млрд. В среднем в 2010 г. в мире на лечение СД будет истрачено 703 долл. на человека.
Таким образом, СД2 представляет собой важнейшую медицинскую, социальную и экономическую проблему современности. Это обусловлено одной из особенностей СД2 – достаточно длительным и малосимптомным течением, наличием своеобразного “скрытого периода” заболевания, с чем связана низкая обращаемость пациентов в медицинские учреждения. Однако уже на самых ранних стадиях заболевания гипергликемия способствует развитию выраженных нарушений секреции инсулина, быстрому прогрессированию атеросклероза, поражению нервной системы. Все это приводит к тому, что к моменту появления явных симптомов СД2 уже присутствуют нарушения, определяющие высокую частоту развития хронических инвалидизирующих осложнений.
Осложнения СД связаны прежде всего с поражением сосудов мелкого и крупного калибра; к ним относятся микро- и макроангиопатии (ретино-, нефропатии, инфаркт миокарда, церебральный инсульт, гангрена нижних конечностей, диабетическая стопа), приводящие к значительному уменьшению продолжительности и ухудшению качества жизни пациентов, а также к высоким затратам на проведение лечебно-диагностических мероприятий со стороны как больного, так и государства.
Патогенез СД2
СД2 – заболевание, обусловленное инсулинорезистентностью (ИР) и относительным дефицитом инсулина. Сохранение функции β-клеток (частичное или полное) на начальном этапе течения болезни у большинства больных определяет отсутствие потребности в инсулинотерапии.
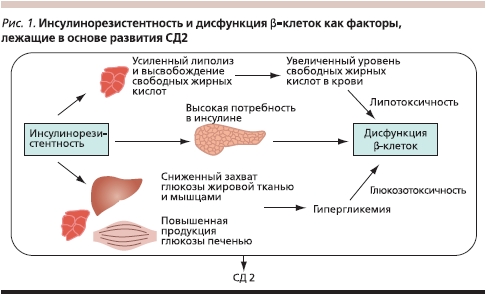
ИР обусловлена генетическими и другими факторами риска, среди которых: пол, возраст, этническая принадлежность и образ жизни. В условиях ИР для поддержания нормального уровня глюкозы в крови необходима усиленная секреция инсулина. Снижение секреторной активности β-клеток до уровня, недостаточного для преодоления ИР, приводит к дефициту инсулина и нарушениям обмена глюкозы. Они манифестируют как нарушение толерантности к глюкозе, а впоследствии эволюционируют в СД2. Компенсаторная гиперинсулинемия приводит к развитию артериальной гипертензии, повышению уровня триглицеридов, снижению уровня липопротеидов высокой плотности и ускорению процессов атерогенеза. На взаимосвязь СД, нарушений жирового обмена и атеросклероза 90 лет назад указывал Elliott P. Josslin: “Уверен, что главная причина преждевременного развития атеросклероза при диабете кроме возраста связана с избытком жира (избыток жира в теле – ожирение, избыток жира в диете и избыток жира в крови). С избытка жира диабет начинается, и от избытка жира диабетик умирает, раньше – от комы, теперь – от атеросклероза”.
ИР клеток печени за счет усиления глюконеогенеза приводит к повышению продукции глюкозы. В результате повышается уровень гликемии натощак. Из-за ИР скелетных мышц повышается постпрандиальная гликемия, поскольку именно утилизация глюкозы в мышцах является главным механизмом удаления глюкозы из крови. ИР жировой ткани проявляется в резистентности к антилиполитическому действию инсулина, приводящему к накоплению свободных жирных кислот и глицерина. Свободные жирные кислоты поступают в печень, где становятся основным источником формирования атерогенных липопротеидов очень низкой плотности.
Ранние стадии СД2 характеризуются повышенной секрецией инсулина, постепенно β-клетки истощаются, происходит усиление нарушений углеводного обмена. В результате глюкозотоксического действия на β-клетки нарушаются синтез и секреция инсулина (увеличивается отношение проинсулин/инсулин). Попутно происходит выпадение ранней фазы стимулированной секреции и нарушается импульсная секреция инсулина. Патогенетические факторы СД2 в их взаимосвязи представлены на рис. 1.
Принципы лечения СД2
Гетерогенность СД2, связанная с наличием ИР и нарушением секреции инсулина β-клетками поджелудочной железы, обусловливает многообразие подходов к терапии этого заболевания. Целью лечения СД2 является достижение и обеспечение стабильного метаболического контроля от момента установления диагноза и на протяжении всей жизни пациента, позволяющие предупреждать или отсрочивать появление поздних осложнений СД.
Необходимость пожизненной терапии СД2 и высокая частота развития осложнений, требующих лечения, ставят вопрос о соотношении цены и качества препаратов, применяемых в терапии СД2, т. е. выбора наиболее оптимального сахароснижающего препарата (ССП), позволяющего достигать эффективного контроля гликемии и характеризующегося ценой, доступной для пациента или органа социального страхования. Данная проблема особенно актуальна для нашей страны, принимая во внимание недостаток финансирования системы муниципального здравоохранения.
На сегодняшний день терапия СД2 базируется на положениях консенсуса Американской диабетологической ассоциации и Европейской ассоциации изучения диабета “Лечение гипергликемии при сахарном диабете типа 2: алгоритм-консенсус для начальной и последующей терапии”.
Ключевым моментом лечения СД2 является борьба с гипергликемией – основным метаболическим нарушением. Поддержание гликемии, максимально приближенной к уровню, наблюдаемому у здоровых людей, снижает риск развития осложнений СД, таких как ретино-, нефро- и нейропатии. Целевой уровень гликированного гемоглобина (HbA1c), согласно последним рекомендациям Американской диабетологической ассоциации, составляет < 7 %. При лечении пациента необходимо стремиться к поддержанию концентрации HbA1c как можно ближе к нормальной (< 6 %), не допуская значимых гипогликемических состояний. Рекомендации Международной федерации диабета по гликемическому контролю требуют достижения уровня HbA1c < 6,5 %. По мнению авторов Консенсуса, уровень HbA1c ≥ 7 % должен служить сигналом к началу или изменению терапии, целью которой должно стать снижение уровня HbA1c до такового у здоровых людей или хотя бы до < 7 %. Рекомендации по лечению СД2 представлены в табл. 1 и 2.
Примечание. ЛПНП – липопротеиды низкой плотности, ЛПВП – липопротеиды высокой плотности.
* С учетом того, что недиабетический уровень = 4,0–6,0 % при использовании метода определения, основанного на DCCT.
** Измерения постпрандиального уровня глюкозы должны выполняться через 1–2 часа после начала приема пищи.
К сожалению, лечению присущих СД2 дислипидемии, артериальной гипертензии, гиперкоагуляции, ожирения и инсулиновой недостаточности исторически всегда отводились вторые роли. В настоящее время при выборе препарата для лечения СД учитывают его эффекты на массу тела, уровень липидов и т. д.
Основные принципы лечения больных СД2:
• индивидуальный подход к терапии с учетом особенностей течения и тяжести заболевания, образа жизни и характера питания больного;
• поддержание нормального уровня глюкозы и липидов в крови;
• диетотерапия и дозированные физические нагрузки, позволяющие поддерживать нормальный вес;
• применение пероральных ССП и/или инсулина в случаях, когда не удается устранить гипергликемию и нормализовать вес с помощью диеты и физических нагрузок;
• обучение больных СД2 и повышение их приверженности проводимой терапии;
• профилактика и раннее начало лечения осложнений СД.
Характеристикам отдельных методов лечения диабета посвящено много работ. Нашей целью является предоставление информации для выбора базисной терапии СД2.
Современные пероральные ССП в лечении СД2
В настоящее время в клинической практике используются следующие классы пероральных ССП:
• производные сульфонилмочевины (ПСМ);
• бигуаниды;
• ингибиторы α-глюкозидаз;
• прандиальные регуляторы гликемии;
• тиазолидиндионы;
• инкретины;
• комбинированные препараты.
Существование нескольких классов ССП расширяет возможности лечения СД2. Процесс выбора ССП базируется на его гипогликемической эффективности у данного пациента; наличии экстрагликемических эффектов, способных предотвращать отдаленные осложнения; профиле безопасности; переносимости; стоимости.
Сравнительные данные о противодиабетических препаратах приведены в таблице 3 (по Nathan D.M., Buse J.B., Davison M.B. и соавт.)
Примечание. ЖКТ – желудочно-кишечный тракт.
* Тяжелая гипогликемия при приеме ПСМ развивается редко. Длительно действующие препараты (хлорпропамид, глибенкламид и глипизид с замедленным высвобождением) с большей вероятностью могут вызывать гипогликемию, чем обычный глипизид, глимепирид и гликлазид.
** Репаглинид более эффективно снижает HbA1с, чем натеглинид.
Сахароснижающая эффективность препаратов и их комбинаций обусловлена не только их свойствами, но и исходным уровнем гликемии, длительностью заболевания, предшествующей терапией. Решающим фактором при выборе препарата является уровень гликемического контроля. Высокая степень гликемии (HbA1c ≥ 8,5 %) диктует необходимость применения препаратов с выраженным и быстрым сахароснижающим эффектом, раннее начало комбинированной терапии. Уровень гликемии, близкий к целевым значениям (HbA1c < 7,5 %), позволяет применять препараты с меньшим гипогликемическим потенциалом, более медленным развитием эффекта.
Метформин – единственный бигуанид, применяемый в большинстве стран мира. Препараты этой группы не изменяют секрецию инсулина, однако в присутствии последнего увеличивают периферическую утилизацию глюкозы тканями. Второй важный механизм действия бигуанидов – это снижение глюконеогенеза и уменьшение продукции глюкозы печенью. Считается также, что они могут уменьшать всасывание углеводов в кишечнике. Основой эффект метформина в отношении уменьшения уровня гликемии натощак можно оценить скорее как антигипергликемический, нежели как сахароснижающий. Обычно монотерапия метформином приводит к снижению концентрации HbA1c примерно на 1,5 %, не сопровождается гипогликемическими состояниями и может безопасно применяться у пациентов с преддиабетической гипергликемией без риска развития гипогликемий.
Помимо воздействия метформина на углеводный обмен следует отметить его положительное влияние на метаболизм липидов, что не менее важно при СД2: снижение уровня общего холестерина на 10 %, триглицеридов – на 20–30 %. Метформин – практически единственный сахароснижающий препарат, лечение которым может приводить не к повышению, а даже к снижению массы тела пациентов (в среднем на 1,5 кг в год). По данным исследования UKPDS, если повышение веса со временем все же происходит, оно минимально по сравнению с действием других препаратов. Поэтому показанием к применению метформина является невозможность достижения компенсации заболевания у лиц с СД2 (в первую очередь с ожирением) на фоне диетотерапии ± ПСМ. Исследование UKPDS продемонстрировало положительное влияние метформина на исходы сердечно-сосудистых заболеваний, но это требует дальнейшего подтверждения.
В исследовании UKPDS, как и в ряде других глобальных исследований, применялся оригинальный препарат метформина ГлюкофажR.
В настоящее время показана эффективность метформина в коррекции ряда состояний, сопряженных с ИР:
• метаболический синдром;
• синдром поликистозных яичников;
• неалкогольный стеатогепатит;
• липодистрофия при ВИЧ-инфекции;
• ожирение и нарушенная толерантность к глюкозе.
Препарат обычно хорошо переносится. Среди побочных эффектов метформина следует отметить диарею и другие диспепсические явления (металлический вкус во рту, тошнота, анорексия), которые в начале терапии наблюдаются почти у 20 % больных, а затем самостоятельно проходят через несколько дней. Риск побочных явлений можно свести к минимуму медленным титрованием дозы, приемом препарата во время еды и временным снижением дозы при их возникновении.
Риск развития лактатацидоза при применении метформина минимален по сравнению с остальными бигуанидами и не превышает 8,4 случая на 100 тыс. больных в год. Кроме того, при развитии лактатацидоза речь, как правило, идет не о метформин-индуцированном, а метформин-ассоциированном лактатацидозе.
Если компенсации углеводного обмена не удается достичь при помощи изменения образа жизни и максимальных доз метформина в течение 2–3 месяцев, пациенту следует назначить дополнительный препарат.
В ближайшее время в России появится новая лекарственная форма метформина пролонгированного действия – ГлюкофажR Лонг. Его можно применять один раз в сутки, в отличие от обычной формы метформина, применяемой 2–3 раза в день. Упрощение схемы приема позволяет повысить комплаентность пациента и эффективность терапии. ГлюкофажR Лонг отличается лучшей переносимостью и меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта, чем метформин обычного высвобождения, что было продемонстрировано в ходе ряда многоцентровых клинических исследований.
Это особенно важно для пациентов, которым впервые назначен метформин, а также для больных с плохой переносимостью обычной формы метформина.
ГлюкофажR Лонг успешно применяется в странах Европы и США и включен в качестве препарата стартовой терапии в клинические рекомендации ряда стран.
Метформин может применяться в сочетании с ПСМ или инсулином. Теоретическое обоснование комбинированной терапии основывается на том, что препараты этих групп имеют различные точки приложения своего основного механизма действия. Поэтому комбинированная терапия может, с одной стороны, усилить терапевтический эффект, с другой – ослабить побочные явления за счет снижения назначаемых доз каждого из лекарств.
Среди ПСМ второго поколения до сегодняшнего дня продолжает использоваться глибенкламид, история применения которого насчитывает более 40 лет. Препарат обладает наиболее выраженным сахароснижающим действием среди всех ПСМ и производится в виде двух форм: немикронизированной и микронизированной. Глибенкламид обладает максимальным сродством к АТФ-зависимым K+-каналам β-клеток, с чем и связан его выраженный сахароснижающий эффект. В ряде случаев это может стать причиной гипогликемии в ночное время, особенно в случае пропуска очередного приема пищи, недостаточного количества пищи или неадекватности физических нагрузок, что наиболее опасно у лиц пожилого и старческого возраста.
Микронизированная форма глибенкламида характеризуется значительно большей биодоступностью и эффективностью по сравнению с немикронизированной, несмотря на применение меньшей дозы этого ПСМ. Микронизированная форма обеспечивает полное высвобождение действующего вещества в течение 5 минут после растворения и быстрое всасывание, поэтому ее рекомендуется принимать непосредственно перед приемом пищи. Максимальная концентрация микронизированных форм глибенкламида в крови достигается через 1,7 (1,75 мг) и 2,5 часа (3,5 мг). Риск гипогликемических эпизодов в промежутки времени между приемами пищи и ночью значительно снижен.
Комбинированный препарат Глюкованс в лечении СД2
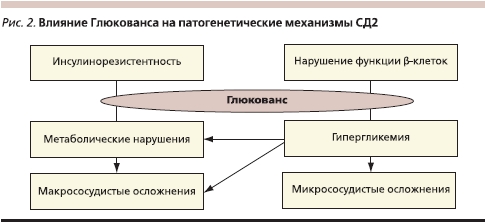
Глюкованс – комбинированный таблетированный препарат, в состав которого входят метформин и глибенкламид. Показанием к назначению Глюкованса является неэффективность предшествующей монотерапии СД2 метформином или глибенкламидом, а также замещение предшествующей терапии двумя этими препаратами. Глюкованс может быть назначен как первый шаг лечения в случае поздней постановки диагноза или при изначально агрессивном течении заболевания с уровнем HbA1c 8,5–9 %. Механизмы воздействия Глюкованса на патогенез СД2 представлен на рис. 2.
В настоящее время производится две лекарственные формы препарата, содержащие 500 мг метформина и 2,5 или 5,0 мг глибенкламида в одной таблетке. Технология производства Глюкованса уникальна: глибенкламид в виде частиц строго определенного размера равномерно распределен в растворимом матриксе метформина. Микронизированные формы глибенкламида характеризуются значительно лучшей биодоступностью, при их использовании пик концентрации активного препарата в плазме крови достигается раньше, чем при применении немикронизированных форм. При приеме Глюкованса эти особенности позволяют добиваться более эффективного контроля гликемии после еды и снижения HbA1c по сравнению с монотерапией его компонентами. Микронизированная форма глибенкламида в составе Глюкованса обеспечивает безопасность препарата при высокой эффективности. Препарат оказывает меньшее воздействие на β-клетки, не повышает концентрацию инсулина в плазме крови натощак и снижает риск гипогликемий.
Эффективность Глюкованса исследовалась Marre M. и соавт. (2002) у 411 больных с неадекватным гликемическим контролем на фоне монотерапии глибенкламидом и метформином. Они были рандомизированы к получению в течение 16 недель терапии метформином, глибенкламидом (5 мг в таблетке) и Глюковансом в двух формах: метформин 500 мг/глибенкламид 2,5 мг и метформин 500 мг/глибенкламид 5,0 мг. Дозы препаратов постепенно увеличивались до достижения целевых значений гликемии (HbA1c < 7,0 ммоль/л). Лучшие результаты были достигнуты в группах больных, принимавших Глюкованс. Через 16 недель лечения уровни HbA1c и глюкозы плазмы натощак в группе больных, принимавших Глюкованс с соотношением метформин/глибенкламид 500 мг/2,5 мг, снизился на 1,2 % и 2,62 ммоль/л, а с соотношением 500 мг/5,0 мг – на 0,91 % и 2,43 ммоль/л соответственно, в то время как в группе метформина эти показатели снизились лишь на 0,19 % и 0,57 ммоль/л, а в группе глибенкламида – на 0,33 % и 0,73 ммоль/л соответственно. Целевые значения гликемии достигались при применении меньших доз метформина и глибенкламида в составе Глюкованса в сравнении с дозами, применяемыми при монотерапии. Для Глюкованса максимальные дозы метформина и глибенкламида составляли 1225 и 6,1 мг/1170 и 11,7 мг в зависимости от формы выпуска против 1660 и 13,4 мг при монотерапии.
В исследовании Donahue S.R. и соавт. (2002) с участием 806 больных было показано, что лечение Глюковансом обеспечивает более эффективный контроль уровня глюкозы после еды по сравнению с монотерапией его компонентами. Глюкованс повышал уровень инсулина через 2 часа после еды эффективнее, чем один глибенкламид, не влияя при этом на концентрацию инсулина натощак. Таким образом, при приеме Глюкованса усиление секреции инсулина происходит в более оптимальные сроки по сравнению с монотерапией глибенкламидом.
Ретроспективный анализ, проведенный Dailey G.E., показал большую эффективность Глюкованса в сравнении с сочетанным применением метформина и глибенкламида в плане снижения уровня HbA1c. При переводе больных с комбинации метформина и глибенкламида на прием Глюкованса наблюдалось достоверное снижение уровня HbA1c (≈ -0,6 %), эффект был наиболее выражен у больных, имевших исходный уровень HbA1c > 8 %.
Основными побочными эффектами применения Глюкованса как комбинированного препарата, содержащего глибенкламид и метформин, являются симптомы гипогликемии и нежелательные явления со стороны ЖКТ. Было показано, что у пожилых людей не наблюдалось увеличения частоты гипогликемий при лечении Глюковансом. Ослабление побочных явлений обусловлено характером влияния препарата на секрецию инсулина: Глюкованс значительно усиливает секрецию инсулина после еды, не влияя на уровень инсулина в плазме крови натощак.
В заключение хотелось бы отметить, что комбинированные препараты несомненно имеют ряд преимуществ. За счет более низких терапевтических доз их компонентов они лучше переносятся пациентами, реже вызывая побочные явления, чем это наблюдается при раздельном назначении комбинируемых препаратов. Прием комбинированных препаратов повышает приверженность больных лечению, поскольку уменьшает количество и кратность приема таблетированных средств. Однако фиксированные дозы компонентов создают ряд трудностей при необходимости изменения дозы только одной из составляющих. Наличие различных дозировок компонентов комбинированного препарата (как в случае Глюкованса) делает возможным более гибкий подбор оптимального соотношения комбинируемых лекарственных средств.
Таким образом, Глюкованс:
• единственный комбинированный препарат, имеющий в составе микронизированную форму глибенкламида, что позволяет снижать риск гипогликемии;
• содержит сбалансированную комбинацию метформина (500 мг) и глибенкламида (2,5 и 5,0 мг) в одной таблетке;
• предоставляет выбор дозировок – возможность титрации доз;
• высокоэффективен в малых дозах, не ухудшает переносимость компонентов.
Более выраженное снижение уровня глюкозы и HbA1c при применении Глюкованса может быть обусловлено лучшим соблюдением больными назначенного лечения (лучший комплаенс). Кроме того, определенное значение может иметь уникальная структура Глюкованса, благодаря которой глибенкламид всасывается быстрее, чем после приема таблетки глибенкламида, хотя его системная концентрация при этих двух способах применения почти одинакова. Поскольку Глюкованс принимают во время еды, это способствует достижению оптимальной эффективности препарата в отношении как постпрандиальной гипергликемии, так и гипергликемии натощак.
Важнейшее значение в терапии СД2 имеет фармакоэкономический аспект, т. е. выбор препарата с оптимальным соотношением стоимости, клинической эффективности и безопасности. Это обусловлено в первую очередь хроническим характером течения заболевания и необходимостью длительного (пожизненного) сахароснижающего лечения. Большое значение имеют и огромное количество пациентов, страдающих СД2, и сложная экономическая ситуация, сложившаяся в нашей стране.
Цены социально значимых лекарств, а именно таковыми являются пероральные ССП, должны быть приемлемыми как для каждого конкретного пациента, так и для системы здравоохранения в целом, обеспечивающей определенные категории больных лекарственными средствами за счет государственного бюджета. С этой точки зрения Глюкованс характеризует достаточная ценовая доступность.
Таким образом, терапия СД2 Глюковансом позволяет проводить патогенетическую терапию, направленную на коррекцию ИР и дисфункции β-клеток, добиваться высокой эффективности при низкой стоимости лечения.



