До половины больных сахарным диабетом (СД) могут испытывать постпрандиальную абдоминальную боль, тошноту, вздутие живота или рвоту, обусловленные нарушением двигательной функции желудка [18]. Спектр двигательных дисфункций желудка при СД весьма широк – это расстройства аккомодации желудка, нарушение ритма перистальтики, ослабление моторики антрального отдела с нарушением эвакуаторной функции и расстройства антродуоденальной координации.
В то же время в клинической практике отсутствует детальная рубрификация данных дискинезий в рамках конкретных нозологических форм, аналогичная классификации функциональных расстройств желудка по Римским критериям III 2006 г. [21]. Поэтому наиболее часто двигательные дисфункции желудка при СД рассматривают в рамках таких нозологических форм, как желудочно-кишечная диспепсия (К30 по МКБ-10), включая постпрандиальный дистресс-синдром, диабетическая гастропатия или диабетический гастропарез (ДГП).
Место ДГП среди моторных дисфункций желудка
Используя классификационные Римские критерии III, в категорию гастропарез можно отнести такие нозологические формы, как хроническая идиопатическая тошнота, функциональная рвота и синдром циклической рвоты, т. е. расстройства, сопровождающиеся тошнотой и рвотой. Основанием послужили исследования, показавшие, что у пациентов с подозрением на гастропарез, в дальнейшем подтвержденный инструментальными методами, тошнота присутствовала в 92 %, рвота – в 84 % случаев [15].
До настоящего времени не существует стандартного определения гастропареза, однако чаще всего под этим понятием подразумевается состояние патологического нарушения перистальтики, характеризующееся замедлением эвакуации содержимого желудка в отсутствие механического препятствия выходного отдела. Для определения ДГП вполне обоснованно можно использовать термин “идиопатический гастропарез”, согласно Римским критериям III, принимая во внимание, что по этиологии он не идиопатический, а диабетический.

Таким образом, под термином “диабетический гастропарез” можно подразумевать двигательное расстройство желудка при СД, в основе которого лежит нарушение его эвакуаторной функции, проявляющееся эпизодами тошноты, возникающей несколько раз в неделю, кратковременными эпизодами рвоты (не реже одного раза в неделю) или стереотипными приступами рвоты (продолжительностью до недели), возникающими не менее трех раз в год. К сожалению, в данном определении совершенно отсутствуют объективные инструментальные критерии диагностики нарушений эвакуаторной функции желудка.
Рассматривая данную проблему, чрезвычайно важно понимать, что ДГП является одной из наиболее тяжелых, крайних форм дискинезий желудка, клинический дебют которых рассматривается в рамках желудочной диспепсии при СД. ДГП является финальной стадией диабетической гастропатии, их объединяют общая этиология, патогенез и единые подходы к лечению.
Гастропарез относится к полиэтиологическим расстройствам (см. рисунок) и может рассматриваться как преходящее состояние (после приемалекарств, на фоне электролитного или метаболического дисбаланса, вирусной инфекции, при тяжелой сопутствующей патологии) или как проявление хронического процесса. Наиболее частыми причинами развития гастропареза являются СД (29 %) и последствия операций в гастродуоденальной зоне (13 %). В 35 % случаев причина гастропареза остается невыясненной.
Распространенность гастропареза очень сложно оценить точно, т. к. критерии его диагностики не стандартизованы, а опубликованные исследования обычно отражают результаты отдельного центра. Однако подсчитано, что около 4 % взрослой популяции имеют проявления гастропареза, причем 82 % из них составляют женщины. Причина полового дисбаланса среди пациентов с гастропарезом остается неизвестной, но существуют данные о гендерных различиях в скорости эвакуации пищи из желудка с более низкими показателями у женщин [11].
Систематические исследования с использованием сцинтиграфии показали, что замедленная желудочная эвакуация или гастропарез выявляется у 30–50 % больных СД типов 1 и 2. При этом желудочная дисмоторика нередко сопровождается снижением всасывания нутриентов, абсорбции лекарственных средств и трудностями в контроле гликемии [20].
Патогенез
В основе патогенеза ДГП лежит задержка эвакуации желудочного содержимого, возникающая при гипергликемии. Это естественная физиологическая реакция, препятствующая дальнейшей гипергликемии [17]. Известно, что и у здоровых субъектов скорость опорожнения желудка уменьшается при индуцированной гипергликемии. Повышение концентрации глюкозы крови до 12–13 ммоль/л немедленно приводит к снижению моторики антрального отдела желудка, а повышение уровня глюкозы до 15 ммоль/л сопровождается замедлением моторики практически всех отделов желудочно-кишечного тракта (ЖКТ) [8].
Кроме того, большое значение в патогенезе ДГП имеют следующие механизмы [2]:
- дисфункция автономной нервной системы;
- дисрегуляция секреции и действия гормонов, инкретинов;
- электролитные нарушения, связанные с уремическим и кетоацидотическим состоянием.
В основе патогенеза автономной и периферической нейропатии лежат гипергликемия, гипоинсулинемия (абсолютная и относительная) и как следствие – развивающийся каскад метаболических расстройств.
Признаки диабетической нейропатии могут выявляться и до манифестации СД, хотя ее частота возрастает по мере увеличения длительности заболевания. Так, признаки поражения периферической нервной системы в первый год СД регистрируются редко (до 7 %), через 5–7 лет от начала заболевания – в 45–60 %, через 12–15 лет они встречаются у 95 % больных.
Известно, что стойкая гипергликемия способствует повышению внутриклеточной концентрации глюкозы и через каскад ферментативных реакций ведет к повышению уровня свободных радикалов, которые повреждают нейроны, нарушают их кровоснабжение и снижают скорость проведения импульса. К подобному результату при СД приводит также подавление синтеза миоинозитола – основного компонента миелина – и снижение активности Nа+/К+-АТфазы.
Важнейшим звеном патогенеза указанных расстройств является диабетическая микроангиопатия. Гипергликемия приводит к гликированию белков в стенках интраневральных сосудов, утолщению этих стенок, ишемии нервов, нарушению проведения импульса.
Желудочная миоэлектрическая активность инициируется клетками Кахаля, расположенными в мышечной стенке фундального и антрального отделов. Эти клетки инициируют и координируют перистальтику желудка. При СД за счет усиления свободно-радикального окисления и нарушения тканевого метаболизма оксида азота нарушается соотношение фаз мигрирующего межпищеварительного моторного комплекса, нормальный электрический ритм желудка замещается бради-, тахигастрией или смешанными формами дисритмии.
Большое число нейротрансмиттеров, включая норадреналин, ацетилхолин, 5-гидрокситирамин и оксид азота, вовлечено в процесс запуска, поддержания и регулирования желудочных сокращений. Оксид азота, продуцируемый нейрональной NO-синтетазой в межмышечном сплетении, вызывает расслабление гладких мышц в проксимальных отделах желудка, что приводит к подавлению его опорожнения. Гуморальное воздействие на моторику желудка осуществляется комплексно, причем медиаторы воздействуют как непосредственно на мышечные волокна, так и опосредованно через нервные элементы [23].
При декомпенсации СД (диабетическом кетоацидозе) в развитии гастропареза важную роль играют разнообразные электролитные нарушения. Гипокалиемия вызывает атонию желудка, а кетоновые тела и азотистые продукты распада белков оказывают токсическое действие.
Важно учитывать, что при СД вышеописанные нарушения моторной функции желудка инициируют нарушения морфо-функционального состояния слизистой оболочки, что приводит к подавлению секреторной функции желудка. С увеличением длительности заболевания СД кислотообразование угнетается независимо от степени его декомпенсации [8]. Данный факт имеет чрезвычайно важное клиническое значение, т. к. становится очевидной определенная несостоятельность изолированной антисекреторной терапии диабетической гастропатии.
Клиника и диагностика
Симптомы ДГП включают тошноту, рвоту, чувство раннего насыщения, вздутие живота, тяжесть и чувство переполнения в животе после еды, боли в животе, снижение/увеличение веса тела. Установлено, что интенсивность диспепсических жалоб не коррелирует с выраженностью нарушений моторики желудка. Так, у пациентов, не предъявляющих каких-либо жалоб со стороны ЖКТ, может наблюдаться значительное замедление опорожнения желудка.
Для стратификации симптомов гастропареза Американской ассоциацией по изучению моторики была предложена простая шкала тяжести заболевания [9], представленная в табл. 1.
Таблица 1. Классификация степени тяжести гастропареза.
Для объективизации выраженности симптомов гастропареза и оценки эффективности лечения Revicki D. и соавт. (2003) разработали опросник для пациентов, т. н. GCSI (gastroparesis cardinal symptom index), широко использующийся в настоящее время при обследовании и лечении больных гастропарезом [16]. Данный опросник включает оценку пациентом или врачом основных симптомов заболевания (чувство раннего насыщения, тошнота, рвота, вздутие живота и т. д.).
При объективном осмотре у пациентов с ДГП наряду с клиническими проявлениями СД могут наблюдаться “шум плеска” над желудком, симптомы дегидратации, недостаточности питания. Описаны случаи развития полной атонии желудка с ежедневной рвотой, серьезными электролитными расстройствами и резким снижением массы тела.
Гастропарез оказывает существенное влияние на течение СД. Повторяющиеся труднокорригируемые гипо- и гипергликемии должны насторожить клинициста в отношении возможного нарушения моторной функции желудка, замедления опорожнения желудка вплоть до гастропареза [12]. Это связано прежде всего с измененной на фоне моторных нарушений абсорбцией лекарственных веществ.
Основные осложнения гастропареза включают эрозивный эзофагит, симптом Мэллори–Вейса, кахексию, уменьшение объема межклеточной жидкости с вторичной почечной недостаточностью, электролитный дисбаланс и образование безоаров.
Диагностика нарушений желудочной эвакуации и ДГП в настоящее время достаточно сложна. Это обусловлено, с одной стороны, неспецифичностью клинических проявлений заболевания, с другой – отсутствием стандартных инструментальных диагностических критериев.
Первым этапом диагностики ДГП должно стать исключение стенозирования или компрессии верхних отделов ЖКТ посредством эндоскопического исследования, капсульной эндоскопии или рентгенографии.
Оценка перистальтики желудка и кишки в настоящее время осуществляется большим количеством методов, которые могут быть разделены на неинвазивные (не влияющие на моторную функцию желудка) и инвазивные (влияющие на моторную функцию). Они могут быть сгруппированы в четыре категории (табл. 2).
Таблица 2. Методы диагностики нарушений желудочной эвакуации.
Чрезвычайно перспективным методом диагностики нарушений желудочной эвакуации является внутрижелудочная импедансометрия, основанная на оценке динамики суммарного импеданса, обратно пропорционального степени наполненности желудка. В 2001 г. нами предложен способ исследования эвакуации из желудка пищи различного нутритивного состава с использованием этого метода [6].
Последним достижением в диагностике гастропареза является использование капсульных WiFi–радиомаяков, позволяющих оценивать внутрипросветный рН, фазовую желудочную активность, изменения температуры, частоту и амплитуду сокращений кишки. В сравнительных исследованиях показана высокая корреляция результатов данного метода с показателями сцинтиграфии.
Лечение
Комплексное лечение ДГП включает следующие направления:
1. Диета:
- частый прием небольших количеств пищи с низким содержанием жиров;
- гомогенизированная пища.
2. Питание:
- добавление питательных смесей;
- зондовое питание.
3. Лечение СД.
4. Коррекция дефицита жидкости и электролитов.
5. Симптоматическая терапия.
Компонентами фармакотерапии гастропареза являются: интенсивная инсулинотерапия (инсулинами короткого действия), адекватное введение жидкости (физиологический раствор, по показаниям растворы калия, глюкозы и бикарбоната натрия). После устранения гастропареза при СД типа 1 продолжается проведение инсулинотерапии, при СД типа 2 либо продолжают инсулинотерапию, либо назначают таблетированные сахароснижающие препараты. Необходимо помнить о том, что при развитии гастропареза нарушение всасывания препаратов может привести к развитию как гипо-, так и гипергликемии. Поэтому строгий контроль уровня глюкозы в крови имеет важнейшее значение в лечении и профилактике ДГП. Целевые уровни глюкозы крови: натощак – не более 6,0–6,5 ммоль/л, через 2 часа после приема пищи – не более 7,0 ммоль/л.
К наиболее часто используемым при ДГП классам препаратов относят прокинетики и противорвотные (антиэметические) средства (табл. 3). Прокинетики повышают тонус нижнего пищеводного сфинктера, повышают эвакуаторную функцию желудка, нормализуют соотношение фаз мигрирующего моторного комплекса, повышают антродуоденальную координацию и продуктивную перистальтику кишки.
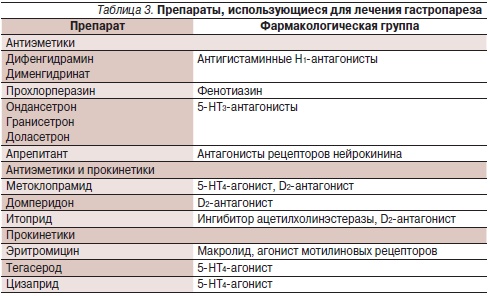
К сожалению, субъективное купирование симптомов слабо коррелирует с влиянием лечения на опорожнение желудка [15]. Важно отметить, что большинство применяемых прокинетиков не уменьшает болевой синдром и чувство раннего насыщения, связанные с гастропарезом. Кроме того, по результатам мета-анализов наблюдается значительный вклад плацебо-эффекта в действие прокинетиков и обсуждается вопрос об обоснованности положительных выводов некоторых клинических исследований [13].
Одним из методов лечения ДГП являются инъекции ботулотоксина в препилорическую область желудка. Однако, по данным Arts J. и соавт. (2003), у пациентов с идиопатическим гастропарезом данный эффект сопоставим с эффектом плацебо.
В качестве резервных методов коррекции моторных нарушении используется желудочная нейростимуляция, которая хотя и получила разрешение FDA, но не одобрена Британским институтом здоровья (NICE) из-за частого развития инфекционных осложнений, что в 5–20 % случаев приводит к необходимости извлечения устройства.
Симптомы гастропареза влияют на самочувствие пациента, его психическое состояние, поведение и социальную активность. Согласно литературным данным, 23 % больных идиопатическим гастропарезом страдают депрессией или принимали антидепрессанты.
Антиэметическая терапия гастропареза в настоящее время направлена исключительно на уменьшение тошноты и носит симптоматический характер. Более эффективно при ДГП использование прокинетических препаратов с антиэметическим эффектом.
В табл. 4 представлены использующиеся в России прокинетики с антиэметической активностью, их механизмы действия и физиологические эффекты.
Таблица 4. Механизмы действия и физиологические эффекты прокинетиков с антиэметической
активностью, используемых в России.
Итоприд (Ганатон) выгодно отличается от остальных прокинетиков сочетанием двойного механизма действия с отсутствием серьезных побочных эффектов, характерных для других препаратов – метоклопрамида (экстрапирамидные эффекты, гиперпролактинемия) и цизаприда (удлинение интервала Q-T). Итоприд рассматривается как препарат первой линии в лечении двигательных нарушений пищевода и желудка.
Название “Ганатон” происходит от своеобразной аббревиатуры словосочетания “gastric natural tone”, т. е. восстанавливающий нормальный тонус ЖКТ. Препарат обладает минимальной способностью проникать через гематоэнцефалический барьер.
Итоприд обладает двойным механизмом действия, обеспечивая:
- блокаду D2-рецепторов в области парасимпатического нервного окончания, повышая высвобождение ацетилхолина;
- ингибирование ацетилхолинэстеразы гладкой мускулатуры ЖКТ, препятствуя деградации ацетилхолина.
Все это в конечном итоге усиливает пропульсивную моторику желудка, ускоряет его опорожнение и устраняет антродуоденальную дискоординацию. Кроме того, препарат оказывает противорвотный эффект, которой реализуется благодаря взаимодействию с D2-дофаминовыми хеморецепторами триггерной зоны.
При гастропарезе назначают внутрь по 1 таблетке препарата Ганатон 50 мг 3 раза в сутки до еды. Рекомендуемая суточная доза составляет 150 мг.
Чрезвычайно важно, что метаболизм итоприда позволяет избежать нежелательного лекарственного взаимодействия при его использовании в сочетании с препаратами, метаболизирующимися ферментами системы цитохрома Р450.
В Японии, где итоприд применяется с 1995 г., он зарекомендовал себя как препарат, характеризующийся хорошей переносимостью и отсутствием серьезных побочных эффектов (тахифилаксия, экстрапирамидные нарушения, гиперпролактинемия), свойственных для большинства прокинетиков. Результаты использования итоприда более чем у 10 млн больных не выявили ни одного случая удлинения интервала Q-T. При назначении препарата в обычных терапевтических дозах повышение уровня пролактина в крови встречается редко.
Noritake M. и соавт. в 1997 г. показана высокая эффективность итоприда при лечении симптомов желудочной диспепсии при ДГП. Подтверждено его достоверное влияние на электромиографическую активность желудка, показано улучшение желудочной эвакуации, подтвержденное сцинтиграфическим методом.
При ДГП также нередко отмечается дисфункция желчного пузыря, проявляющаяся гипокинезией со значительным увеличением его размеров. В работе, оценивавшей эффект Ганатона при дисфункции желчного пузыря, выполненной отечественными авторами [3], показано, что применение препарата в лечении больных с функциональными расстройствами билиарного тракта в течение 2 недель у большинства (78 %) пациентов привело к купированию болевого и диспепсического синдромов и нормализации моторной функции, по данным контрольного ультразвукового исследования.
Нарушение эвакуации содержимого из желудка закономерно способствует учащению патологических гастроэзофагеальных рефлюксов. Поэтому более чем у 40 % пациентов с СД имеют место двигательные дисфункции пищевода, приводящие к гастроэзофагеальной рефлюксной болезни (ГЭРБ).
Проведенные исследования показали, что при терапии ГЭРБ итопридом в комбинации с ингибитором протонной помпы у пациентов происходят достоверное усиление сократительной активности нижнего пищеводного сфинктера, усиление моторной активности желудка, а также ускорение желудочной эвакуация в отсутствие признаков лекарственного взаимодействия.
Итоприд хорошо зарекомендовал себя в комплексной терапии больных ДГП. В исследовании 2008 г. 91 % исследователей расценили эффективность комбинированного препарата итоприда и пантопразола при лечении ДГП как отличную и хорошую [22].
Таким образом, диабетическая гастропатия, сопровождающаяся задержкой эвакуации пищи из желудка, характеризующаяся симптомами желудочно-кишечной диспепсии или гастропареза, является широко распространенным и трудно диагностируемым состоянием, встречающимся почти у половины больных диабетом. Применение гипогликемической, ангио и нейропротективной терапии в большинстве случаев не позволяет нивелировать двигательные дисфункции желудка, в свою очередь препятствующие эффективной коррекции гликемии. Проведенные клинические и постмаркетинговые исследования дают основание рассматривать итоприд (Ганатон) как препарат первой линии в лечении двигательных дисфункций желудка. Итоприд представляет собой эффективный и безопасный прокинетик с антиэметическим эффектом, использование которого у больных ДГП является клинически и патогенетически обоснованным.
Информация об авторах:
Саблин Олег Александрович – доктор медицинских наук, заведующий отделом общесоматическим
и профпатологии Всероссийского центра экстренной и радиационной медицины им. А.М. Никифорова МЧС России.
Тел. (812) 607-59-00 доб.180, e-mail: gastroleg@yandex.ru;
Ильчишина Татьяна Алексеевна – кандидат медицинских наук, врач-терапевт отделения общесоматического
и профпатологии Всероссийского центра экстренной и радиационной медицины им. А.М. Никифорова МЧС России.
E-mail: ita17@mail.ru;
Трофимова Ирина Владимировна – кандидат медицинских наук, заведующая отделением общесоматическим
и профпатологии ФГУЗ Всероссийского центра экстренной и радиационной медицины им. А.М. Никифорова МЧС России.
Тел. (812)596-51-86


