Введение
Острым психотическим эпизодом называют состояние измененного восприятия реальности, которое наступает внезапно и приводит к существенной дезадаптации человека [1]. Эндогенным психотическим эпизодом считается состояние, при котором не выявляется этиологический фактор [1]. Острый психотический эпизод принято рассматривать в рамках эндогенных психических расстройств. Наиболее распространенным из них является шизофрения [1].
В качестве основной терапии острого психотического эпизода у детей и взрослых рекомендованы антипсихотики [2]. Рекомендуется применение минимальных эффективных дозировок антипсихотиков, особенно при первом в жизни психотическом эпизоде [3–4]. Улучшение наступает у 80% пациентов, хотя полная ремиссия вероятна лишь у 30% [5].
Антипсихотики – класс препаратов, действие которых реализуется путем блокады рецепторов дофамина [6]. Выделяют две основные группы антипсихотиков: первой генерации (АПГ) и второй генерации (АВГ). При применении АПГ часто наблюдаются экстрапирамидные симптомы, седация, гипотензия за счет выраженной блокады рецепторов дофамина [7]. АВГ отличаются от них более выраженными метаболическими и гормональными нарушениями [8]. Последнее связано с более широким спектром аффинности: к рецепторам дофамина 1–4-го типов (D1–D4), рецепторам серотонина различных типов (HTR2A, HTR2C, HTR1A, HTR1B и др.) [9].
Многочисленные сравнительные исследования установили, что АПГ сопоставимы по эффективности с АВГ у подростков с расстройствами шизофренического спектра, при этом имеют менее выраженные нежелательные реакции (НР) и меньший процент выбывших из исследований [10]. Стоит отметить, что не выявлено значимых отличий по степени редукции негативной симптоматики между антипсихотиками первой и второй генераций, зато АПГ лучше воздействуют на продуктивные психотические симптомы [11].
Поэтому, несмотря на общую тенденцию заменять АПГ на АВГ в качестве первой линии терапии, применение «старых» препаратов имеет право на существование при лечении психотических расстройств. Но АВГ ввиду их лучшей переносимости рекомендуется рассматривать в первую очередь при лечении детей и подростков [11].
Более 80% детей и подростков испытывают те или иные НР на фоне приема антипсихотиков [11]. Мета-анализы M.R. Stafford et al. (2015) и Y. Bai et al. (2019) продемонстрировали, что дети более склонны к НР на фоне приема антипсихотиков по сравнению со взрослыми [12, 13]. Хорошо иллюстрирует картину безопасности исследование M. Bioque et al. (2016), в котором участвовали пациенты от 7 до 35 лет с первым психотическим эпизодом. У 35% пациентов наблюдалась хотя бы одна НР [14].
С учетом сложностей, связанных с эффективностью и безопасностью антипсихотиков, перспективно развитие персонализированного подбора фармакотерапии. Фармакогенетика на сегодня является наиболее доступной и изученной технологией персонализации.
Фармакогенетика является наукой о влиянии генотипа пациента на эффективность и безопасность фармакотерапии. На сегодня психотропные препараты активно изучаются в фармакогенетических исследованиях. Благодаря этому уже существуют рекомендации по подбору некоторых антипсихотиков и антидепрессантов на основании фармакогенетического тестирования [15]. Но фармакогенетических исследований влияния психотропных препаратов на детей и подростков сравнительно намного меньше, чем у взрослых пациентов [16].
Наиболее актуальные сведения об ассоциациях CYP2D6 с исходами приема антипсихотиков подростками содержит систематический обзор A.A. Maruf et al. (2020) [17]. Основным выводом является доказанное влияние генотипа CYP2D6 на плазменную концентрацию антипсихотиков и риск НР, преимущественно метаболических при приеме рисперидона [17]. Большинство работ, включенных в систематический обзор A.A. Maruf et al. детей с расстройствами аутистического спектра [17].
Учтя явный дефицит фармакогенетических исследований антипсихотиков у подростков с острым психотическим эпизодом, нами было проведено собственное исследование. Его результаты были изложены ранее [18–22].
В настоящей работе предложен алгоритм выбора антипсихотика для подростков с острым психотическим эпизодом на основе результатов фармакогенетического тестирования. Данный алгоритм сформирован нами на основе синтеза полученных результатов и проведения регрессионного анализа.
Методы
Исследование было одобрено заседанием локального Этического комитета ФГБОУ ДПО РМАНПО Минздрава РФ (Протокол № 6 от 13.06.2018).
В исследование был включен 101 подросток с установленным диагнозом «острое полиморфное психотическое расстройство» на момент поступления (F23.0-9, согласно Международной классификации болезней 10-го пересмотра). Включение проводилось в срок от 1 до 3 дней после госпитализации пациента в психиатрическую больницу. Каждый пациент или его законный представитель подписал добровольное информированное согласие на участие в исследовании. Все пациенты идентифицировали себя этнически русскими. Персональные данные, которые позволяют идентифицировать пациента, не были внесены в базы данных.
Критерии включения:
1. Возраст от 12 до 18 лет;
2. Клинически верифицированный острый психотический эпизод;
3. Назначение антипсихотика в качестве основного вида фармакотерапии;
4. Согласие пациента и родителя (законного представителя) на участие в исследовании.
Критерии невключения:
1. Наличие соматического или инфекционного заболевания в состоянии декомпенсации;
2. Положительный результат теста на употребление психоактивных веществ, что указывает на экзогенный характер психотического расстройства;
3. Противопоказания к приему антипсихотиков;
4. Отказ пациента или его родителя (законного представителя) от участия в исследовании.
Наблюдение за пациентами проводилось в течение 14 дней. Оценка психического состояния пациента проходила дважды: на момент включения и на момент окончания периода наблюдения. Безопасность психофармакотерапии оценивалась на 14-й день наблюдения.
Для оценки тяжести психического состояния применялись специальные шкалы: CGAS (Children’s Global Assessment Scale), PANSS (Positive and Negative Symptoms Scale), CGI-S (Clinical Global Impression Severity) и CGI-I (Clinical Global Impression Improvement). Динамические изменения данных шкал использовались для оценки эффективности психофармакотерапии.
Безопасность психофармакотерапии оценивалась при помощи шкал UKU SERS (UKU Side Effects Rating Scale), SAS (Sympson-Angus Scale), BARS (Barnes Akathisia rating scale). Эти шкалы имеют числовые значения: чем выше значение, тем больше выраженность симптомов. Но UKU SERS также позволяет оценивать наличие отдельных неблагоприятных побочных эффектов у пациента.
Исследователь не мог влиять на назначение психофармакотерапии лечащим врачом. Все получаемые пациентом психотропные препараты были учтены в исследовании. Все пациенты получали антипсихотик в качестве основной терапии. Некоторым пациентам дополнительно назначали второй антипсихотик, антидепрессант, нормотимик, антихолинергический препарат или транквилизатор. Подобные случаи рассматривались как полипрагмазия и обязательно учитывались при анализе. Для анализа учитывали суточную дозу антипсихотика, не разделяя один и тот же препарат по пути введения. Дозы антипсихотиков были переведены в хлорпромазиновый эквивалент для унификации дальнейшего анализа. В анализ включались только те лекарственные средства, которые назначались пациенту не менее чем на 3 дня.
От каждого пациента был взят соскоб эпителия внутренней стороны щеки (буккального эпителия) в день включения в исследование с целью генотипирования. Биоматериал замораживали, транспортировали в лабораторию и в дальнейшем хранили при температуре -77°С.
Лабораторная часть исследования проводилась на базе НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава РФ (Москва). Выделение ДНК и генотипирование образцов происходили по мере их поступления в период с 25 апреля 2019 по 15 мая 2020 г. Выделение ДНК из буккального эпителия было проведено сорбентным методом.
Определение полиморфных вариантов генов CYP3A4*22 (rs2740574), CYP3A5*3 (6986A>G, rs776746), CYP2D6*4, *9, *10 (rs3892097, rs4986774, rs1065852), ABCB1 1236C>T (rs1128503), 2677G>T/A (rs2032582), 3435C>T (rs1045642), DRD2 (rs1800497), DRD3 (rs6280, C>T), DRD3 (rs324026, C>T), DRD4 (rs1800955, C>T), HTR2A (rs6313), COMT rs4680 (G>A), ZNF804A rs1344706 (G>T), ANKS1B rs7968606 (C>T) осуществлялось методом полимеразной цепной реакции (ПЦР) в реальном времени с применением коммерческих наборов реактивов (ООО «Синтол»). Оборудование: детектирующий амплификатор CFX96 TouchTM Real-Time PCR Detection System (Bio-Rad, USA).
Генотипы CYP2D6*4, *9, *10 были трансформированы в фенотип пациента согласно консенсусу сообществ CPIC и DPWG (R. van Westrhenen et al., 2020). Носители одной низкоактивной аллели (*4, *9, *10) рассматривались как «промежуточные» метаболизаторы (IM – intermediate metabolizers), носители диплотипов *4/*4, *9/*9 или *4/*10 – как «медленные» метаболизаторы (PM poor metabolizers). Отсутствие у пациента данных аллелей мы расценивали как «нормальную» скорость метаболизма CYP2D6.
Статистическая обработка проводилась в программе SPSS Statistics 21.0. Оценка прогностической значимости фармакогенетических факторов была проведена при помощи регрессионного анализа.
В качестве зависимой переменной при проведении регрессионного анализа использовались параметры эффективности и безопасности фармакотерапии. Ковариатами всегда служили фармакогенетические факторы.
В связи с тем что выборка была относительно небольшой, в модель было недопустимо включать все ковариаты одновременно. Поэтому анализ был разделен – сначала строились модели регресса для фармакокинетических генетических факторов, затем построение моделей повторялось для фармакодинамических маркеров. Применялся шаговый отбор ковариат. Результат анализа представлен как коэффициент β и значение достоверности p. Значение коэффициента β может принимать положительные или отрицательные значения от 0 до 1. Ковариаты всегда были закодированы на два значения: 1 и 2. Под цифрой 2 всегда кодировался полиморфный генотип. Следовательно, если значение зависимой переменной было выше у носителей полиморфного варианта, коэффициент β принимал положительное значение, если же значение переменной снижалось – тогда наоборот. Отдельно следует отметить, что разность балла шкалы PANSS при ее значимом уменьшении на 14-й день – отрицательное число. Значит, отрицательное значение β в этом случае говорит о более выраженной редукции симптоматики у носителей полиморфного генотипа. В случае если для разности балла шкалы PANSS коэффициент β принимает положительное значение, носители полиморфного варианта отличались меньшей редукцией симптомов.
Применялся обратный метод отбора ковариат по Вальду. В качестве зависимых переменных в анализе участвовали «Ответ на фармакотерапию согласно снижению балла шкалы PANSS», «Факт наличия НР по мнению пациента» и «Факт наличия НР по мнению врача». В качестве ковариат поочередно были включены сначала фармакокинетические генетические факторы, затем фармакодинамические.
Результат логистического регресса представлен в виде отношения шансов (ОШ), 95% доверительного интервала (ДИ) и значения достоверности p.
В качестве опорной категории независимой переменной всегда использовался полиморфный генотип, который увеличивает или уменьшает риск наступления исхода.
В результате нами представлены данные только д тех регрессионных моделей, которые продемонстрировали достоверную надежность прогнозирования.
Результаты
Общая информация о выборке была опубликована ранее [18–22].
Основной задачей данного исследования было установление наиболее значимых фармакогенетических предикторов эффективности и безопасности применения антипсихотиков.
В табл. 1 представлены результаты линейного регрессионного анализа. Последовательно была выявлена роль фармакокинетических и фармакодинамических генетических факторов для прогнозирования эффективности и безопасности фармакотерапии.
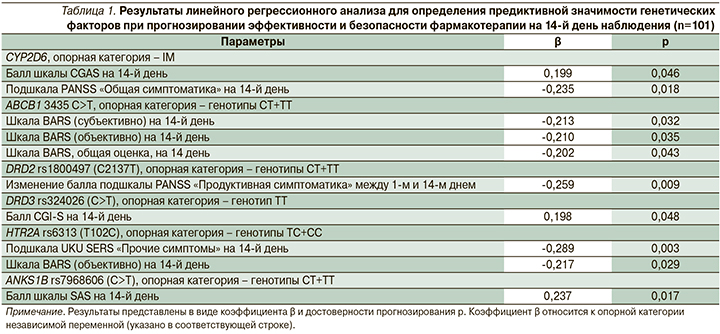
Было установлено, что «промежуточные» метаболизаторы CYP2D6 отличались значимо меньшей выраженностью психотической симптоматики. Положительный коэффициент β для CGAS (β=0,199; p=0,046), а также отрицательный для подшкалы PANSS «Общая симптоматика» (β=-235; p=0,018) подтверждают это. Шкала CGAS при большем своем значении означает лучшую адаптацию пациента, шкала же PANSS интерпретируется иначе: чем выше балл, тем более выражены симптомы психоза. Данная находка логична, поскольку «промежуточный» тип метаболизма CYP2D6 может приводить к большей концентрации субстратов в крови и повышать эффективность терапии.
Другим значимым фармакокинетическим маркером являлся полиморфный вариант ABCB1 3435 C>T. Носители генотипов CT+TT отличались меньшим баллом шкалы акатизии BARS. Данная находка парадоксальна, т.к. носительство полиморфных вариантов ABCB1 должно приводить к меньшей активности белка – транспортера P-gp. Но в то же время регрессионный анализ в данном случае подтвердил результаты гаплотипического анализа: «дикие» генотипы полиморфизмов ABCB1 ассоциированы в нашем исследовании с худшей переносимостью фармакотерапии.
Подтверждено значимое влияние носительства полиморфного варианта DRD2 1800497 на изменение балла подшкалы PANSS «Продуктивная симптоматика»: β=-0,259; p=0,009.
У носителей DRD2 1800497 снижение продуктивной симптоматики на 14-й день было более выраженным.
Носительство полиморфного варианта HTR2A rs6313 сочеталось с меньшей выраженностью НР согласно подшкале UKU SERS «Прочие симптомы» (β=-0,289; p=0,003) и объективной подшкале акатизии BARS (β=-0,217; p=0,029). Таким образом, носительство полиморфного варианта HTR2A rs6313 обладало протективным действием.
Интересный результат показал регрессионный анализ для шкалы SAS. Значимым предиктором увеличения ее балла являлся только полиморфный вариант ANKS1B rs7968606: β=0,237; p=0,017. Следовательно, носительство генотипов CT+TT сочеталось с большим риском антипсихотик-индуцированных экстрапирамидных симптомов.
Логистический регрессионный анализ оценивал вероятность возникновения НР, а также вероятность ответа на фармакотерапию. Результаты представлены в табл. 2.

Пациенты с «промежуточным» метаболизмом CYP2D6 на уровне тенденции к достоверности отличались бόльшим риском наличия любой НР по сравнению с «быстрыми» метаболизаторами.
Полиморфные варианты DRD3 rs6280 и rs324026 также проявили прогностическую значимость: их носительство снижало риск наличия НР у пациента на 14-й день терапии. Также носители DRD3 rs6280 (генотип TT) с меньшей вероятностью могли быть отнесены к ответившим на фармакотерапию согласно уменьшению балла шкалы PANSS.
К результатам стоит отнестись с осторожностью, т.к. большинство значимы лишь на уровне тенденции к достоверности.
На основе проведенного исследования были установлены наиболее значимые фармакогенетические предикторы развития НР у подростков с острым психотическим эпизодом.
Мы предлагаем генотипировать следующие полиморфные варианты: CYP2D6*4, *10, DRD3 rs324026 (аллель C), DRD3 rs6280 (аллель C), HTR2A rs6313 (генотип TT) и ANKS1B rs7968606 (аллель T).
Схема предлагаемого алгоритма по выбору антипсихотика представлена на рисунке.
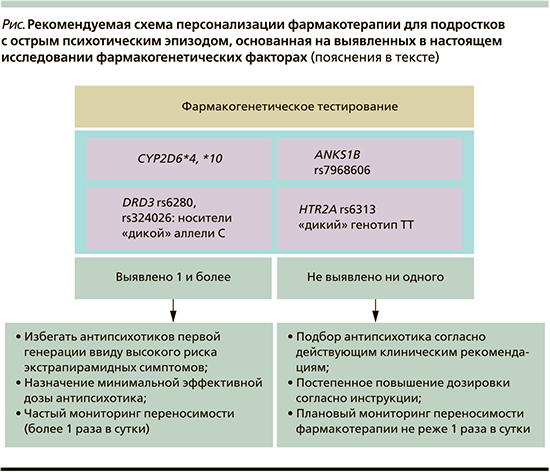
В случае если у пациента выявляется носительство одного или более генетических факторов риска, рекомендовано избегать назначения антипсихотиков первой генерации, придерживаться минимальной эффективной дозы антипсихотика, а также чаще мониторировать переносимость. Следует обращать особое внимание на экстрапирамидные симптомы, которые не исключены даже при приеме антипсихотиков второй генерации.
Минимальная эффективная дозировка антипсихотика не всегда указана в инструкции по применению препарата. Как правило, ее подбирают в процессе медленного увеличения дозы. Минимальная эффективная дозировка антипсихотика предполагает отсутствие или минимальную выраженность НР у пациента при достижении редукции психотической симптоматики.
Мониторинг безопасности фармакотерапии лечащим врачом, согласно действующим стандартам оказания медицинской помощи, осуществляется не реже 1 раза в сутки. Выявление фармакогенетических факторов риска означает, что мониторировать состояние пациента обязательно требуется чаще 1 раза в сутки. Особое внимание следует уделять оценке экстрапирамидных симптомов, акатизии, нарушения мочеиспускания. Данные НР в проведенном нами исследовании выявлялись чаще всего и были значимо ассоциированы с носительством представленных в алгоритме полиморфных вариантов генов.
Приведенный алгоритм позволяет выявлять пациентов, относящихся к группе высокого риска плохой переносимости фармакотерапии. Дать более точные рекомендации по выбору препарата не представляется возможным, поскольку для этого нужны исследования гораздо большего масштаба. Но следует помнить, что сравнение эффективности антипсихотиков между собой не выявило преимуществ какого-либо препарата. Значит, выбор можно осуществлять из всего доступного врачу арсенала, исходя из действующих клинических рекомендаций.
Обсуждение
В результате проведенного исследования предложена прогностическая модель для персонализированного подбора безопасной фармакотерапии подросткам с острым психотическим эпизодом. В нашу прогностическую модель включены те факторы риска, которые были ассоциированы с безопасностью фармакотерапии. По нашему мнению, на первом месте стоит прогнозирование именно безопасности фармакотерапии. Развитие НР может приводить к неприверженности пациента лечению, прерыванию терапии и новым рецидивам с последующей инвалидизацией. Знание о наличии генетической предрасположенности к неэффективности фармакотерапии оказывается полезным после того, как купировано острое состояние. Но на этапе инициации более важным является назначение безопасной фармакотерапии, т.к. в случае развития НР увеличивается срок лечения пациента, могут возникать сложности в связи с заменой лекарства и недоверием пациента к врачу.
Немногочисленные исследования фармакогенетики безопасности антипсихотиков у детей подтверждают значимость изученных нами генетических факторов.
В работе S.A. Jallaq et al. (2021) установлены значимые ассоциации фенотипа CYP2D6 с параметрами безопасности арипипразола у 277 пациентов с аффективными расстройствами [23]. Подтверждено, что промежуточный и медленный метаболизм CYP2D6 увеличивает риск развития гиперпролактинемии и других неблагоприятных побочных эффектов у детей и подростков при приеме рисперидона [24–25] и других антипсихотиков второй генерации [26].
Согласно экспертному мнению J.T. Brown et al. (2021), на сегодня проведено недостаточно фармакогенетических исследований антипсихотиков у детей и подростков, чтобы стала возможной разработка рекомендаций для клинической практики [27]. Вместе с этим авторы выделяют группы риска. Дети более старшего возраста, а также длительно принимавшие антипсихотик без существенного эффекта, более склонны к двигательным расстройствам; напротив, дети помладше, которым антипсихотик назначен впервые, чаще страдают от метаболических нарушений [27].
До настоящего времени не был предложен алгоритм персонализации назначения антипсихотиков подросткам с острым психотическим эпизодом на основе результатов фармакогенетического тестирования.
Разработанный нами алгоритм является первым шагом в развитии персонализированного подхода к повышению эффективности и безопасности фармакотерапии для подростков с острым психотическим эпизодом.
Заключение
Наиболее значимыми предикторами развития НР на фармакотерапию подростков с острым психотическим эпизодом являются полиморфные варианты CYP2D6*4, *10, DRD3 rs324026 (аллель C), DRD3 rs6280 (аллель C), HTR2A rs6313 (генотип TT) и ANKS1B rs7968606 (аллель T).
На основе полученных результатов предложен алгоритм персонализированного подбора антипсихотика для повышения безопасности фармакотерапии.
Требуется проведение новых исследований для уточнения перечня биомаркеров высокого риска непереносимости и фармакорезистентности. Эти находки должны лечь в основу разработки системы поддержки принятия решения по назначению фармакотерапии подросткам с острым психотическим эпизодом.
Финансирование. Исследование выполнено при финансовой поддержке Российского научного фонда, проект № 18-75-00046.



