По данным Международной диабетической федерации (IDF), сахарным диабетом (СД) в мире страдают более 415 млн человек, а к 2040 г. на фоне увеличения средней продолжительности жизни это число возрастет до 640 млн [1]. В общей структуре заболевания до 95% приходится на СД 2 типа (СД2) и 5–7% на СД 1 типа (СД1). При СД1 наблюдается деструкция β-клеток поджелудочной железы, обычно приводящая к абсолютной недостаточности инсулина. В связи с этим единственным способом лечения СД1 остается инсулинотерапия. При СД2 возникает относительная недостаточность инсулина на фоне выраженной инсулинорезистентности. Среди пациентов с СД2 около 20% получают инсулинотерапию в базис-болюсном режиме. Находясь на данном режиме терапии, большинство из них не достигает цели лечения [2]. Это связано с тем, что данный режим введения инсулина сложный для выполнения. Особенно это относится к пациентам старше 65 лет. Кроме того, повышается вариабельность гликемии, которая рассматривается в качестве фактора риска развития диабетических осложнений и гипогликемии [3]. Все это приводит к неблагоприятным клиническим исходам [4], отрицательно влияет на качество жизни пациентов, повышает стоимость лечения [5].
Осуществить подбор адекватной дозы инсулина без контроля гликемии невозможно. При многократных инъекциях инсулина частота проведения самоконтроля должна быть как минимум 4 раза в день. Лишь 19% пациентов c СД1 могут проводить самоконтроль более 6 раз в день в течение 3 дней подряд [6]. Данные рекомендации многие пациенты не выполняют из-за необходимости многократного прокалывания пальцев с целью забора крови для исследования глюкозы. Для некоторых пациентов это достаточно болезненная процедура, приводящая к снижении возможностей проведения постоянного самоконтроля.
В настоящее время существует достаточно доказательств того, что самоконтроль уровня глюкозы крови (СКГ) способствует обеспечению лучшего прогноза СД [4]. Такие исследования, как UKPDS и DCCT, показали, что хороший гликемический контроль, оцениваемый по показателю гликированного гемоглобина (HbA1c), значительно снижает риск микро- и макроваскулярных осложнений. Достижение оптимального уровня гликемии остается ключевой задачей СКГ. Проведение СКГ стимулирует пациентов и лечащих врачей на совместную работу по сбору, интерпретации и использованию полученных данных. Это эффективный способ обучения пациентов управлению своим заболеванием. Лечение СД – длительный пожизненный процесс, в котором должен участвовать как врач, так и пациент. В связи с этим успех проводимого лечения зависит от того, насколько больной может управлять своим заболеванием.
Общепринятым стандартом оценки эффективности терапии является определение HbA1c. Однако он не отражает риска гипогликемии и вариабельности гликемии [5]. Показано, что 30–40% людей с СД1 испытывают в среднем от одного до трех эпизодов тяжелой гипогликемии за год [7]. Особенно опасны ночные гипогликемии, которые составляют примерно половину всех случаев тяжелых гипогликемий [8]. Частые гипогликемические состояния повышают риск развития бессимптомной гипогликемии, нарушений распознавания гипогликемии и тяжелой гипогликемии.
Уменьшение числа гипогликемических эпизодов представляется достаточно реальной задачей. Клинически значимым является уменьшение количества гипогликемий на 30% [9]. Структурированное обучение, индивидуализация целей лечения, СКГ – все это позволяет предотвращать гипогликемии и управлять риском их возникновения. Внедрение в клиническую практику непрерывного мониторинга глюкозы (НМГ) облегчает проведение СКГ и существенно снижает риски гипогликемии [10].
Принимая во внимание постоянно растущие затраты на лечение пациентов с СД, очень важно оценить оправданность и эффективность применения инновационных средств контроля уровня глюкозы крови для разных когорт пациентов. Стандартным подходом к СКГ является использование глюкометров в домашних условиях.
В настоящее время большинство пациентов с СД проводят постоянный СКГ. Однако его качество не всегда соответствует требованиям. Особенно это касается пациентов с СД2. Использование даже самых современных средств СКГ часто не приводит к улучшению гликемии, т.к. полученные результаты не всегда правильно интерпретируются, а коррекция сахароснижающей терапии проводится несвоевременно. Для поддержания адекватного гликемического контроля каждого пациента с СД врач информирует его о целевых уровнях HbA1c, гликемии натощак, постпрандиальной гликемии. Достигнуть целевых параметров глюкозы крови проще при использовании структурированного подхода. Определение гликемии с помощью глюкометра позволяет получать результат в данный момент времени, но не отражает тенденции к ее изменению. Такой СКГ не всегда обеспечивает достаточную информацию о суточных колебаниях глюкозы, не выявляет в полной мере постпрандиальную гипергликемию и гипогликемию, гликемию в ночные часы.
Гипогликемии являются одним из основных факторов, ограничивающих возможность достижения оптимального уровня гликемии у пациентов с СД. Ночные гипогликемии в значительной степени затрудняют подбор дозы инсулина и в большинстве случаев не выявляются обычными способами контроля уровня глюкозы в крови. В связи с этим важное значение приобретает подбор дозы с использованием НМГ. НМГ с помощью Flash мониторинга глюкозы все чаще используется при ведении пациентов с СД на инсулинотерапии [11]. Этот метод позволяет определять уровень глюкозы в подкожной интерстициальной жидкости, а не в капиллярной крови, как при рутинном СКГ с использованием тест-полосок.
В феврале 2017 г. на Конгрессе ATTD (Advanced Technologies and Treatment for Diabetes) группой экспертов был принят Международный консенсус по использованию НМГ.
Ниже приведены наиболее важные положения консенсуса.
- НМГ следует рассматривать как дополнение к определению уровня HbA1c для оценки состояния углеводного обмена у пациентов с СД1 и СД2, получающих инсулинотерапию в базис-болюсном режиме.
- Поскольку высокая вариабельность гликемии является предиктором развития гипогликемии и сопровождается повышенным риском летального исхода, рекомендуется оценивать стандартное отклонение, коэффициент вариации (КВ) и среднюю амплитуду колебаний глюкозы в качестве показателей вариабельности гликемии. КВ является предпочтительным способом и рассчитывается как отношение стандартного отклонения к среднему значению величины, измеряемое в процентах. Гликемия считается стабильной при КВ менее 36% и нестабильной – при КВ более 36%.
- Рекомендовано использовать параметр «time in range» – период нахождения в диапазоне целевых значений гликемии (3,9– 10,0, реже 3,9–7,8 ммоль/л), дающий более достоверную информацию о текущем состоянии гликемического контроля по сравнению с HbA1c. Однако необходимо учитывать, насколько и в какую сторону от нормы отклоняются значения.
- Следует рассчитывать в процентах периоды пребывания в следующих диапазонах: 2-й уровень гипогликемии (менее 3,0 ммоль/л), 1-й уровень гипогликемии (3,9–3,0 ммоль/л); целевые значения (3,9–10,0 или 3,9–7,8 ммоль/л), 1-й уровень гипергликемии (10,0–13,9 ммоль/л), 2-й уровень гипергликемии (более 13,9 ммоль/л). Этот метод очень удобен для оценки эффективности лечения, а также помогает пациентам увидеть, как изменяются частота и выраженность гипо- и гипергликемии на фоне лечения.
- Стоит также выделять блоки времени: период сна (00.00–06.00), пробуждения (06.00–12.00), весь день (00.00–24.00), что позволяет более прицельно проводить коррекцию терапии. Для получения достоверного результата мониторирование следует проводить не менее 14 дней [12].
В клинической практике все чаще используют НМГ с помощью Flash мониторинга (FreeStyle Libre).
К явным преимуществам этого недавно появившегося устройства относятся удобство использования и наглядная, понятная форма представления полученных сведений об уровне глюкозы. Это очень важно для пациентов, получающих интенсивную инсулинотерапию, которым необходим точный и частый контроль гликемии. Требуется определение уровня глюкозы с помощью глюкометра в периоды резких ее колебаний, т.к. уровень глюкозы в интерстициальной жидкости может не соответствовать точному уровню глюкозы в крови, а также в случаях гипогликемии или угрозы гипогликемии, и в случаях, когда симптомы не соответствуют показаниям системы.
По опубликованным в 2015 г. данным регистра больных СД в США, средний уровень HbA1c у 410 пациентов с СД1, получавших инъекции инсулина и использующих НМГ, был сопоставимым с HbA1c у пациентов на помповой терапии, проводящих НМГ (7,6 и 7,7% соответственно), но ниже, чем у пациентов на помповой терапии без НМГ (7,6 против 8,8%; р<0,001) [13]. У пациентов с СД1 Flash мониторинг позволяет улучшать гликемический контроль, уменьшать риски развития кетоацидоза и гипогликемии.
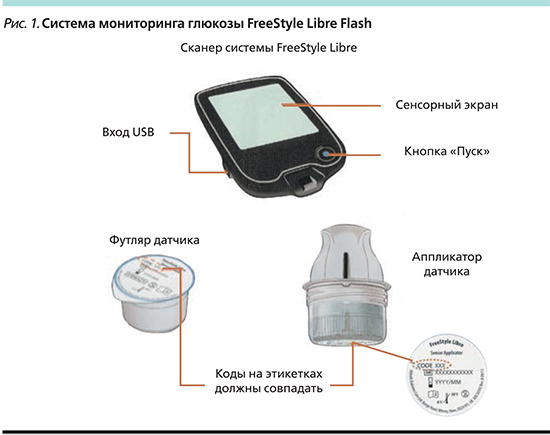
Система FreeStyle Libre состоит из двух компонентов (рис. 1):
- Круглый датчик, 35 мм в диаметре и 5 мм в высоту – крепится на кожу с помощью клейкого основания. Срок использования – 14 дней.
- Сканер с «активным экраном», который нужно подносить к датчику для того, чтобы считать его показания.
При каждом сканировании пользователь одновременно узнает текущее содержание сахара (подобно тесту с помощью глюкометра, только «бескровно») и получает данные о колебаниях гликемии за последние 8 часов. Измерение уровня глюкозы происходит каждую минуту и автоматически сохраняется в памяти устройства. Затем при сканировании эти данные загружаются в сканер FreeStyle Libre. Сканирование происходит через одежду и занимает не более секунды, после чего на экране отображается график и текущее значение гликемии.
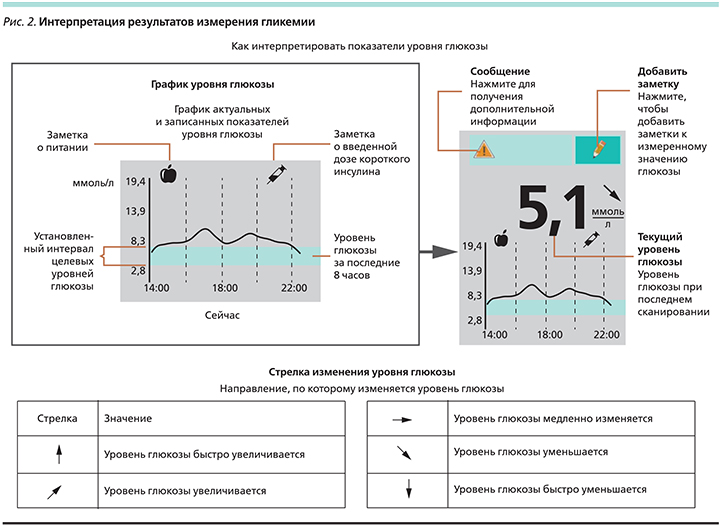
Сведения об интерпретации результатов измерения гликемии представлены на рис. 2.
Эффективность, безопасность и удобство использования FreeStyle Libre по сравнению с традиционным СКГ были оценены в многоцентровом проспективном открытом рандомизированном контролируемом исследовании на популяции пациентов с хорошо контролируемым СД1.
В исследование вошли 328 пациентов с СД1, НbА1с ≤7,5%, прошедшие обучение и владеющие навыками самоконтроля. Критериями исключения являлись нарушения чувствительности к гипогликемии, диабетический кетоацидоз или инфаркт миокарда в предыдущие 6 месяцев, аллергическая реакция на пластырь, использование НМГ, планирование или наличие беременности, терапия стероидами.
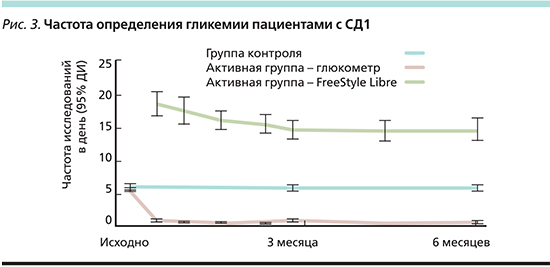
Исходно все больным СД1 на 14-й дней был установлен слепой датчик (не передающий информацию в реальном времени). Затем пациенты были рандомизированы (1:1) в активную группу (мониторинг гликемии датчиком FreeStyle Libre) и группу контроля (мониторинг гликемии традиционным способом). Первичной исходной точкой была оценка длительности гипогликемии (период времени <3,9 ммоль/л) изначально и через 6 месяцев. В конце исследования длительность пребывания в состоянии гипогликемии уменьшилась с 3,38 до 2,03 ч/день (∆ -1,39) в активной группе и с 3,44 до 3,27 ч/день (∆ -0,14) в группе контроля. Т.е. время гипогликемии в активной группе по отношению к контрольной уменьшилось на 38% (p<0,0001). Через 6 месяцев 65% пациентов активной группы по сравнению с 33% пациентов контрольной группы достигли уменьшения времени нахождения в гипогликемическом диапазоне на 30% (p<0,0001). Также в активной группе достоверно сократился процент времени нахождения пациента в гипергликемическом диапазоне (>13,3 ммоль/л) по отношению к контролю. Период времени нахождения пациентов в нормальном диапазоне гликемии (3,9–10,0 ммоль/л) был одинаков в обеих группах. Не было отмечено разницы в индексах вариабельности гликемии, таких как CV – коэффициент вариации (Coefficient of Variation), LBGI – индекс риска гипогликемии (Low Blood Glucose Index), HBGI – индекс риска гипергликемии (High Blood Glucose Index), а также динамики HbA1c. Частота самоконтроля в активной группе уменьшилась с 5,5 исследований в сутки исходно до 0,5 тестов в день в фазе лечения. В реальной клинической практике пациенты, использующие для мониторинга гликемии НМГ, оценивают уровень гликемии с помощью глюкометра 1 раз в 2–5 дней.
В активной группе сканирование датчика проводилось 15,1 раза в день (рис. 3).
Таким образом, использование Flash мониторинга позволяет преодолеть основной барьер в достижении оптимальной гликемии – гипогликемические состояния – и сделать инсулинотерапию более безопасной в зависимости от физиологических потребностей организма [14].
Важность определения гликемии с помощью Flash мониторинга пациентами с СД1 не вызывает сомнений. Для многих пациентов с СД2, проводящих терапию инсулином в режиме многократных инъекций или с помощью инсулиновой помпы, Flash мониторинг станет важной опцией самоконтроля.
Эффективность НМГ оценивалась в мультицентровом открытом рандомизированном контролируемом исследовании в течение 6 месяцев у пациентов с СД2, получавших интенсивную инсулинотерапию (из них 5% вводили инсулин с помощью инсулиновой помпы). Аналоги инсулина использовали 78% пациентов. В исследовании приняли участие 224 человека, из которых 149 – вошли в группу НМГ, а 75 человек (контрольная группа) проводили СКГ традиционным способом. Группы были сопоставимыми по возрасту, массе тела, длительности СД, дозам вводимого инсулина, частоте самоконтроля гликемии. Все пациенты проходили базовый курс обучения. В качестве первичной конечной точки оценивали уровень HbA1c, вторичной – длительность гипогликемических эпизодов, удовлетворенность самоконтролем, а также оценивали влияние возраста на уровень HbA1c.
В конце исследования не было отмечено достоверной разницы в снижении уровня HbA1c между группами: -0,29±0,07 и -0,31±0,09% соответственно (p=0,8222). У больных с СД2 в возрастной группе старше 65 лет отмечали более значимое снижение уровня HbA1c в группах НМГ (p=0,0301) и контроля (p=0,0081).
В группе НМГ длительность пребывания в состоянии гипогликемии, с гликемией <3,9 ммоль/л было на 43% меньше (p=0,0006), с гликемией <3,1ммоль/л – на 53% меньше (p=0,0014), а с гликемией <2,5 ммоль/л – на 64% меньше (p=0,0013), чем в контрольной группе. Длительность эпизодов ночных и дневных гипогликемий уменьшилась в группе НМГ по сравнению с контролем (p=0,0001 и p=0,0374 соответственно). Вариабельность гликемии также была ниже в группе НМГ.
Интересные данные были представлены по частоте проведения тестов. Так, было отмечено, что число проведений тестирования с помощью глюкометра в группе НМГ снизилось с 3,8±1,4 до 0,4±1,0 тест/сут к концу исследования. Общая частота мониторинга глюкозы в крови в течение 6 месяцев составила в группе пациентов на НМГ 0,3±0,7 тест/сут. Частота сканирования датчика составила 8,3±4,4 раз в день, т.е. в 2 раза больше, чем частота проведения мониторинга гликемии с помощью глюкометра (рис. 4).

Не было выявлено различий в частоте сканирования датчика у пациентов разных возрастных групп. Также не найдено корреляционной зависимости между частотой сканирования датчика и длительностью нахождения пациента в состоянии гипогликемии или уровнем HbA1c. Частота контроля гликемии у пациентов контрольной группы не менялась в процессе исследования (исходно 3,9±1,5 тест/сут с медианой 3,9; через 6 месяцев 3,8±1,9 тест/сут с медианой 3,9). Анализ подгрупп пациентов до и старше 65 лет показал достоверно более редкое тестирование пациентов в возрасте до 65 лет (2,78±1,08 против 3,6±0,94 тест/сут, p=0,0247).
При анализе динамики изменения суточной дозы инсулина различий между группами отмечено не было.
В группе пациентов на НМГ исходно она составляла 87,6±44,0 ЕД, а через 6 месяцев 85,2±39,7 ЕД, в группе контроля – 90,1±40,6 и 87,8±41,5 ЕД соответственно (p=0,9059). Между группами также не было отмечено различий в динамике массы тела. У пациентов группы НМГ имела место более высокая удовлетворенность проводимым лечением и отмечалось лучшее качество жизни. Технические проблемы с Flash монитором были зарегистрированы у 4% пациентов (эритема, зуд, высыпания в местах крепления датчика) [15].
М.М. Gernay (2019) исследовал возможности поддержания гликемического контроля, время нахождения в гипогликемическом диапазоне, динамику массы тела, а также удовлетворенность проводимым лечением пациентов с СД при использовании системы FreeStyle Libre.
В исследовании, проведенном с мая по октябрь 2017 г., приняли участие 645 человек, использующих НМГ, и 193 пациента, проводящих обычный СКГ. В группе пациентов, использовавших НМГ, было показано снижение уровня НbА1с на 0,15±0,07% после 15 месяцев наблюдения. Снижение уровня НbА1с чаще отмечалось у пациентов с его исходным уровнем выше 7,5%.
В группе пациентов, отметивших улучшение гликемического контроля, наблюдалось повышение индекса массы тела. Пациенты, совершавшие больше сканирований в день, имели лучшие показатели гликемического контроля, также у них отмечалась меньшая частота и продолжительность гипогликемических состояний. Пациенты продемонстрировали высокий уровень удовлетворенности лечением при использовании технологии НМГ [16].
F. Campbell et al. продемонстрировали снижение среднего уровня НbА1с с 8,4 до 6,3% (p<0,05) с одновременным статистически значимым снижением частоты гипогликемических состояний у 102 больных с СД в возрасте от 4 до 19 лет при использовании технологии НМГ. При этом снижение частоты гипогликемических состояний отмечалось у пациентов и с хорошим, и c плохим гликемическим контролем [17].
Точность системы НМГ была изучена у 11 больных с СД2 в условиях стационара по сравнению с СКГ перед приемами пищи и перед сном. Было продемонстрировано, что согласно сетки ошибок наблюдения, 65,44% значений НМГ попадали в зону А, а 96,5% значений в зону А и Б.
Согласно сетки ошибок Кларка, 58,8% значений находились в зоне А и 98,0% в зоне А и Б. MARD составил 18,99+7,24%, коэффициент вариации – 33,94+10,54 [18].
В исследовании A. Laurenzi было продемонстрировано, что в течение 8 недель использования системы НМГ у пациентов с СД1 не отмечалось снижения уровня НbА1с. При этом имело место увеличение времени нахождения в целевом диапазоне (Time in Range 70–180 мг/дл), но только у пациентов, с продолжительностью заболевания менее 12 лет (p=0,037). При анализе опросников качества жизни отмечено статистически значимое повышение удовлетворенности лечением (p=0,0026), снижение страха гипогликемии (p=0,0145) и улучшение распознавания гипогликемий (p=0,0463) [19].
Таким образом, применение Flash мониторинга пациентами с диабетом 1 и 2 типов, использующих инсулин, приводит к существенному снижению количества и длительности гипогликемических эпизодов, уменьшению вариабельности гликемии, улучшению качества жизни и лечения, без увеличения уровня НbA1с и изменения дозы инсулина. Использование НМГ не сопровождалось техническими проблемами с оборудованием [20]. С помощью НМГ можно подобрать дозу инсулина в зависимости от физиологической потребности организма.
Дополнительная информация
Обзор подготовлен по инициативе авторов. Все авторы участвовали в подготовке, критическом пересмотре и утверждении окончательного варианта рукописи.



