Актуальность
По данным МНИОИ им. П.А. Герцена, представленным в 2017 г., распространенность злокачественных новообразований полости рта (С01 – 09; 46,2) в 2016 г. составила 26,7 случая на 100 тыс. населения России, что имеет некоторую тенденцию к росту по сравнению, например, с тем же показателем 2011 г. – 23,1 случая. Распространенность злокачественных новообразований глотки (С10 – 13) и гортани (С32) также имеет тенденцию к повышению: распространенность поражений глотки с 2011 до 2016 г. возросла с 10,1 до 11,7 случая на 100 тыс. населения, гортани – с 28,4 в 2006 г. до 30,3 случая в 2016-м [1].
Абсолютные показатели заболеваемости говорят, что в 2016 г. выявлен 8991 случай злокачественных новообразований слизистой оболочки полости рта, 5277 первичных случаев поражения глотки и 6870 случаев поражения гортани. Смертность же на первом году с момента установления диагноза составила 34,0% в случае опухолей полости рта, 41,0% – при поражении глотки и 23,6% – при поражении гортани. Иными словами, выживаемость этой группы пациентов уже в первые 12 месяцев после установления диагноза не превышает 70% [1].
Согласно проведенному анализу, практически треть пациентов рассматриваемой когорты первично обращаются за медицинской помощью, уже имея IV стадию заболевания, т.е. местнораспространенный процесс, при котором первичная опухоль слизистой оболочки полости рта, глотки или гортани распространяется в смежные анатомические области или имеются нерезектабельные регионарные метастазы, следовательно, вопрос о радикальном, в т.ч. и хирургическом, лечении поставлен быть не может, а выбирая тактику лечения данных пациентов, мы говорим только о попытке или паллиативном характере терапии.
Другим крайне важным аспектом, когда мы говорим о выживаемости больных злокачественными новообразованиями органов головы и шеи, является крайне высокий показатель рецидивирования опухоли – практически 50% даже после полного комплексного лечения, проведенного по существующим стандартам.
А примерно у 10% пациентов при первичном обращении по результатам проведенного обследования регистрируются отдаленные метастазы, свидетельствующие о диссеминации процесса, что также исключает возможность проведения радикального лечения.
Принципы лечения
Так что же нам говорят стандарты? Какую тактику лечения выбрать для пациентов с местнораспространенным, метастатическим или рецидивирующим процессами с целью не только увеличения показателя общей выживаемости (ОВ) больных, но и по меньшей мере сохранения, а в лучшем случае – и улучшения исходного качества жизни больного?
Лечение местнораспространенного рака органов головы и шеи. Выбор тактики лечения местнораспространенного процесса в полости рта, глотки или гортани – сложная и крайне ответственная задача для клинициста, поскольку именно от этого выбора будет зависеть судьба больного и его выживаемость. Существующие на сегодняшний момент американские и европейский стандарты говорят о безусловном предпочтении включения пациентов данной когорты в международные клинические исследования с включением современных новейших препаратов, однако доступность этих исследований на сегодняшний момент невелика и большая часть пациентов получают лечение в рамках ранее разработанных подходов и тактик [2].
Наиболее эффективным подходом к лечению местнораспространенного процесса в области органов головы и шеи является конкурентная химиолучевая (ХЛТ) или индукционная химиотерапия (ХТ) с последующей лучевой или конкурентной химио-лучевой терапией, в том случае когда невозможно проведение радикального хирургического лечения [2].
О попытках добавления цитостатических агентов к лучевой терапии пациентов с опухолями органов головы и шеи известно еще с 1961 г., когда специалистами Университета Висконсина доложены результаты рандомизированного исследования, в котором продемонстрировано достоверное улучшение показателей локорегионального контроля и ОВ у пациентов с плоскоклеточным раком органов головы и шеи, которые получали болюсные инфузии 5-фторурацила в сочетании с лучевой терапией, по сравнению с группой пациентов, получавших только лучевую терапию [3]. Подобные результаты были доложены F. Sanchiz et al., которые сравнили результаты лечения пациентов, получавших только лучевую терапию до дозы 60 Гр, с группой пациентов, к лучевой терапии которых было добавлено введение 5-фторурацила, что привело к достоверному увеличению выживаемости [4].
А вот добавление к лучевой терапии блеомицина не улучшило достоверно ни показатели выживаемости пациентов, ни частоту объективного ответа (ЧОО), о чем свидетельствуют результаты исследований EORTC (Northern California Oncology Group Trial и European Organization for Research and Treatment of Cancer) в 1987–1988 гг. [5, 6].
В 1983 г. ECOG (European Cooperative Oncology Group) представили результаты сравнения использования цисплатина в дозе 20 мг/м2 еженедельно в сочетании с лучевой терапией пациентов с местнораспространенными новообразованиями слизистой оболочки органов головы и шеи по сравнению только с лучевой терапией. Но, к сожалению, увеличения ОВ пациентов при использовании данной схемы в ходе анализа зарегистрировано не было [7].
В 1990 г. RTOG (Radiation Therapy Oncology Group) провели рандомизированное исследование сравнения результатов лечения пациентов с местнораспространенным плоскоклеточным раком органов головы и шеи, в котором пациенты были рандомизированы в три группы: только лучевая терапия, лучевая терапия в сочетании с еженедельным введением низких доз цисплатина и лучевая терапия в сочетании с введением высоких доз цисплатина каждые 3 недели. Безусловный выигрыш по ОВ получили пациенты, получавшие высокие дозы цисплатина 1 раз в 3 недели в сочетании с лучевой терапией [8].
В 2003 г. D.J. Adelshtein et al. представлены окончательные результаты рандомизированного исследования, проведенного Intergoroup (ECOG и Southwest Oncology Group – SWOG). В данном исследовании 295 больных местнораспространенным плоскоклеточным раком органов головы и шеи были рандомизированы в 3 группы. Пациенты первой группы получали только лучевую терапию в конвенциональном режиме, вторая группа получала такую же лучевую терапию в сочетании с введением цисплатина в дозе 100 мг/м2 1 раз в 3 недели, третья группа – расщепленный курс лучевой терапии в сочетании с конкурентным введением цисплатина с 5-фторурацилом. Окончательный анализ достоверно показал, что пациенты, получившие лучевую терапию в сочетании с высокими дозами цисплатина, вводимого 1 раз в 3 недели, имели достоверно бóльшую ОВ. А вот разницы в эффективности между группой высокодозного цисплатина в сочетании с лучевой терапией и группой лучевой терапии с комбинацией цисплатина и 5-фтор-урацила выявлено не было. Однако добавление 2 цитостатиков в дополнение к лучевой терапии однозначно достоверно увеличивает токсичность лечения, что и привело к необходимости проведения расщепленного курса лучевой терапии этой группы пациентов [9].
В 1999 г. G. Calais et al. впервые представили, а в 2004 г. F. Denis et al. обновили результаты рандомизированного исследования 226 пациентов с местно-распространенным плоскоклеточным раком органов головы и шеи, в котором одна группа пациентов получала только лучевую терапию (35 фракций до СОД – суммарная очаговая доза = 70 Гр), вторая группа пациентов ХЛТ с аналогичным режимом лучевой терапии и параллельным проведением 3 циклов (1 раз в 21 день) ХТ с использованием карбоплатина в дозе 70 мг/м2 в 1-й день в/в капельно и 5-фторурацила в дозе 600 мг/м2 с 1-й по 4-й дни цикла. Окончательный анализ показал достоверный выигрыш в общей 5-летней выживаемости в группе ХЛТ – 22% по сравнению с 16% в группе только лучевой терапии [10, 11].
К сожалению, несмотря на выраженную эффективность конкурентной химиолучевой терапии, подобные схемы обладают выраженной токсичностью, как гематологической, так негематологической, что приводит к необходимости откладывания циклов ХТ, расщепления курса лучевой терапии вплоть до прекращения лечения. Развитие выраженных мукозитов или дисфагии с нарушением нутриционного статуса пациента в ряде случаев приводит к необходимости наложения гастростомы, что дополнительно осложняет и ухудшает общее состояние пациента и качество его жизни [12].
Еще в 2001 г. F. Robert et al. представили результаты лечения 15 больных местнораспространенными опухолями органов головы и шеи, которым проводилась лучевая терапия на фоне еженедельных введений цетуксимаба. У 13 пациентов из 15 после проведенного лечения достигнут объективный ответ, причем у 11 пациентов ответ был полным. Кроме объективного ответа авторы оценили 1-годичную и 2-летнюю выживаемость этих пациентов, и она составила 73 и 65%. Данное небольшое исследование послужило некоей основой для дальнейшего исследования комбинации ингибитора рецепторов эпидермального фактора роста в сочетании с лучевой терапией пациентов с плоскоклеточным раком органов головы и шеи [13].
Чуть позже, в 2005 г., Y. Su et al. проанализировали эффективность добавления цетуксимаба к конкурентной ХЛТ в стандартном режиме с использованием цетуксимаба 22 пациентами со злокачественными новообразованиями органов головы и шеи. Проведенный авторами анализ позволил говорить о 56% 3-летней безрецидивной выживаемости (БРВ) пациентов, получивших данную комбинацию, и ЧОО в 75% случаев [31].
В 2006 г. опубликованы результаты масштабного исследования J. Bonner, в котором проанализированы результаты лечения 424 пациентов с III и IV стадиями плоскоклеточного рака органов головы и шеи, 213 из которых получали только лучевую терапию, в схему лечения других 211 пациентов был введен цетуксимаб в стандартных дозировках (нагрузочная доза – 400 мг/м2 с последующим еженедельным его введением в дозе 250 мг/м2) в дополнение к лучевой терапии. В результате добавления цетуксимаба достоверно увеличился показатель 3-летнего локо-регионального контроля: 47% в группе с цетуксимабом по сравнению с 34% в группе только лучевой терапии (р=0,005), а также показатель 5-летней ОВ, который в группе с цетуксимабом составил 46%, в группе только лучевой терапии – 36% (р=0,018) [14].
 Еще одной опцией для лечения местнораспространенного рака органов головы и шеи является сочетание индукционной ХТ с последующей лучевой или ХЛТ. Данный протокол лечения был предложен для лечения рака гортани, основной целью которого было сохранение органа и его функций.
Еще одной опцией для лечения местнораспространенного рака органов головы и шеи является сочетание индукционной ХТ с последующей лучевой или ХЛТ. Данный протокол лечения был предложен для лечения рака гортани, основной целью которого было сохранение органа и его функций.
Еще в 1991 г. Veterans Affairs Laryngeal Cancer Study Group, а в 1996 г. EORTC и J.L. Lefebvre говорили о роли индукционной ХТ для проведения органосохранного лечения рака гортани, улучшая выживаемость с сохранением органа по сравнению с ларингэктомией [15, 16]. Однако сравнение режима с индукционной ХТ только с лучевой терапией или конкурентной ХЛТ не показало достоверной разницы в ОВ данной когорты пациентов. Об этом свидетельствуют результаты исследования RTOG 91-11, доложенные в 2003 г.: группа пациентов (n=173), получавшая индукционную ХТ в режиме PF (цисплатин 100 мг/м2 в 1-й день+5-фторурацил 1000 мг/м2 24-часовая инфузия с 1-й по 4-й дни) с последующей конкурентной ХЛТ с цисплатином в дозе 100 мг/м2 в 1-й, 22 и 43-й дни курса лучевой терапии, не имела выигрыша в 5-летней ОВ, составившей 55% по сравнению с группой только лучевой терапии (n=173; 5-летняя ОВ составила 56%) или группой конкурентной ХЛТ (n=172: цисплатин в дозе 100 мг/м2 в 1-й, 22 и 43-й дни курса лучевой терапии) – 54% [17].
В 2013 г. доложены результаты еще одного исследования – TREMPLIN, в котором проанализированы результаты лечения 153 больных раком гортани III и IV стадий, получавших в рамках индукционной ХТ 3 цикла ХТ в режиме TPF (доцетаксел, цисплатин, 5-фторурацил) каждые 3 недели, с последующей рандомизацией в 2 группы. Первая группа в рамках 2-го этапа лечения получила конкурентную терапию (до СОД=70 Гр) с цисплатином в дозе 100 мг/м2 каждые 3 недели, вторая группа – лучевую терапию в аналогичном режиме и еженедельные введения цетуксимаба в стандартных дозировках нагрузочной и последующих доз. Первичной конечной точкой было сохранение гортани, достигнутое в 95 и 93% случаев соответственно, но не имевшее достоверной разности. ОВ также достоверно не различалась в обеих группах – 92 и 89%. Результаты этого исследования убедительно показывают, что введение в схему конкурентной ХЛТ цетуксимаба позволяет достигать достоверно схожих с цисплатином показателей ОВ, а также показателей сохранения органа и его функций. Еще одним важным аспектом является тот факт, что те пациенты, которые получали цетуксимаб в сочетании с лучевой терапией, имели более мягкий профиль острой токсичности (за исключением кожных поражений) по сравнению с пациентами, получавшими цисплатин [18].
Таким образом, использование цетуксимаба в сочетании с лучевой терапией пациентов с местнораспространенным плоскоклеточным раком органов головы и шеи не только сопоставимо по эффективности с использованием стандартных режимов лечения с цитостатиками, но и гораздо легче переносится пациентами, что позволяет соблюдать временные рамки, дозирование лекарственных препаратов и фракций лучевой терапии, а также использовать данный режим терапии больных, имеющих противопоказания к введению химиотерапевтических агентов, и пациентов старших возрастных групп.
Клинический случай 1
Пациентка С.Ф.Д. 77 лет считала себя больной с сентября 2016 г., когда впервые отметила наличие незаживающей язвы в области слизистой оболочки альвеолярной части нижней челюсти справа под базисом съемного протеза, быстро увеличивающейся в размерах.
Впервые за медицинской помощью пациентка обратилась в октябре 2016 г.
Пациентка осмотрена специалистом по заболеваниям органов головы и шеи, выявлено наличие объемного инфильтративно-язвенного процесса в области альвеолярной части нижней челюсти справа с распространением на слизистую оболочку дна полости рта справа, преддверие рта справа, ткани нижней губы и подбородочной области справа.
17.10.2016 под местной анестезией произведена инцизионная биопсия образования слизистой оболочки альвеолярной части нижней челюсти слева, верифицирован высокодифференцированный плоскоклеточный рак с элементами ороговения (Grade 1).
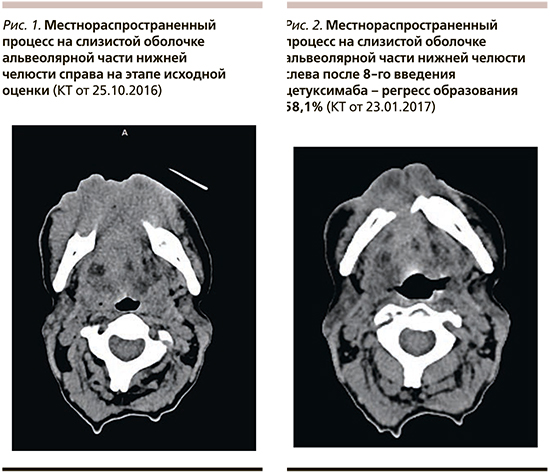
Больной проведено комплексное обследование: выполнено компьютерное томографическое (КТ) исследование органов груди и живота, данных за метастатическое поражение не получено. По данным КТ челюстно-лицевой области и шеи выявлено образование альвеолярной части нижней челюсти справа с распространением на ткани дна полости рта справа, инфильтрацией тканей подбородочной области справа (рис. 1).
Таким образом, у пациентки диагностирован местнораспространенный плоскоклеточный рак слизистой оболочки альвеолярной части нижней челюсти справа, T4bN2aM0.
С учетом удовлетворительного общего состояния (статус по шкале ECOG=1), гистологической верификации процесса, местнораспространенного характера образования в полости рта, удовлетворительных клинико-лабораторных показателей, отсутствия выраженной сопутствующей патологии, существующих стандартов пациентке начат курс лучевой терапии на линейном ускорителе с использованием методики 3D-CRT на фоне терапии цетуксимабом. Первая нагрузочная доза цетуксимаба 400 мг/м2 в/в капельно введена 31.10.2016 – за 1 неделю до начала лучевой терапии. Далее, с 7.11.2016 по 22.12.2016 (7 недель) проводился сочетанный курс лучевой терапии с еженедельным введением цетуксимаба в дозе 250 мг/м2 в/в капельно. Всего за курс облучения к зоне очага подведена СОД=70 Гр, к зоне путей регионарного лимфати-ческого оттока – СОД=50 Гр. Курс проводился без перерывов.
 Максимальный эффект терапии – частичный ответ опухоли с регрессом=58,1% от исходных размеров (рис. 2).
Максимальный эффект терапии – частичный ответ опухоли с регрессом=58,1% от исходных размеров (рис. 2).
Достоверных признаков прогрессирования процесса до 01.04.2018 не выявлено. Пациентка жива. ОВ (от момента постановки диагноза) составляет 18 месяцев.
В ходе регистрации нежелательных явлений проводимой терапии зарегистрирована кожная сыпь 1-й ст., хорошо купированная местными антисептическими средствами.
Проведение ХЛТ с использованием в качестве системного агента ингибитора рецепторов эпидермального фактора роста цетуксимаба позволило в данном случае не только провести полный курс лечения пациентки старшей возрастной группы с максимальным эффектом, но и минимизировать негативное воздействие терапии, что выражалось в отсутствии необходимости расщепления курса лучевой терапии или коррекции дозы лекарственного препарата, тем более его отмены. Выбор подобной тактики терапии однозначно привел к увеличению БРВ и ОВ пациентки, а также – к улучшению качества ее жизни за счет значительного уменьшения выраженности (вплоть до исчезновения) болевого синдрома в области опухолевого образования, повышения ее нутритивного статуса за счет нормализации процесса приема пищи, а также улучшения внешнего вида больной, что позволило ей проявлять нормальную социальную активность.
С учетом имеющейся сейчас доказательной базы цетуксимаб включен и в Российские клинические рекомендации RUSSCO (Российское общество клинической онкологии), и в рекомендации Ассоциации онкологов России в тактике лечения местнораспространенного рака органов головы и шеи.
Согласно обновленным рекомендациям RUSSCO 2017 г. «альтернативным вариантом лечения местно-распространенного плоскоклеточного рака органов головы и шеи может быть одновременное с лучевой терапией (ЛТ) назначение цетуксимаба (400 мг/м2 за неделю до начала ЛТ, далее – по 250 мг/м2 еженедельно в процессе ЛТ), что обеспечивает увеличение общей продолжительности жизни и улучшает локорегионарный контроль по сравнению с ЛТ, но не увеличивает токсичность» [19].
Согласно рекомендациям Ассо-циации онкологов России 2017 г., «цетуксимаб может быть предпочтительным вариантом в силу меньшей токсичности после индукционной ХТ в дозе 400 мг/м2 за неделю до начала лучевой терапии и 250 мг/м2 еженедельно во время проведения ЛТ. Уровень убедительности рекомендаций – 2B (уровень достоверности доказательств Ia)» [20].
Лечение рецидивирующего/метастатического плоскоклеточного рака органов головы и шеи. С учетом частоты рецидивирования опухолей органов головы и шеи около 50% даже после комплексного лечения и частоты регистрации первичного диссеминированного процесса с наличием отдаленных метастазов порядка 10% лечение этой когорты пациентов также представляет актуальную задачу современной клинической онкологии.
В 2008 г. J.B. Vermorken et al. опубликованы первые результаты рандомизированного клинического исследования III фазы EXTREME, в котором участвовали 442 пациента с рецидивирующим/метастатическим раком органов головы и шеи. Пациентов рандомизировали в 2 группы, одна из которых (n=220) получала стандартную терапию в режиме цисплатин или карбоплатин+5-фторурацил в стандартных дозировках, вторая группа (n=222) в дополнение к аналогичной цитостатической терапии получала еженедельные инфузии цетуксимаба, начиная с нагрузочной дозы. Оценка первичной конечной точки (ОВ) подтвердила достоверное увеличение этого показателя в группе пациентов, получавших в схеме лечения ингибитор рецептора EGFR (epidermal growth factor receptor): 10,1 месяца по сравнению с 7,4 месяца [21]. В 2008 г. представлены, в 2010 г. опубликованы уточненные результаты, свидетельствующие о том, что у пациентов, получавших цетуксимаб, ЧОО составила 36% – иными словами, опухоль каждого 3-го пациента ответила на терапию. Причем стабилизация процесса выявлена у 45,5% больных, частичный ответ – у 28,8%, а у 6,8% пациентов был зарегистри-рован полный ответ опухоли на лечение [21].
Анализ острой токсичности выявил отсутствие значимого увеличения частоты нежелательных явлений, в т.ч. и 3/4-й степени, при введении в схему лечения цетуксимаба в дополнение к ХТ в режиме PF [12].
Кроме того, авторы обращают наше внимание на то, что проведение лечения рецидивирующего/метастатического рака органов головы и шеи по схеме цетуксимаб+PF с последующей монотерапией цетуксимабом до регистрации прогрессирования или возникновения непереносимой токсичности по сравнению только с ХТ в режиме PF достоверно увеличивает ОВ и БРВ (10,1 против 7,4 месяца ОВ и 5,6 против 3,3 месяца БРВ), значимо повышает ЧОО опухоли на лечение (более трети пациентов ответили на лечение – ЧОО составила 36%) и ощутимо облегчает симптомы заболевания без ухудшения, в большинстве случаев – с улучшением качества жизни больных [12, 21].
Дальнейшие попытки улучшить результаты протокола EXTREME заставляют исследователей модифицировать или схему ХТ, или режим дозирования или введения цетуксимаба. Так, например, в 2018 г. H. Fuchs et al. представили результаты пилотного исследования, в котором группа пациентов (n=38) получала режим: цисплатин 50 мг/м2+доцетаксел 50 мг/м2+цетуксимаб 500 мг/м2, каждые 2 недели.
Проведенный анализ определил, что показатель ОВ пациентов составил 10,8, БРВ – 6,3 месяца [22]. Однако говорить сегодня о модификации схем введения цетуксимаба в сочетании с ХТ еще преждевременно, поскольку эти данные должны быть подтверждены результатами многоцентровых рандомизированных исследований.
Клинический случай 2
Пациент Е.А.Ю., мужчина 64 лет, считал себя больным с ноября 2015 г., когда впервые отметил появление незаживающей язвы на слизистой оболочке правой щеки, быстро увеличивающейся в размерах.
За медицинской помощью пациент впервые обратился в декабре 2015 г. Пациент был осмотрен специалистом по заболеваниям органов головы и шеи, при осмотре выявлен инфильтративно-язвенный процесс на слизистой оболочке правой щеки размером 27×20 мм.
С целью верификации процесса больному под местной анестезией произведена инцизионная биопсия образования слизистой оболочки полости рта и выявлен умеренно дифференцированный плоскоклеточный рак (Grade 2).
Больному произведено комплексное обследование, в результате которого у пациента диагностирован плоскоклеточный рак слизистой оболочки щечной области справа, T2N1M0. С учетом удовлетворительного состояния пациента (статус по шкале ECOG=1), гистологической верификации, удовлетворительных клинико-лабораторных показателей, существующих стандартов пациенту проведена ХЛТ (январь–март 2016 г.): курс лучевой терапии на линейном ускорителе с использованием методики 3D-CRT на фоне терапии цисплатином 100 мг/м2 в/в капельно в 1-й, 22 и 43-й дни курса лучевой терапии на фоне симптоматической терапии. К зоне первичного очага на слизистой оболочке щеки справа подведена СОД=70 Гр, к зоне путей регионарного лимфатического оттока – СОД=50 Гр. На фоне проводимого лечения достигнут полный регресс опухоли. Пациент переведен в режим динамического наблюдения.
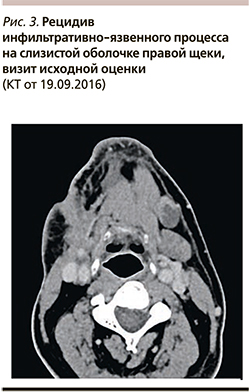
В сентябре 2016 г., через 7 месяцев после завершения ХЛТ первичной опухоли, зарегистрировано прогрессирование заболевания в области тканей щеки справа. Пациент дообследован: 14.09.2016 верифицирован местный рецидив плоскоклеточного рака слизистой оболочки правой щеки с поражением лимфатических узлов на шее справа (рис. 3).
С учетом удовлетворительного состояния пациента (статус по шкале ECOG=1), гистологической верификации рецидива заболевания, удовлетворительных клинико-лабораторных показателей, существующих стандартов с 22.09.2016 начат 1-й цикл лекарственного лечения 1-й линии в режиме протокола EXTREME: цетуксимаб в нагрузочной дозе 400 мг/м2 в/в капельно в 1-й день с дальнейшим еженедельным введением в дозе 250 мг/м2 в/в капельно начиная с 8-го дня. Цетуксимаб применялся в комбинации с цисплатином 100 мг/м2 в/в капельно в 1-й день; 5-фторурацилом 1000 мг/м2 в/в капельно, 24-часовые инфузии с 1-го по 4-й день (S тела=2,0 м2).
Пациенту проведено 6 циклов ХТ в режиме PF с интервалом в 21 день на фоне еженедельных введений цетуксимаба. После завершения цитостатической терапии с 12.01.2017 продолжены еженедельные инфузии цетуксимаба в дозе 250 мг/м2 в/в капельно.
Максимальный эффект терапии – частичный ответ (по критериям RECIST 1.1) достигнут после 3-го цикла лечения: регресс таргетного очага в области щеки справа и лимфатических узлов шеи справа составил 63,7% (рис. 4).
В декабре 2017 г. по результатам контрольного КТ-исследования от 17.12.2017 зарегистрировано прогрессирование заболевания: отмечен рост образования в области щеки справа и появление метастатического поражения легких.
Таким образом, выживаемость без прогрессирования пациента составила 15 месяцев от момента верификации рецидива опухоли и начала терапии с использованием цетуксимаба.
Опухоли слизистой оболочки щеки имеют неблагоприятный прогноз течения, хуже реагируют на терапию, например, по сравнению с опухолями орофарингеальной зоны. Но проведение терапии 1-й линии с применением цетуксимаба позволило практически в 2 раза увеличить БРВ, купировать неблагоприятные проявления болезни и не ухудшить качество его жизни токсичностью вводимых препаратов. Именно такая тактика лечения позволила ему вести образ жизни, максимально приближенный к его состоянию до болезни, работать и вести активный образ жизни.
Обсуждение
Несмотря на то что прогноз выживаемости данной когорты пациентов крайне неблагоприятный – пациенты редко проживают более 7–9 месяцев, введение в схему лечения таргетного агента с целью блокирования рецепторов эпидермального фактора роста позволяет не только увеличить БРВ и ОВ, но и улучшить качество их жизни за счет купирования симптомов заболевания (боль, дисфагия и т.п.) на фоне лечения цетуксимабом.
С учетом данного факта цетуксимаб включен в рекомендации RUSSCO 2017 г. для лечения больных рецидивирующим и метастатическим плоскоклеточным раком органов головы и шеи как в комбинации с ХТ в режиме PF или DP, так и в монотерапии в рамках 1-й линии лечения [19].
Клинические рекомендации Ассоциации онкологов России 2017 г. для рецидивирующих неоперабельных опухолей головы и шеи или при наличии отдаленных метастазов также предлагают рассматривать цетуксимаб в сочетании с ХТ как один из равноценных вариантов выбора терапии [20].
Заключение
Проведенный нами анализ безусловно подтверждает, что поиск оптимальной тактики лечения местнораспространенного и рецидивирующего/плоскоклеточного рака органов головы и шеи считается актуальной задачей современной клинической онкологии в связи с возрастающим уровнем заболеваемости и сохраняющимся крайне высоким уровнем смертности от этой патологии.
В связи с этим для любого клинициста, занимающегося лечением пациентов с данной патологией, крайне важным вопросом является выбор оптимальной тактики лечения, которая позволит уменьшить опухолевое образование и улучшить качество жизни пациента.
К сожалению, как стандартная терапия с использованием препаратов платины в индукционном режиме и в сочетании с ЛТ, так и трехкомпонентные цитостатические схемы ХТ (например, TPF) имеют неудовлетворительную переносимость. В связи с этим фактом данное лечение не может быть назначено всем пациентам с опухолями органов головы и шеи, как правило, имеющим сниженный общий статус или побочные явления самого заболевания.
Кроме того, на современном этапе развития представлений о лечении злокачественных новообразований головы и шеи большинство ученых и клиницистов склоняются к проведению органосохранного (консервативного) лечения, которое не только позволяет сохранить сам орган (например, такой значимый комплекс, как гортань), но и его функцию.
Именно поэтому поиск таргетных агентов для лечения пациентов этой когорты остается весьма актуальным вопросом современной клинической онкологии.
Эффективность использования цетуксимаба в лечении опухолей органов головы и шеи (как первичных, так и рецидивирующих/метастатических форм) несомненна, что подтверждается результатами не только многочисленных международных исследований, но и нашим клиническим опытом использования этого ингибитора EGFR в течение многих лет.
Благодаря мягкому профилю токсичности цетуксимаб может быть с успехом использован в комплексном лечении пациентов старших возрастных групп, ослабленных пациентов или пациентов, имеющих противопоказания к введению таких агрессивных цитостатиков, как препараты платины.
Введение в схему стандартного химиотерапевтического или лучевого лечения больных плоскоклеточным раком органов головы и шеи таргетных агентов (в частности, ингибитора рецепторов EGFR цетуксимаба) не только позволяет увеличить ОВ и БРВ пациентов данной когорты, но и по меньшей мере не ухудшает, а в большинстве случаев улучшает качество жизни наших пациентов за счет уменьшения объема опухоли и исчезновения негативных симптомов заболевания.



