Введение
Плоскоклеточные карциномы языка и слизистой оболочки дна полости рта представляют собой генетические нарушения, связанные с факторами экологического риска, а также с чрезмерным употреблением алкоголя и табака. Данная патология занимает 6-е место среди всех злокачественных новообразований [1]. Чаще всего поражается язык, за ним следует дно полости рта. Исследования показали, что опухоли на этом участке имеют прогноз хуже, чем на других участках полости рта, что приводит к более низким показателям выживаемости. Следовательно, рак языка и слизистой оболочки дна полости рта имеет более высокий уровень смертности по сравнению с другими видами злокачественных новообразований [2].
Согласно мировой базе данных Globocan, в мире всего за 2018 г. зарегистрировано 354 864 случая заболеваемости и 177 384 случая смертности от данной патологии [3]. Более половины пациентов на момент постановки диагноза имеют местнораспространенный процесс, в то время как около 2% больных исходно имеют отдаленное метастазирование.
Радикальная хирургия остается основным методом лечения пациентов с плоскоклеточным раком полости рта. Определение биомаркеров, связанных как с восприимчивостью к плоскоклеточному раку полости рта, так и с прогнозом его течения, – это важный подход, который может улучшить результаты лечения. Последние достижения в области молекулярной биологии продемонстрировали, что мутации, такие как одиночный нуклеотидный полиморфизм соответствующих генов, могут влиять на риск и прогноз многих злокачественных новообразований.
К тому же понимание пути онкогенеза привело к успешной разработке некоторых таргетных препаратов на мировом рынке [4].
За последние десятилетия было установлено, что многочисленные онкогены проявляют свою активность при различных видах опухолей вследствие генетических изменений в виде мутаций, амплификации, перестройки и т.д. Эти мутантные онкогены часто играют ключевую роль в развитии злокачественного процесса. Данный факт в значительной степени подготовил почву для открытия таргетной противоопухолевой терапии. Наиболее успешным примером служат ингибиторы протеинкиназ, продемонстрировавшие клинические преимущества в лечении различных видов опухолей [5–6].
RAS является одним из наиболее часто мутирующих онкогенов при различных опухолях, но частота и распределение мутаций гена RAS неоднородны. Мутации, наиболее часто встречающиеся в гене KRAS, происходят в основном в кодонах 12, 13 или 61. Также эти мутации встречаются в кодонах 63, 117, 119 и 146, но с меньшей частотой [7].
Известно, что дикий тип гена KRAS проявляет функцию подавления роста опухоли при мутантном типе. KRAS дикого типа является антагонистом онкогенного типа KRAS, что приводит к неэффективной клеточной трансформации и снижению опухолевой нагрузки при некоторых злокачественных новообразованиях. Считается, что KRAS дикого типа оказывает свою ингибирующую рост функцию через нисходящие медиаторы или активацию параллельных сигнальных путей [8–9].
Геномный анализ в онкологической практике позволяет разработать более точные клинические лабораторные тесты, которые будут иметь большое значение для персонализированной фармакотерапии. Традиционные подходы, основанные на биопсии, ограничены возможностью получения образцов тканей для выявления резистентности опухоли к той или иной терапии. Геномное профилирование на основе исследования плазмы крови (т.н. жидкостная биопсия) – важная составляющая для мониторинга опухолевых геномов и может дополнять традиционную биопсию. Опухоль-ассоциированные мутации могут быть идентифицированы во внеклеточной ДНК из образцов крови пациента и использованы для мониторинга активности заболевания [10].
Известно, что EFGR почти в 100% случаев экспрессируется при плоскоклеточной карциноме полости рта. Белок KRAS известен как важная нижестоящая молекула сигнального пути EGFR, таким образом, мутации или полиморфизмы KRAS могут играть важную роль в прогнозировании эффективности лечения плоскоклеточного рака полости рта [4, 11–12].
RAS является первым человеческим онкогеном, обнаруженным Ши и Вайнбергом в начале 1980-х гг. KRAS – один из трех представителей семейства онкогенов RAS. Активация онкогена KRAS участвует в канцерогенезе многих раковых заболеваний человека, включая плоскоклеточный рак полости рта, а подавление KRAS может подавлять рост злокачественных клеток и повышать их чувствительность к химиотерапии (ХТ) [13].
Цетуксимаб представляет собой высокоспецифичное химерное антитело иммуноглобулина G1 (IgG1) против внеклеточного домена EGFR. Помимо блокирования EGFR цетуксимаб может влиять на иммунные клетки с последующей активацией антителозависимой клеточной цитотоксичности, что приводит к большему уничтожению опухолевых клеток [14, 15]. Частой причиной резистентности к моноклональным антителам служит активация нижележащих сигнальных путей, в частности, в белке RAS, что сопровождается резистентностью к анти-EGFR-терапии. Известно, что механизмы устойчивости к цетуксимабу опосредуются как внутриклеточным сигнальным механизмом в опухолевых клетках (клеточно-автономных), так и секретируемыми факторами клеток в микроокружении опухоли (TME) [9]. Несмотря на массу данных, подтверждающих EGFR как терапевтическую мишень при плоскоклеточном раке органов головы и шеи, частота ответа на терапию цетуксимабом при данной нозологии не столь высока [16] и резистентные к терапии опухоли возникают у большинства пациентов, получавших цетуксимаб [17].
Выявление путей, отвечающих за устойчивость к цетуксимабу, остается актуальной задачей.
Целью исследования стало определение активирующих мутаций в гене KRAS во внеклеточной ДНК плазмы крови больных плоскоклеточным раком языка и слизистой оболочки дна полости рта при проведении либо ХТ с таргетной терапией цетуксимабом либо стандартной ХТ без таргетного воздействия на этапах лечения.
Методы
Был применен метод цифровой капельной полимеразной цепной реакции (ПЦР).
Были также использованы система QX200 (Bio-Rad) и набор ddPCRtm KRAS Screening Multiplex Kit. Система включает два прибора с соответствующим программным обеспечением, расходными материалами и реагентами, состоящая из генератора капель QX200: использует запатентованные реагенты и микрофлюиды для разделения образцов на капли нанолитрового объема в количестве 20 тыс. штук и ридера капель QX200 после ПЦР-амплификации нуклеиновой кислоты-мишени в каплях, данный прибор по отдельности анализирует каждую каплю с помощью двуцветной системы определения (настроенной на определение FAM, VIC, HEX или EvaGreen); производится подсчет ПЦР-положительных и ПЦР-отрицательных капель для проведения абсолютного количественного анализа ДНК-мишени в цифровой форме с помощью программного обеспечения QuantaSoft™ [18].
В исследование были включены данные, полученные от 60 пациентов, лечившихся в отделении противоопухолевой лекарственной терапии № 1 ФГБУ «НМИЦ онкологии» Минздрава России с диагнозом «плоскоклеточный рак языка и слизистой оболочки дна полости рта» со степенью распространенности опухолевого процесса T3-4N0-1M0. Все больные были разделены на две группы – основную и контрольную. В основную группы вошли 30 пациентов, которым была проведена ХТ по схеме цисплатин 100 мг/м2 внутривенно в 1-й день, 5-фторурацил 1000 мг/м2/сут., 96-часовая непрерывная инфузия в сочетании с таргетной терапией цетуксимабом 250 мг/м2, еженедельные введения (нагрузочная доза – 400 мг/м2). Контрольную группу составили также 30 пациентов, которым была проведена стандартная ХТ без цетуксимаба. Средний возраст больных составил 60–65 лет. Преимущественно по степени дифференцировки встречался умеренно-дифференцированный плоскоклеточный рак. В подавляющем большинстве это были лица мужского пола: в основной группе 79% мужчин и 21% женщин, в контрольной – 72,7% мужчин и 27,3% женщин. В зависимости от эффективности проведенного лечения больные основной и контрольной групп были поделены на две подгруппы: с чувствительностью к лечению, которая включала частичную регрессию и стабилизацию процесса, и с резистентностью – прогрессированием заболевания. Оценка эффективности лечения производилась согласно критериям RECIST 1.1 (response evolution criteria in solid tumors). Всем больным до начала противоопухолевого лечения и после двух циклов производился забор крови в два этапа объемом 9 мл.
Путем двойного центрифугирования выделялась плазма. Все образцы внеклеточной ДНК были выделены из плазмы крови, согласно протоколу, с помощью набора cobas cfDNA Sample Preparation Kit [19].
Концентрация выделенных препаратов ДНК доведена до 2 нг/мл. Методом Digital Droplet PCR с использованием набора KRAS Screening Multiplex kit (Bio-Rad, USA) детектировали наличие/отсутствие 7 активирующих мутаций во втором экзоне гена KRAS в образцах внеклеточной ДНК, выделенных из плазмы крови пациентов.
ПЦР-реакцию проводили из смеси готовых ПЦР-миксов по схеме 2х ddPCR Supermix for Probes (no dUTP) 10 мл и 20х multiplex primers/probes (FAM+HEX) 1 µLмл на один образец плюс 9 мл ДНК в концентрации 2 нг/мл.
Миксы тщательно перешивались и осаживались на вортексе. Готовый ПЦР-микс в объеме 20 мл для каждого образца переносили в картридж для генерации капель DG8. В среднюю лунку помещали образец в объеме 20 мл, в нижнюю – масло в объеме 70 мл. После этого картридж помещали в Droplet Generator QX200 на 2 минуты для генерации капель. Затем получившуюся масляную эмульсию в объеме 40 мл (для каждого образца) переносили в 96-луночную ПЦР-планшету [201].
Проводили ПЦР до конечной точки (~40 циклов) при помощи термоциклера.
Для прочтения образцов загружали планшету в ридер капель QX200 и запускали программу. Ридер забирает каждый образец, разделяет капли и по одной направляет их позади двуцветного детектора. Ридер считывает каждую каплю и определяет, какие из них содержат мишень (+) по каналу FAM MT, а какие нет (-) по каналу HEX WT.
Анализ полученных данных проводили с помощью программного обеспечения QuantaSoft v1.7.4. Программное обеспечение QuantaSoft предоставляет полный набор инструментов для подготовки и присваивания имени образцу, работы и управления прибором и анализа результатов. Также программное обеспечение определяет «положительные» и «отрицательные» капли в каждом образце и представляет в графическом виде покапельное изменение флуоресценции: доля положительных/отрицательных капель в образце определяет концентрацию мишени в копиях/мкл [18] (рис. 1).
Технология Digital Droplet PCR не позволяет получать данные в реальном времени, а выдает результаты по числу событий в каждом образце: прямое число мутантных копий ДНК по каналу FAM и прямое число копий ДНК дикого типа по каналу HEX (задано набором KRAS Screening Multiplex kit).
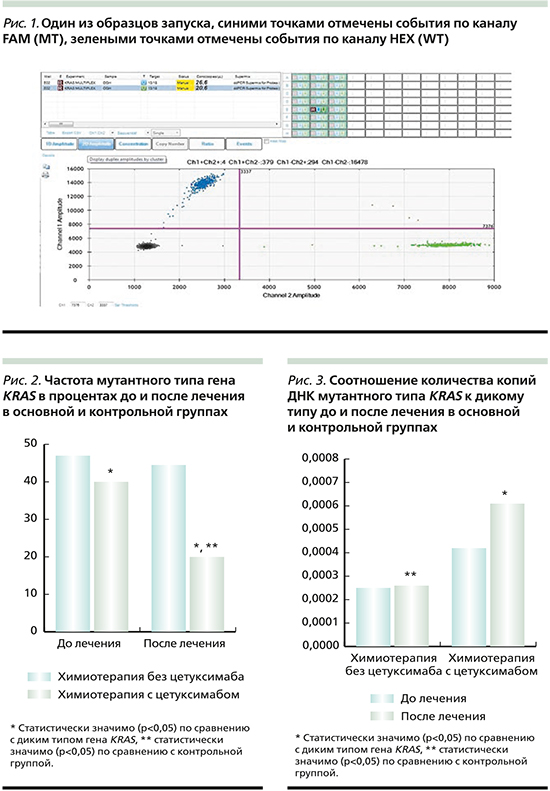
Результаты
В ходе исследования обнаружено, что при выборке из 60 пациентов до начала противоопухолевого лечения частота мутантного типа KRAS составляла 43%, после лечения – 32%.
В основной группе частота встречаемости мутантного типа KRAS составляла 40%, после проведения лекарственного лечения – 20%. В контрольной группе цифры распределились следующим образом: до начала ХТ частота встречаемости мутантного типа KRAS составляла 47 и 43% после лечения (рис. 2). Обнаружено статистически значимое снижение на 20% (p=0,00089) частоты встречаемости мутантного типа KRAS после проведения ХТ и цетуксимаба, при этом она на 23% (p=0,00009) была ниже частоты встречаемости мутантного типа KRAS после ХТ без цетуксимаба (контрольная группа).
До начала лечения все больные имели примерно одинаковое соотношение числа копий мутантного типа KRAS к дикому типу (р=0,08). После ХТ и цетуксимаба среднее число копий ДНК мутантного типа повысилось в 1,5 раза (р=0,084), а относительно контрольной группы оно было в 2,3 раза меньше (р=0,04) (рис. 3).
Лечение цетуксимабом приводило к увеличению соотношения числа копий ДНК мутантного типа KRAS к дикому типу, а также к снижению частоты мутаций в гене KRAS. Данный факт можно объяснить тем, что с помощью цифровой капельной ПЦР возможно определение мутаций, даже если они представлены в небольшом числе опухолевых клеток. У части больных в результате лечения наблюдался регресс опухоли в той или иной степени и как следствие – снижалось число циркулирующих опухолевых клеток. Снижение числа циркулирующих опухолевых клеток способствовало снижению титра мутантной ДНК в плазме крови, следовательно, снижалась и частота обнаруженных мутаций.
После проведенного лечения в зависимости от эффективности больные распределились следующим образом: в основной группе, где применялись цетукисимаб и ХТ, чувствительными оказались 19 пациентов, резистентными – 11. Перед началом лечения фоновые значения в обеих подгруппах были различными. Так, у больных, чувствительных к лечению, соотношение мутантного типа к дикому типу KRAS в 1,8 раза меньше (р=0,04), а частота мутантного типа в подгруппе с чувствительностью была в 1,7 раза меньше относительно подгруппы с резистентностью (р=0,009) (рис. 4).
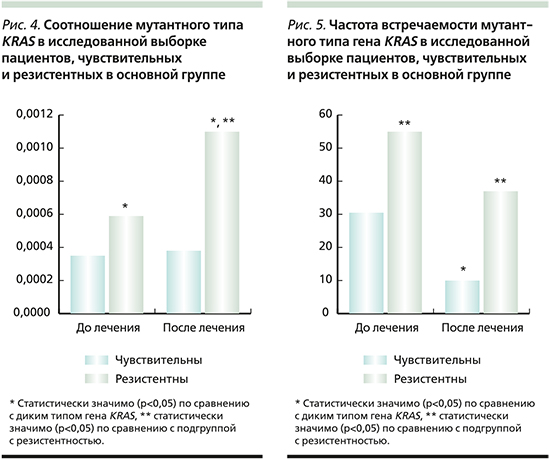
После проведенного лечения при возникновении чувствительности в основной группе не было выявлено изменений соотношения мутантного типа KRAS (а) относительно фоновых значений, а частота встречаемости мутантного типа KRAS в данной выборке уменьшилась в 3 раза (р=0,009). При возникновении резистентности соотношение мутантного типа KRAS относительно фона увеличилось в 1,9 (р=0,09), а при сравнении с подгруппой с чувствительностью – в 3,1 раза (р=0,049). Что касается частоты встречаемости мутантного типа KRAS, то она сократилась в 1,5 раза (р=0,05), а если сравнивать с подгруппой больных, чувствительных к данной терапии, увеличилась в 3,5 раза (р=0,0045) (рис. 5) [21].
Итак, та часть больных, оказавшихся резистентными к ХТ и цетуксимабу, еще до начала лекарственного лечения характеризовались повышенной встречаемостью мутаций в гене KRAS, следовательно, большим числом опухолевых клеток, несущих эти мутации. Использование цетуксимаба привело к тому, что несколько изменилась направленность эволюции клеток: в подавляющем большинстве случаев это привело к увеличению числа клеток, несущих мутантные копии гена KRAS, а в некоторых случаях это привело к снижению.
Что касается контрольной группы пациентов, получавших только стандартную ХТ, чувствительными к лечению из 30 пациентов оказались 12 (40%) человек, а резистентными – 18 (60%). Следует отметить: как до начала лечения, так и после него больные обеих подгрупп статистически значимо не различались ни по соотношению мутантного типа к дикому типу гена KRAS, ни по частоте мутантного типа (рис. 6–7).
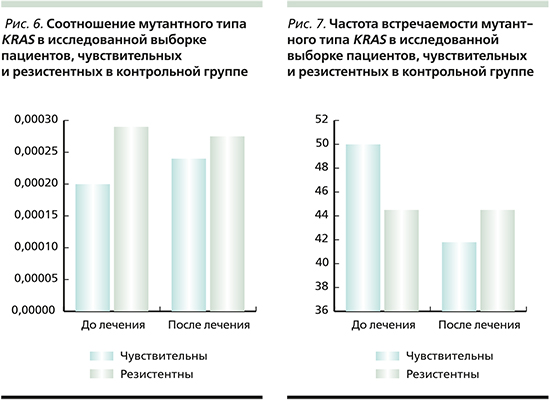
ХТ без цетуксимаба не оказывало влияния на статус мутаций в гене KRAS, и ее эффективность также не зависела от частоты и соотношения мутанного типа KRAS к дикому типу.
Обсуждение
Поиск биомаркеров, ответственных за резистентность к тем или иным препаратам, – актуальная проблема современной онкологии. Основными стратегиями в терапии злокачественных новообразований являются целенаправленный подход к воздействию на опухоль, а также определение персонального молекулярно-генетического профиля для каждого пациента.
В последнее время многие исследования по профилированию генома позволили получить представление о молекулярном профиле для многих типов опухолей. Более глубокое понимание этих генетических изменений и их функциональных последствий привело к открытию новых терапевтических возможностей. Хотя исследование биопсийного материала больных служит «золотым» стандартом, оно имеет определенные ограничения: биопсия тканей является инвазивной процедурой, несущей определенный риск осложнений, и может не представлять всю опухоль из-за лежащей в ее основе генетической гетерогенности. В этом контексте альтернативой может служить минимально-инвазивная т.н. жидкостная биопсия, позволяющая проводить молекулярный мониторинг в режиме реального времени. Фрагменты циркулирующей внеклеточной ДНК высвобождаются из тканей как здоровых людей, так и онкологических больных. Фракция внеклеточной ДНК, которая высвобождается из первичных опухолей или метастатических очагов, т.е. циркулирующая опухолевая ДНК, представлена генетическими аберрациями в опухолевых клетках – потенциальных источниках диагностических и прогностических биомаркеров. Недавние исследования продемонстрировали техническую возможность ее выполнения и клиническое применение, включая обнаружение лекарственных мишеней и мутаций резистентности, а также мониторинг пациентов с опухолями, получавших ту или иную терапию [22, 23]. Данный метод является щадящим и доступным как для врача, так и для пациента. Так, например, FDA (Food and Drug Administration) недавно одобрило первый такой тест «жидкостной биопсии» для определения мутации EGFR у пациентов с немелкоклеточным раком легкого (НМРЛ). Такие неинвазивные методы позволяют идентифицировать специ-фические мутации резистентности, такие как EGFR T790M, у пациентов с НМРЛ, получавших гефитиниб. Более универсальным подходом, основанным на геномной нестабильности, является анализ структуры хромосомных аберраций путем секвенирования всего генома с низким охватом. Увеличение и потеря хромосомных областей были обнаружены в плазме опухолеспецифичной внеклеточной ДНК как аберрации числа копий, которые могут быть использованы для вычисления показателя нестабильности числа копий генома (CNI) во внеклеточной ДНК. Специфический индекс CNI, полученный путем массивного параллельного секвенирования, отличал пациентов с раком предстательной железы (ПЖ) как от здоровых лиц, так и от мужчин с доброкачественными заболеваниями ПЖ. Кроме того, аберрации генов андрогенных рецепторов во внеклеточной ДНК были связаны с терапевтической резистентностью при метастатическом кастрационно-резистентном раке ПЖ. Было показано, что изменение показателя CNI служит ранним предиктором ответа на стандартную ХТ при различных других типах рака (например, НМРЛ, колоректальный рак, протоковая аденокарцинома поджелудочной железы). Было также показано, что CNI предсказывают терапевтический ответ на иммунотерапию. Серийное геномное профилирование позволяет обнаруживать мутации резистентности за 16 недель до рентгенологического прогрессирования [10]. Молекулярные механизмы, лежащие в основе клинической резистентности к цетуксимабу у больных плоскоклеточным раком полости рта, до сих пор не выяснены. При метастатическом колоректальном раке механизмы резистентности гораздо лучше изучены и включают мутации в нижестоящих сигнальных молекулах EGFR, таких как RAS. Конститутивная сигнализация RAS опосредована мутациями, предотвращающими гидролиз GTP, тем самым блокируя RAS в активном состоянии независимо от вовлечения EGFR. По этой причине опухоли толстой кишки, несущие активирующие мутации RAS, не отвечают на анти-EGFR-терапию, поэтому противоопухолевое лечение ингибиторами EGFR назначается при диком типе гена RAS [24, 25]. Однако при плоскоклеточном раке головы и шеи первичные мутации RAS довольно редки. F. Braig et al. в своем исследовании показали, что в результате проведенного лечения цетуксимабом больных плоскоклеточным раком головы и шеи выявлены приобретенные мутации в генах KRAS, NRAS и HRAS более чем у трети пациентов в результате проведения жидкостной биопсии. Из них у 46% пациентов с прогрессированием заболевания на фоне лечения цетуксимабом обнаружены приобретенные мутации RAS, в то время как у больных, чувствительных к данной терапии, их обнаружено не было. Этот факт указывает на то, что приобретение мутантных клонов генов RAS достоверно коррелировало с клинической резистентностью. Появление мутаций предшествовало прогрессированию у половины больных, причем максимальное время обнаружения мутации до клинического прогрессирования составило 16 недель. Мутации в гене RAS объясняют приобретенную резистентность к анти-EGFR-таргетной терапии у значительной части больных, даже несмотря на то что эти опухоли исходно редко мутируют. Жидкостная биопсия может быть использована для мониторинга мутационного статуса в режиме реального времени и тем самым при необходимости своевременно изменять схему лечения [26].
Выводы
Основными стратегиями в терапии злокачественных новообразований являются целенаправленное таргетное воздействие на опухоль, а также определение персонального молекулярно-генетического профиля для конкретного пациента. Лучшее понимание механизмов передачи сигналов и молекулярной структуры различных генов поможет определить молекулярно-ориентированную терапию для пациентов. Подытоживая вышесказанное, можно сделать следующий вывод: выполнение молекулярно-генетического тестирования с целью определения активирующих мутаций в гене KRAS путем выделения внеклеточной ДНК из плазмы крови позволяет прогнозировать развитие резистентности к цетуксимабу и своевременно менять тактику лекарственной терапии на этапах лечения.
Источник финансирования. НИР согласно по госзаданию.



