Введение
Индуцированные химиотерапией тошнота и рвота (ИХТР) являются ее частым побочным эффектом, который негативно воздействует на качество жизни пациентов со злокачественными новообразованиями и может приводить к необходимости снизить дозировку или прекратить применение химиопрепаратов. Появление новых противорвотных препаратов резко изменило ситуацию в области ИХТР. В 1970-е гг. распространенным при наличии тошноты было длительное пребывание в стационаре [1]. В 1979 г. рандомизированное исследование, которое включило пациентов со злокачественными новообразованиями, показало, что число лиц, у которых на фоне химиотерапии возникает рвота, составляло 83% [2]. Спустя два десятилетия после появления новых противорвотных средств наблюдательное исследование показало, что острые тошнота и рвота возникают у 35% пациентов, получающих терапию с высоким эметогенным потенциалом, и 13% лиц, которые получают умеренноэметогенную терапию [3].
В настоящий момент следование рекомендациям по применению противорвотных средств приводит к достижению наилучшего результата в профилактике тошноты и рвоты [4–6] и пациенты могут быстро вернуться к повседневным делам после курса лечения [7–9]. В результате качество жизни пациентов со злокачественными новообразованиями улучшается и адекватный контроль ИХТР помогает избегать снижения дозировки химиопрепаратов и прекращения терапии. Эти достижения признаны при всемирном опросе, проведенном американским онкологическим обществом в 2014 г., когда противорвотная терапия была отнесена к числу «5 важнейших достижений современной онкологии» (http://www.asco.org/research-progress/cancer-progress/top-5-advances-modern-oncology). Основываясь на патогенезе развития ИХТР, для ее профилактики используются в основном три класса лекарственных средств: антагонисты 5HT3-рецепторов серотонина, глюкокортикоиды и антагонисты NK1-рецепторов [10]. Важнейшим инструментом противорвотной терапии в острой фазе (первые 24 часа от начала химиотерапии) служат ингибиторы серотониновых рецепторов. Первое поколение этих препаратов включает такие лекарственные средства, как ондансетрон, доласетрон, гранисетрон и трописетрон. В 2003 г. Американское управление по контролю за качеством лекарственных и пищевых продуктов (FDA) разрешило использование антагониста серотониновых рецепторов второго поколения, палоносетрона, для профилактики тошноты и рвоты, ассоциированной с высокоэметогенной химиотерапией и химиотерапией умеренной степени эметогенности [11].
Палоносетрон отличается от антагонистов 5НТ3-рецепторов I поколения принципиально более длительным периодом полувыведения – 40 часов (для сравнения: у ондансетрона – 4 часа, у гранисетрона – 9), самым высоким сродством (аффинностью) – к рецепторам серотонина за счет отличной от других 5HT3-антагонистов структурной формулы, что определяет аллостерический тип связывания палоностерона с рецепторами (препараты I поколения имеют конкурентный с серотонином тип связывания), интернализацией рецепторов: связываясь с палоносетроном, рецептор погружается в клетку и блокирует его на более длительное время (под действием ондансетрона и гранисетрона этого вообще не происходит). Также палоносетрон обладает уникальной способностью косвенно ингибировать опосредованный ответ субстанции Р.
Палоносетрон является первым препаратом данного класса, одобренным для профилактики как острой, так и отсроченной тошноты и рвоты, вызванных умеренноэметогенной терапией [12]. Три регистрационных исследования III фазы были выполнены для сравнения палоносетрона с ингибиторами серотонина первого поколения [11].
В двух исследованиях использовали аналогичный дизайн «неменьшей эффективности» (non-inferiority), в них было показано, что палоносетрон позволяет добиваться значимо более высокой частоты полной ремиссии ИХТР как в острой фазе (палоносетрон по сравнению с ондансетроном: 81 и 69%; р=0,008; палоносетрон по сравнению с доласетроном: 63 и 53%; р=0,049), так и в отсроченной (палоносетрон по сравнению с ондансетроном: 74 и 55%, р<0,001; палоносетрон по сравнению с доласетроном: 54 и 39%; р=0,021). Третье исследование (однократная внутривенная доза палоносетрона) не выявило значимых различий с контрольной терапией, однако значительно большая частота полной ремиссии наблюдалась в группах, получивших одновременно с палоносетроном дексаметазон, по сравнению с группой, получившей ондансетрон и дексаметазон в отсроченном периоде (42 против 29%; р=0,029). В крупном японском исследовании сравнивали палоносетрон и гранисетрон у пациентов, получавших высокие дозы цисплатина или антрациклины с фосфамидом [13]. Частота полной ремиссии в острой фазе была схожей в двух группах, тогда как в отсроченной фазе она значимо чаще наблюдалась в группе, получавшей палоносетрон (57 против 45%; р<0,001). Еще два исследования [14, 15] показали, что использование палоносетрона позволяет сокращать время назначения дексаметазона, уменьшив его с 3-дневного режима до однодневного. Как отмечают Decker и соавт. [16], значимо большее число пациентов, получавших палоносетрон, отметили ослабление влияния тошноты на качество жизни в остром периоде и тошноты и рвоты на качество жизни в отсроченном периоде.
Согласно данным Oyama и соавт. [17], 78,6% пациентов с раком желудка, принимавших комбинированную противорвотную терапию палоносетроном, дексаметазоном и апрепитантом, сохраняли качество жизни на прежнем уровне, даже несмотря на проводимую высокоэмитогенную терапию комбинацией нового перорального аналога 5-фторурацила (S-1) и цисплатина.
Мета-анализ использования палоносетрона в профилактике ИХТР [18], базировавшийся на данных восьми исследований, включивших 3592 пациента, показал, что по сравнению с антагонистами серотониновых рецепторов I поколения палоносетрон достоверно лучше позволяет предотвращать тошноту и рвоту в ранней фазе (p=0,0003), в отсроченной фазе (p<0,00001) и в целом (p<0,00001). При этом не было разницы в эффективности палоносетрона между дозами 0,25 и 0,75 мг.
При этом Tricco и соавт., выполнившие сетевой мета-анализ, опубликованный в 2016 г., пришли к выводу, согласно которому сравнение безопасности и эффективности антагонистов серотониновых рецепторов показывает, что палоносетрон в сочетании со стероидами обеспечивал наилучший профиль эффективности и безопасности в профилактике ИХТР [19]. При этом применение антиэметиков улучшает качество жизни пациентов, получающих высокоэметогенную химиотерапию и химиотерапию умеренной степени эметогенности, а также является эффективным с точки зрения расходования ресурсов здравоохранения [20].
Поэтому целью данного исследования было выполнить анализы «затраты–эффективность», «затраты–полезность» и анализ влияния на бюджет Российской Федерации для обоснования целесообразности более широкого использования палоносетрона в профилактике ИХТР.
Материал и методы
Появление новых антиэметических препаратов требует проведения их клинико-экономической оценки для выбора оптимальных режимов терапии. Наиболее часто применяемыми фармакоэкономическими методами являются анализы «затраты–эффективность» и/или «затраты–полезность».
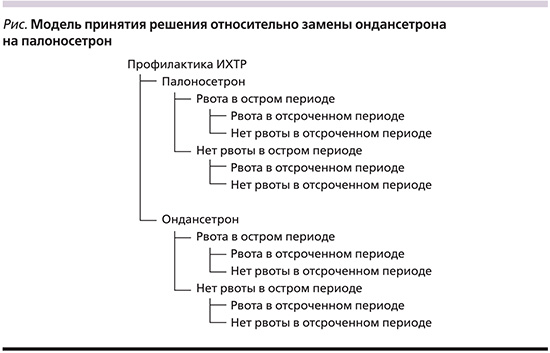
Использованная в данной работе модель представляет собой дерево решений, основанное на данных сравнительного анализа использования палоносетрона (как препарата выбора) и ондансетрона (как препарата с минимальной ценой, препарата сравнения) для профилактики ИХТР в случае применения высокоэметогенной терапии в соответствии с результатами исследования Aapro и соавт. [21]. В моделировании использовались данные о двухкомпонентном режиме (антагонисты 5НТ3-рецепторов в сочетании с дексаметазоном в соответствии с данными исследования). В упрощенном виде модель представлена на рисунке.
На основании приведенных в работе [21] данных были оценены вероятности следующих состояний – рвота (отсутствие полного ответа) в острой фазе (0–24 часа) и в отсроченной фазе (25–120 часов); отсутствие полного ответа в острой фазе, но наличие в отсроченной; наличие ответа в острой фазе, но отсутствие в отсроченной, наличие ответа во всех фазах. Далее была оценена вероятность потребности в дополнительной терапии (rescue medication) на основе данных о том, какому количеству лиц потребовалась такая терапия. Поскольку рекомендации предполагают при необходимости дополнительной терапии ее продолжение на протяжении всего цикла, предполагалось, что если необходимость возникает в острой фазе, терапия длится 5 дней, а если в отсроченной – то 4 дня.
Данные о стоимости ондансетрона были взяты как медианная стоимость дозировки (32 мг) на основании зарегистрированных данных перечня ЖНВЛП, для палоносетрона стоимости были взяты на основании базы данных аптечных цен (http://www.pharmindex.ru/onitsit.html), а также стоимости препарата в крупной европейской стране с системой лекарственного возмещения и ограничения цен (Германия). Согласно немецким данным, стоимость составила 89,34 евро [22]. Цена была переведена в рубли по курсу ЦБ России на 10.06.2017. Данные о стоимости дополнительной терапии (метоклопрамид, дексаметазон, оланзапин) были взяты из базы данных аптечных цен. Поскольку данных об относительном соотношении используемых препаратов при дополнительном лечении найти не удалось, в качестве оценочной была взята средняя дневная стоимость терапии. Данные о затратах времени врача и среднего медицинского работника при возникновении осложнений были взяты из работы Tarricone и Girolami [23], где приведены оценки таких затрат для Российской Федерации в минутах. Данные были усреднены, и принято, что они составляют 10 минут в день для врача и 30 – для среднего персонала. Расходы были переведены в денежные единицы на основе данных о средней заработной плате медицинских работников за январь–сентябрь 2016 г. (http://www.gks.ru/free_doc/new_site/population/trud/itog_monitor/itog-monitor3-16.html) и количества рабочих часов за этот период (http://www.garant.ru/calendar/buhpravo/2016/).
Весовые коэффициенты качества жизни для каждого состояния были взяты из работы Sun и соавт. [24, 25] и на их основе были проведены расчеты показателя QALY [26].
Модель была реализована в программе Microsoft Excel и затем продублирована в программе R (версия 3.3) с помощью пакета data.tree.
Результаты
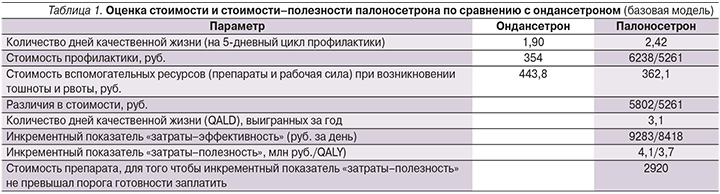
Основные результаты анализа представлены в табл. 1. Режим с назначением палоносетрона был ассоциирован с увеличением продолжительности качественной жизни на 0,5 дня (за 5-дневный цикл). Среднее ее значение на ондансетроне составило 1,9 дня, на палоносетроне – 2,4. Вместе с тем стоимость терапии была более высокой. Стоимость ондансетрона для профилактики составляет 354 руб., тогда как стоимость палоносетрона – от 6238 при использовании средних аптечных цен и 5699 руб., если ориентироваться на цены в Германии (по курсу ЦБ РФ). Усредненная стоимость ресурсов, направляемых на лечение тошноты и рвоты, составила в группе ондансетрона 443,8 руб. на человека, в группе палоносетрона – 362,1. Соответственно, разность расходов в случае цены на палоносетрон, соответствующей средним аптечным ценам, составляет 5802 руб. на цикл при использовании средних аптечных цен и 5261 руб., если ориентироваться на цены в Германии. Показатели «затраты–эффективность» составили 9283 руб. за дополнительный день без тошноты и рвоты, если ориентироваться на аптечные цены, и 8418, если ориентироваться на цену в Германии. Если перевести данные в показатели «затраты–полезность», инкрементный показатель составляет 3,7–4,1 млн руб. за один дополнительный год качественной жизни (QALY). Обычно принимаемый в качестве порога готовности заплатить за медицинскую технологию показатель равен утроенному годовому ВВП на душу населения [27, 28]. Для 2016 г. ВВП на душу населения составил 586 тыс. руб. (http://www.gks.ru/) соответственно, тройной порог готовности заплатить составил 1758 тыс. руб. Следовательно, расчетное значение стоимости за год качественной жизни для палоносетрона находится вне пределов порога готовности заплатить для РФ.
Таким образом, чтобы не превышать порога готовности заплатить для Российской Федерации, стоимость палоносетрона должна составлять не более 2920 (цена производителя без НДС) руб. за упаковку, или 46 евро по текущему курсу. В этом случае данный препарат оказывается стоимостно-эффективным в профилактике ИХТР для Российской Федерации.
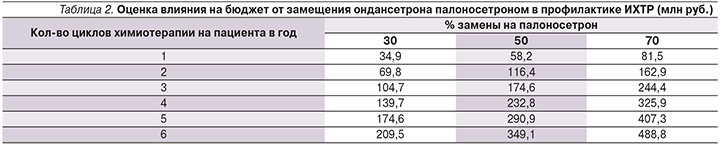
Для оценки влияния на бюджет были взяты данные по диагностике злокачественных новообразований в 2015 г. [29]. Предполагалось, что 90% всех пациентов с IV стадией рака молочной железы, яичников, легких, желудка и злокачественных лимфом потребуют эметогенной химиотерапии. Таких в 2015 г. было 46 844 больных, однако оценка роста расходов бюджета Российской Федерации будет зависеть от того, сколько циклов эметогенной химиотерапии в год они будут проходить и какова будет замена ондансетрона на палоносетрон (табл. 2). Стоимость профилактики палоносетроном была взята из описанной выше модели при учете стоимости препарата в пределах порога готовности заплатить.
Всего замена более старых препаратов на палоносетрон позволяет максимально сохранять 397,5 лет качественной жизни в год за счет лучшего предотвращения тошноты и рвоты при химиотерапии. Как видно из табл. 2, замена приведет к росту расходов в пределах от 35 до 489 млн руб. в зависимости от интенсивности использования и частоты замены. Вместе с тем, учитывая показанную выше затратную эффективность, выявленный рост расходов бюджета вполне обоснован в целях улучшения качества лечения онкологических больных при фиксации цены в пределах порога готовности заплатить.
Выводы
Палоносетрон является высокоэффективным и безопасным антагонистом серотониновых рецепторов, который превосходит по своей эффективности другие препараты этой группы и по сравнению с ондансетроном приводит к увеличению продолжительности качественной жизни на 0,51 дня за 5-дневный цикл профилактики. Палоносетрон является жизненно необходимым лекарственным препаратом для пациентов, получающих высоко- и умеренноэметогенную химиотерапию и может быть рекомендован в качестве оптимальной терапевтической опции для больных, не отвечающих на стандартную противорвотную терапию с включением блокаторов 5НТ3-рецепторов I поколения. Длительный период полувыведения и эффективность в отношении отсроченной ИХТР делают палоносетрон предпочтительным для пациентов, получающих химиотерапию в амбулаторных условиях и в условиях дневного стационара.



