Заболевания щитовидной железы (ЩЖ) – актуальная медико-социальная проблема. Особого внимания заслуживают изменения тиреоидного статуса как следствие неблагоприятных побочных реакций ряда препаратов. В список лекарственных средств, которые могут влиять на функционирование системы гипоталамус–гипофиз–ЩЖ, входят β-адреноблокаторы, препараты лития, глюкокортикоиды, йодсодержащие соединения, в т.ч. рентгенконтрастные препараты, и др. Среди них особого рассмотрения заслуживает амиодарон.
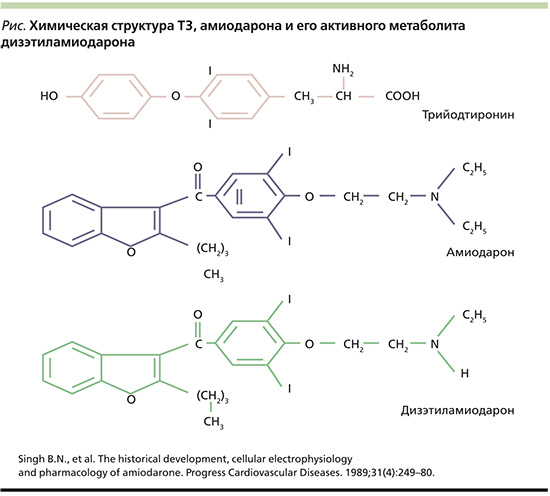
Этот препарат широко применяется в лечении сердечно-сосудистых заболеваний и характеризуется доказанной эффективностью при жизнеопасных желудочковых и предсердных аритмиях; частота применения амиодарона среди всего арсенала антиаритмических средств достигает 24,1% [1–3]. Это йодированное бензофурановое производное, по структуре близкое к тироидным гормонам (ТГ; см. рисунок) [4]. В связи с широким использованием амиодарона в клинической практике необходимо помнить о его возможных нежелательных эффектах, из числа которых к наиболее распространенным относятся изменения со стороны органа зрения, сердечно-сосудистой, дыхательной, пищеварительной, эндокринной и нервной систем (табл. 1) [5]. Среди побочных эффектов амиодарона особую озабоченность вызывает нарушение функции ЩЖ [6, 7]. Вместе с тем у большинства пациентов (около 80%), получающих амиодарон, сохраняется нормальная функция ЩЖ.
Лечение этим препаратом может приводить к различным, порою непрогнозируемым нарушениям функциональной активности ЩЖ – от незначительных изменений до гипотиреоза или выраженного тиреотоксикоза (амиодарон-индуцированные тиреопатии – АИТ) [8]. Частота нарушений функции ЩЖ при такой терапии колеблется от 15 до 20% [9, 10].
Указанные изменения чаще всего имеют преходящий характер, проявляются лишь лабораторными сдвигами и главное – не относятся к патологическим состояниям, требующим лечения. Однако в ряде случаев они могут сопровождаться клиническими проявлениями и оказывать существенное влияния на состояние пациента и прогноз жизни. Наиболее серьезным и имеющим важное клиническое значение нарушением является тиреотоксикоз, при этом существуют два его типа. Из числа АИТ тиреотоксикоз чаще развивается в йододефицитных регионах, в то время как гипотиреоз – в районах с достаточным йодным обеспечением.
Влияние амиодарона на синтез и метаболизм ТГ
Считается, что часть антиаритмических, равно как и нежелательных эффектов, амиодарона могут быть обусловлены связыванием с внутриклеточными ядерными рецепторами ТГ. На клеточном уровне этот препарат действует как антагонист ТГ за счет структурного сходства с трийотиронином (Т3). Наиболее активный метаболит амиодарона дизэтиламиодарон (ДЭА) действует как конкурентный ингибитор присоединения Т3 к α1-Т3-рецептору и как неконкурентный ингибитор β1-Т3-рецептора. Известно, что α1-Т3-рецепторы находятся в основном в сердечной и скелетной мускулатуре, тогда как в печени, почках и мозге преобладают β1-Т3-рецепторы. Следовательно, при достаточной концентрации амиодарон действует как конкурентный ингибитор Т3, обусловливая развитие «местного» гипотиреоза в сердечной мышце. Уменьшение проникновения Т3 в кардиомиоциты оказывает антиаритмический эффект за счет снижения экспрессии генов ионных каналов и других функциональных белков [11, 12]. Однако другие лекарственные средства, которые блокируют внетиреоидную конверсию тетрайодтиронин (Т4) в Т3, не обладают антиаритмическим эффектом, а действие амиодарона не зависит от изменения уровня тиреотропного гормона (ТТГ).
Потенциальное воздействие амиодарона на ЩЖ обусловлено особенностями его молекулы. Препарат содержит 37,6% йода, 10% которого находятся в свободной форме, и при приеме 200 мг препарата в организм ежесуточно поступает около 7,5 мг йода. При этом уровень неорганического йода в моче и плазме пациентов повышается в 40 раз [13]. Иными словами, при назначении поддерживающей дозы амиодарона 200–600 мг пациент получает порядка 7–21 мг/сут свободного йода, что в 50–100 раз превышает оптимальную потребность в этом элементе (150–200 мкг) [14].
Значительная часть препарата связывается с белками и липидами. Помимо высокого содержаний йода амиодарон отличают высокая липофильность и большой объем распределения (60 л), благодаря чему он накапливается во многих тканях (особенно в жировой). Биодоступность амиодарона после перорального приема составляет 30–80%; препарат медленно накапливается в тканях и также медленно выводится, поэтому нормализация концентрации йода наблюдается только через 6–9 месяцев после его отмены. При длительном пероральном приеме амиодарона, когда создается тканевое депо, период полувыведения препарата и его активного метаболита ДЭА может достигать 100 дней, в среднем составляя 52±23,7 и 61,2±31,2 дня соответственно [15].
Длительный период полувыведения амиодарона повышает риск медикаментозных осложнений, при этом АИТ могут возникать спустя долгое время после отмены препарата. В недавнем исследовании [16] авторы показали, что повышение соотношения ДЭА/амиодарон в плазме отмечается при развитии тиреотоксикоза, а его снижение – при гипотиреозе, что доказывает превалирующую роль ДЭА при амиодарон-индуцированном тиреотоксикозе и может служить предиктором тироидной дисфункции.
Нормально функционирующая ЩЖ отвечает на поступление в организм большого количества йода развитием эффекта Вольфа–Чайкова, при котором блокируется органификация йодидов и образование тироксина и Т3 на молекуле тиреоглобулина. В результате этого блокирующего эффекта, длительность которого составляет 2–3 недели, повышается содержание ТТГ и снижается уровень Т4. А затем благодаря « ускользанию» от этого феномена за счет уменьшения экспрессии натрий-йодного симпортера концентрация йодидов в ЩЖ снижается, блок ликвидируется и синтез ТГ нормализуется [17].

При длительном приеме амиодарон влияет на функционирование системы гипоталамус–гипофиз–ЩЖ посредством нескольких механизмов [18, 19]:
- подавление активности 5’-дейодиназы 1-го типа и как следствие – уменьшение конверсии Т4 в свободный Т3 в периферических тканях и конверсии реверсивного Т3 в 3,3’-дийодотиронин с итоговым снижением клиренса Т4 и реверсивного Т3;
- ингибирование захвата ТГ периферическими тканями;
- подавление активности 5’дейодиназы 2-го типа в гипофизе и как следствие – увеличение уровня ТТГ;
- подавление взаимодействия Т3 с клеточными рецепторами;
- снижение числа активных β-адренорецепторов, ослабление адренергических эффектов Т3;
- прямое токсическое действие на фолликулярные клетки ЩЖ.
Помимо этого амиодарон и ДЭА могут выступать в роли конкурентных антагонистов Т3 в клетках сердца. Принято считать, что эти механизмы способствуют развитию эутиреоидной гипертироксинемии с повышенными уровнями общего и свободного Т4, реверсивного Т3 при нормальном или субнормальном содержании Т3 (табл. 2) [20]. Необходимо иметь в виду, что указанные лабораторные сдвиги не сопровождаются признаками тиреотоксикоза и, соответственно, не требуют медикаментозной коррекции. На фоне длительного приема амиодарона может наблюдаться увеличение титра антител к тиреоидпероксидазе (ТПО) и тироглобулину.
Кроме вышеописанных эффектов амиодарон и ДЭА оказывают цитотоксическое действие на ЩЖ. Экспериментальными исследованиями установлено, что амиодарон индуцирует апоптоз и оказывает цитотоксический эффект на клетки ЩЖ и значительная роль в этом принадлежит оксидативному стрессу [21]. Синтез ТГ зависит от концентрации H2O2, которая из-за высокой токсичности должна находиться в строгом соответствии с активностью антиоксидантных систем. В норме многие биохимически опасные процессы протекают на апикальной мембране тиреоцита, что позволяет ограничивать действие свободных радикалов и избегать клеточной деструкции. Однако при патологических состояниях происходит нарушение ферментативных систем и их компоненты становятся аномально активированными в цитоплазме, а это в свою очередь приводит к функциональным и морфологическим нарушениям в ЩЖ.
На основании результатов исследований физиологии ЩЖ предполагается, что избыток йода, поступающий с амиодароном, приводит к недостаточному гликозилированию оксигеназ DUOXs, активированию мультибелкового комплекса DUOX-TPO в цитоплазме и избыточному образованию H2O2 [22]. Снижение активности антиоксидантных систем, которое, возможно, является следствием мутаций генов, приводит к усилению оксидативного стресса, некрозу/апоптозу клеткок и массивной интерстициальной воспалительной реакции. В этом случае йод-индуцированная цитотоксичность рассматривается как вероятный механизм развития амиодарон-индуцированного тиреотоксикоза 2-го типа.
У лиц, генетически склонных к развитию аутоиммунных заболеваний, таких как тиреоидит Хашимото и болезнь Грейвса, оксидативный стресс приводит к манифестации аутоиммунного воспаления (амиодарон-индуцированный гипотиреоз, амиодарон-индуцированный тиреотоксикоз 1-го типа).
У большинства больных, принимающих амиодарон, сохраняется эутиреоз. Тем не менее у некоторых пациентов может развиваться АИТ [22].

В недавнем исследовании показано, что у половины пациентов, у которых развились АИТ, изначально отмечались субклинические тиреотоксикоз или гипотиреоз, которые являются предиктором указанных нарушений [23].
Соответственно, если до назначения амиодарона у пациента выявлялся субклинический тиреотоксикоз в результате диффузного токсического зоба или токсического узлового/многоузлового зоба, ему показано радикальное лечение (радиойодтерапия или оперативное лечение) до начала антиаритмической терапии.
Нарушения функции ЩЖ, ассоциированные с приемом амиодарона
Тиреотоксикоз как наиболее тяжелое осложнение, возникающее на фоне терапии амиодароном, часто развивающееся внезапно, представляет прямую опасность для жизни пациента. Развитие амиодарон-индуцированного тиреотоксикоза может сопровождаться утратой антиаритмической активности препарата и приводить к рецидивам сердечных аритмий. Он развивается в 2–12% случаев применения амиодарона, риск его развития не зависит от кумулятивной дозы препарата [24]. Важно отметить, что при этом нарушении функции ЩЖ не всегда есть корреляция между уровнями циркулирующих ТГ и клинической тяжестью тиреотоксикоза, что, по-видимому, связано с взаимодействием амиодарона и его активного метаболита ДЭА с рецепторами Т3.
Как уже было указано выше, обусловленный амиодароном тиреотоксикоз бывает двух типов, причем их дифференциальная диагностика зачастую проблематична. Тиреотоксикоз типа 1 чаще развивается на фоне исходно измененной ЩЖ (субклиническая форма болезни Грависа, узловой зоб с функциональной автономией) и формируется по механизму йод-индуцированного заболевания с чрезмерными синтезом и секрецией ТГ [25]. Реже наблюдаются случаи тиреотоксикоза типа 1 у пациентов с ранее нормально функционирующей ЩЖ.
Амиодарон-индуцированный тиреотоксикоз типа 2 – следствие деструктивного тиреоидита с массивным разрушением фолликулов ЩЖ из-за токсического действия самого препарата. Эта форма тиреотоксикоза, как правило, развивается при отсутствии исходной патологии ЩЖ. Этот эндокринный орган обладает уникальной способностью депонировать в фолликулах большое количество ТГ. Считается, что такого количества ТГ достаточно для обеспечения организма на протяжении 2–3 месяцев. При амиодарон-индуцированном тиреотоксикозе типа 2 избыток ТГ за счет массивной деструкции фолликулов ЩЖ попадает в системный кровоток, обусловливая симптоматику заболевания и все типичные для него лабораторные сдвиги, при этом отсутствует увеличение синтеза ТГ.
У пациентов, перенесших тиреотоксикоз типа 2, со временем может развиться гипотиреоз, особенно в ответ на прием фармакологических доз йода [24].
Нередко первым признаком развития амиодарон-индуцированного тиреотоксикоза служит ухудшение течения основного сердечно-сосудистого заболевания. В ряде случаев традиционные симптомы тиреотоксикоза (похудание, глазные симптомы, потливость, тремор пальцев вытянутых рук) могут быть выражены незначительно, особенно у лиц пожилого возраста. В клинической картине заболевания преобладают кардиоваскулярные нарушения, в т.ч. учащение приступов стенокардии, прогрессирование сердечной недостаточности, рецидивы аритмий и ухудшение гемодинамики [26]. Дифференциальный диагноз между двумя типами амиодарон-индуцированного тиреотоксикоза важен для выбора эффективной терапии. В дифференциальной диагностике помимо данных анамнеза, клинического осмотра пациента с пальпацией ЩЖ используются ультразвуковое исследование (УЗИ) с цветным допплеровским картированием и сцинтиграфия ЩЖ (табл. 3) [27].
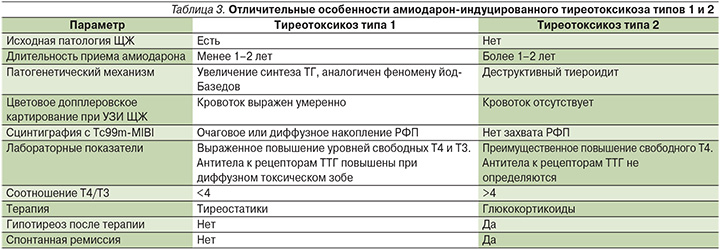
Вызванный амиодароном тиреотоксикоз типа 1 характеризуется нормальным или повышенным кровотоком в ЩЖ, кроме того, при УЗИ отмечаются признаки узлового зоба и/или увеличение объема железы. При сцинтиграфии ЩЖ наблюдается повышенное накопление или, гораздо реже, нормальный и даже сниженный захват радиофармпрепарата (РФП). Поможет в постановке диагноза исследование антител к рецепторам ТТГ, которые могут выявляться при наличии субклинической формы болезни Грейвса.
Важно отметить, что т.к. амиодарон-индуцированный тиреотоксикоз типа 2 не обусловлен гиперфункцией ЩЖ, а связан с деструкцией фолликулов, при сцинтиграфии будет определяться снижение или полное отсутствие накопления РФП, а при УЗИ – нормальный или усиленный кровоток.
Лечение определяется типом тиреотоксикоза [24]. В большинстве случаев требуется отмена приема амиодарона. При тиреотоксикозе типа 1 для ингибирования синтеза ТГ назначают тиреостатики, в ряде случаев – в высоких дозах (тиразол 40–60 мг/сут); для достижения результата, как правило, требуется больший период времени по сравнению с лечением болезни Грейвса; в отсутствие эффекта проводят оперативное лечение заболевания. При амиодарон-индуцированном тиреотоксикозе типа 2 используются глюкокортикоиды (преднизолон 0,5–0,7 мг/кг массы тела/сут), курс лечения обычно продолжается 2–3 месяца [28, 29]. При тяжелом течении тиреотоксикоза (обычно при сочетании двух его форм) используют комбинацию тионамида и глюкокортикоида.
У некоторых пациентов комбинированная лекарственная терапия может быть неэффективной, что требует хирургического вмешательства. Оперативное лечение обычно проводится в случае невозможности достижения компенсации заболевания после длительного (около 6 месяцев) курса фармакотерапии или при сочетании гипертиреоза с узловым зобом. Пациентам с диффузным или узловым зобом, имеющим нормальное или повышенное поглощение РФП, в отсутствие эффекта от консервативной терапии показано лечение радиоактивным йодом.
Распространенность гипотиреоза на фоне приема амиодарона колеблется в пределах от 6% в странах с низким потреблением йода до 13% в регионах с его высоким потреблением (субклиническая форма до 20%). Чаще гипотиреоз встречается в пожилом возрасте у лиц женского пола. Наличие антител к ТПО резко увеличивает риск развития амиодарон-индуцированного гипотиреоза у пациентов с аутоиммунным тиреоидитом, особенно у женщин (до 13 раз). Развитие гипотиреоза чаще связывают с индукцией и прогрессированием аутоиммунного тиреоидита, кроме того, снижение функции ЩЖ может быть обусловлено длительной блокадой органификации на фоне высокой концентрации интратиреоидного йода. Следует знать, что развитие амиодарон-индуцированного гипотиреоза не приводит к утрате антиаритмической эффективности амиодарона и не является показанием к его отмене. Согласно данным литературы, это патологическое состояние может развиваться как в ранние сроки, уже через 2 недели от начала терапии амиодароном, так и в поздние – спустя 39 месяцев [30].
Клинические проявления дефицита ТГ (сухость кожи, вялость, отечный синдром, заторможенность, зябкость и др.) при амиодарон-индуцированном гипотиреозе не отличаются от таковых при гипотиреозе, вызванном другими причинами. Субклиническая форма гипотиреоза протекает бессимптомно, но возможны атерогенные изменения в липидном спектре крови. Пациентам с амиодарон-индуцированным гипотиреозом назначается заместительная терапия ТГ. Рекомендуется начинать лечение L-тироксином с минимальной дозы (25 мкг/сут), медленно повышая ее с интервалами 4–6 недель под контролем уровня ТТГ до достижения компенсации гипотиреоза, при этом не допуская утяжеления кардиальной патологии [31].
После отмены амиодарона (из-за отсутствия сердечно-сосудистой эффекивности) нормальная функция ЩЖ обычно восстанавливается, но только спустя 3–4 месяца с учетом длительного периода полувыведения препарата. При необходимости амиодарон может назначаться пациентам с уже имеющимся гипотиреозом одновременно с ТГ, что может потребовать увеличения суточной дозы L-тироксина.
Заключение
Амиодарон на сегодняшний день является наиболее эффективным и широко используемым препаратом для лечения и профилактики жизнеугрожающих желудочковых нарушений сердечного ритма и различных других форм сердечной аритмии. Однако, как и любой другой фармакологический препарат, он может вызывать нежелательные эффекты со стороны различных органов и тканей, что осложняет его использование. Планируя назначение амиодарона, следует учитывать, что препарат может оказать воздействие на функциональную активность и структуру ЩЖ, хотя у большинства пациентов, его получающих, тиреоидная функция не нарушается. Перед началом терапии необходимо тщательное обследование пациента с обязательным определением ТТГ – самого информативного показателя; в случае отклонения ТТГ от нормы необходимо провести оценку свободного Т4. Также необходимо исследовать титр антител к ТПО (определения их в динамике не требуется), провести УЗИ, а при подозрении на функциональную автономию (снижение уровня ТТГ, наличие узлового/многоузлового зоба) – сцинтиграфию ЩЖ. Желательно определение антител к рецепторам ТТГ у пациентов с диффузным зобом при подозрении на субклиническую форму болезни Грейвса. На фоне приема амиодарона повторное определение уровней свободного Т4 и ТТГ следует повторить через 3 месяца от начала терапии, а далее – каждые полгода на протяжении всего периода лечения. При интерпретации показателей тиреоидного статуса следует исходить из того, что изолированное повышение уровня свободного Т4 не является диагностическим признаком тиреотоксикоза. В дальнейшем при нормальных показателях ТГ мониторинг на фоне продолжения приема амиодарона осуществляется по уровню ТТГ 1–2 раза в год. Следует иметь в виду, что АИТ могут возникать спустя долгое время после прекращения терапии амиодароном, что требует контроля тиреоидного статуса каждые 6 месяцев на протяжении 1 года после отмены препарата.
В тех случаях, когда амиодарон назначается для первичной или вторичной профилактики фатальных желудочковых нарушений ритма сердца или когда отмена препарата невозможна по иным причинам (любые формы аритмий, протекающие с тяжелой клинической симптоматикой, которые не удается устранить другими средствами антиаритмической терапии), компенсацию нарушения функции ЩЖ, в частности тиреотоксикоза, проводят на фоне продолжения приема амиодарона. Вопрос об отмене или продолжении лечения амиодароном должен решаться индивидуально для каждого пациента совместно кардиологом и эндокринологом.



