Пембролизумаб относится к принципиально новому классу противоопухолевых средств – ингибиторам контрольных точек PD-1/PD-L1, лечебный эффект которых осуществляется путем реактивации противоопухолевого иммунного эффекта. Он представляет собой высокоселективное гуманизированное моноклональное антитело изотипа IgG4-kappa, которое блокирует взаимодействие между рецептором PD-1 на поверхности Т-клеток и PD-L1- и PD-L2-лигандами, находящимися на клетках опухоли и ее микроокружения.
Это второй после блокаторов активирующих мутаций EGFR (Epidermal growth factor receptor) и транслокаций ALK- (Anaplastic Lymphoma Kinase) и ROS1-класса препаратов, существенно изменивших результаты лечения ряда опухолей у определенной категории больных.
Пембролизумаб зарегистрирован в декабре 2016 г. в Российской Федерации для лечения немелкоклеточного рака легкого (НМРЛ) при экспрессии PD-L1 с отсутствием активирующих мутаций EGFR, ALK и ROS1.
Следует отметить, что зарубежные рекомендации (NCCN – National Comprehensive Cancer Network) включают пембролизумаб не только во вторую, но и в 1-ю линии лечения метастатического НМРЛ при наличии высокого уровня экспрессии PD-L1 (≥50%) и в отсутствие мутаций EGFR и ALK.
В настоящее время установлена целевая популяция больных для эффективного лечения пембролизумабом. Ключевым показанием является высокий (≥50% клеток независимо от степени окрашивания) уровень экспрессии лиганда программной гибели опухолевых клеток (PD-L1), выявляющийся у 23–28% больных НМРЛ [1, 2].
Представлены результаты исследования I фазы KEYNOTE-001, включившего (после поправок в проект большинство больных имели экспрессию PD-L1>1%) 495 больных, из них 101 получал пембролизумаб в 1-й линии и 394 – в последующих.
По состоянию на сентябрь 2015 г. медиана наблюдения составила 23,1 месяца, медиана общей выживаемости (ОВ) – 22,1 (95% доверительный интервал [ДИ] – 17,1–27,2) для ранее нелеченных пациентов и 10,6 месяца (95% ДИ 8,6–13,3) у предлеченных больных.
Противоопухолевая эффективность у пациентов с высоким уровнем экспрессии PD-L1 ассоциировалась со значимым увеличением медиан выживаемости – общей и без прогрессирования (ВБП). При экспрессии PD-L1≥50% клеток (n=73) противоопухолевый эффект достигался в 45,2% с медианой его длительности 12,5 месяцев. У пациентов, ранее получавших лечение (n=57), эффект составил 44% и ВБП – 6,1 месяца, медиана ОВ не была достигнута. Для сравнения: при более низком проценте окрашивания (1–49% клеток, n=103) эффект регистрировался в 16,5%, ВБП – 4,1 месяца в отсутствие окрашивания (≤1% клеток) – в 10,7%, ВБП – 4,0 месяца.
При оценке результатов лечения в таргетной популяции (PD-L1≥50%) у больных плоскоклеточным и неплоскоклеточным раком эффективность терапии в первом случае была выше: 50,0 против 35,9%. Соответственно, медианы составили: ВБП – 10,3 против 4,3 и ОВ – 14,0 против 18,5 месяца [3]. Однако малое число больных в подгруппе плоскоклеточного рака не позволяет адекватно интерпретировать полученные результаты. Интерес представляет результат подгруппового анализа влияния статуса EGFR на общую выживаемость. Лечение пембролизумабом у ранее предлеченных больных с наличием мутации EGFR (n=74) было несколько менее эффективным – медиана ОВ составила 6,0 против 12,1 месяца в ее отсутствие (n=12).
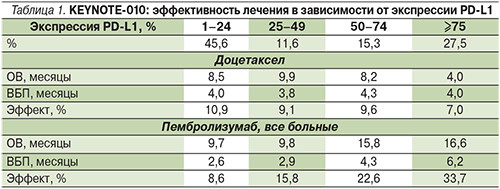
Полученные результаты были воспроизведены в исследовании II/III фаз KEYNOTE-010, включившем более 1000 больных, имевших прогрессирование после платиносодержащих режимов и наличие экспрессии PD-L1≥1%. Было проведено сравнение эффективности двух дозовых режимов пембролизумаба 2 и 10 мг/кг со стандартной химиотерапией доцетакселом. В обеих дозах пембролизумаб был примерно равноэффективным, индуцируя медиану ОВ 10,4 и 12,7 месяца, достоверно превышая ее в группе доцетаксела – 8,5 месяцев (отношение рисков [ОР]=0,71, 95% ДИ – 0,58–0,88 и 0,61, 95% ДИ – 0,49–0,75 соответственно). Медианы ВБП во всех группах не различались, составив около 4 месяцев.
В популяции пациентов с гиперэкспрессией PD-L1≥50% (n=442) медианы ОВ составили 14,9 (2 мг/кг) и 17,3 месяца (10 мг/кг) в обоих режимах, достоверно превышая результаты доцетаксела 8,2 месяца (ОР=0,54, 95% ДИ – 0,38–0,77 и ОР=0,50, 95% ДИ – 0,36–0,70 соответственно). Различий в медианах ВБП у пациентов, получавших пембролизумаб, не различалось, составив 5,0 и 5,2 месяца, и были достоверно ниже в группе доцетаксела – 4,1 месяца (ОР=0,59, 95% ДИ – 0,44–0,78 и ОР=0,59, 95% ДИ – 0,45–0,78 соответственно).
В общей популяции больных объективный эффект (RECIST v. 1.1) также достигался чаще: 18% при обеих дозах пембролизумаба по сравнению с 9% у пациентов, получавших доцетаксел (p=0,0005 и p=0,0002 соответственно). Подгрупповой анализ подтвердил представленную в предыдущем исследовании зависимость эффективности лечения от степени экспрессии PD-L1. Так, при ее значениях ≥50% частота объективного эффекта составила 30 и 29%, что достоверно превышало таковую доцетаксела – 8% (p<0,0001 и p<0,0001 соответственно). Наилучшие результаты лечения пембролизумабом были достигнуты больными, имевшими ≥75% окрашенных опухолевых клеток. Данные представлены в табл. 1 [4].
В этой популяции доцетаксел был наименее эффективен, что при ограниченном доступе к пембролизумабу позволяет ее позиционировать как «таргетную».

Частота развития значимых (3–5-я ст.) побочных эффектов была существенно ниже у пациентов, получавших пембролизумаб, – 13 и 16% соответственно по сравнению с 35% в подгруппе доцетаксела.
Полученные результаты позволили спланировать исследование III фазы KEYNOTE-024, дизайн которого был максимально приближен к реальной практике. Были отобраны 305 лиц с отсутствием активирующих мутаций EGFR и ALK и имевших окрашивание не менее 50% опухолевых клеток. Среди них преобладали мужчины, более 90% были курильщиками, плоскоклеточный рак был примерно у 20%. Предварительно больные, не получавшие лечения, были рандомизированы в группу пембролизумаба в фиксированной дозе 200 мг каждые 3 недели (n=154) или химиотерапии на основе препаратов платины в зависимости от морфологии, согласно выбору исследователя (n=151) [5]. Дизайн предполагал возможность «переключения» при прогрессировании на фоне химиотерапии на лечение пембролизумабом. Таких больных было 43,7%. Основной целью была ВБП. На момент представления данных 48,1% пациентов в группе пембролизумаба продолжали лечение. Медиана ВБП у пациентов, получавших пембролизумаб, была достоверно выше: 10,3 против 6,0 месяцев (ОР=0,50, 95% ДИ – 0,37–0,68; р<0,001). Медиана ОВ не была достигнута, но ее кривые расходились с ранних сроков, обусловливая достоверность различий преимущества пембролизумаба (ОР=0,60, 95% ДИ – 0,41–0,89; р=0,005). Преимущество пембролизумаба было и в частоте объективного эффекта, составившего 44,8 против 27,8%. Его длительность составила 12,1 и 5,7 месяца соответственно. Серьезные побочные эффекты (3–5-я ст.) в меньшей степени осложняли терапию пембролизумабом – 27 по сравнению с 53% при химиотерапии. Подгрупповой анализ ВБП установил, что наилучшие значения ее достигались мужчинами при плоскоклеточном раке, не получавшими пеметрексед (у больных при прогрессировании после химиотерапии).
Таким образом, результаты проведенных исследований позволили выделить ряд характеристик НМРЛ, способствующих максимальной реализации противоопухолевого эффекта пембролизумаба. Таргетную популяцию составляют пациенты с гиперэкспрессией PD-L1≥50%, где лечение пембролизумабом экстраполируется в значимое увеличение времени до прогрессирования заболевания и частоты достижения объективного эффекта. Это важно именно для российской популяции больных, как минимум в половине случаев представленной плоскоклеточным раком легкого, и курящих или бывших курильщиков. У этих больных пембролизумаб имеет существенные преимущества по сравнению с существующими опциями химиотерапии как 1-й, так и последующих линий, что создает прецедент для изменения клинических рекомендаций. Остается ряд нерешенных вопросов, в частности, о тактике 1-й линии лечения пациентов с наличием гиперэкспрессии PD-L1 и активирующей мутации EGFR /ALK /ROS1.
Рак молочной железы
На сегодняшний день одновременно несколько научных групп приступили к реализации крупных клинических исследований по анализу эффективности пембролизумаба при раке молочной железы (РМЖ).
Наибольший интерес представляет изучение этого препарата в группе пациентов, страдающих РМЖ с тройным негативным фенотипом, ввиду агрессивности течения этого заболевания и отсутствия возможности использования таргетных препаратов (эндокринотерапия или терапия, направленная на HER-2/neu).
Толчком послужили результаты исследования Ib-фазы, KEYNOTE-012 (KN-012), в котором продемонстрирована высокая эффективность и хорошая переносимость монотерапии пембролизумабом пациентами с метастатическим РМЖ (мРМЖ), с тройным негативным фенотипом и высоким уровнем экспрессии лиганда программной гибели опухолевых клеток (PD-L1), ранее получавших несколько линий химиотерапии (включая антрациклины, таксаны, производные платины и капецитабин).
В этом исследовании больные (n=32) получали пембролизумаб в дозе 10 мг/кг каждые 2 недели до прогрессирования заболевания или развития непереносимой токсичности. Следует отметить, что при клинической стабилизации болезни терапия пембролизумабом была продолжена даже при прогрессировании заболевания по данным компьютерной томографии (согласно RECIST v1.1) вплоть до его подтверждения при контроле через 4 и более недель. Больным было проведено от 1 до 36 курсов терапии (медиана составила 5 курсов). Токсический профиль характеризовался в основном осложнениями I–II степеней (артралгия, астения, миалгия, тошнота), только у 5 пациентов (15,6%) отмечено развитие AE (adverse events) III–IV степеней и один случай смерти, обусловленной проводимым лечением. Эффективность терапии составила 18,5% (включая один случай полного регресса) с медианой времени наступления эффекта лечения 17,9 недели (от 7,3 до 32,4) и длительностью эффекта от 15,0 до >47,3 недели (медиана не достигнута). Большинство ответивших на проводимую терапию пациентов имели висцеральные метастазы (3/5) и получали монотерапию пембролизумабом больше года (3/5).
Вслед за вышеописанной программой было инициировано два клинических исследования II и III фаз, в которых изучалась эффективность пембролизумаба в монотерапии пациентов с мРМЖ с тройным негативным фенотипом, ранее получавших несколько линий химиотерапии: KEYNOTE-086 и KEYNOTE-119. Набор пациентов в эти программы завершен, промежуточные результаты ожидаются в ближайшее время. В обоих исследованиях изучается статус PD-L1.
- В программе KEYNOTE-086 (II фаза) больным, ранее получавшим антрациклины и таксаны и хотя бы одну линию химиотерапии по поводу мРМЖ, проводится терапия пембролизумабом в режиме 200 мг/сут внутривенно в день 1 каждые 3 недели до прогрессирования заболевания или развития непереносимой токсичности, но не более 24 месяцев.
- В программе KEYNOTE-119 (III фаза) у больных, ранее получавших антрациклины и/или таксаны и 1–2 линии химиотерапии по поводу мРМЖ, сравнивается эффективность пембролизумаба (200 мг/сут внутривенно каждые 3 недели) и химиотерапии (в соотношении 1:1, на выбор врача: капецитабин, эрибулин, гемцитабин или винорельбин). Длительность терапии пембролизумабом не более 35 циклов.
Не менее интересным представляется изучение эффективности комбинации пембролизумаба и химиотерапии. Обоснование сочетания пембролизумаба с химиотерапией основано на иммуномодулирующих эффектах последней, что в свою очередь может повысить противоопухолевую активность ингибирования пути PD-1. Несмотря на то что цитотоксические лекарственные средства, включая таксаны и гемцитабин/карбоплатин, исторически считались иммуносупрессорами, они также могут играть иммунопотенцирующую роль.
При РМЖ с тройным негативным фенотипом ведется набор пациентов в три программы: KEYNOTE-355, KEYNOTE-522 и KEYNOTE-173 (табл. 2).
Высокая эффективность пембролизумаба для больных РМЖ с тройным негативным фенотипом открывает перспективы его изучения при РМЖ с другими характеристиками (HER-2- положительный, люминальный).
В программе PANACEA анализируется способность пембролизумаба преодолеть лекарственную резистентность к трастузумабу и улучшить клинические результаты терапии у HER-2-положительных больных. Включенные в программу пациенты получают пембролизумаб в комбинации с трастузумабом в стандартных дозировках (200 мг и 8–6 мг/кК/сут соответственно, внутривенно в день 1, каждые 3 недели). Также ведется изучение эффективности применения комбинации пембролизумаба с другими анти-HER2-препаратами (например, TDM-1).
У больных люминальным РМЖ комбинация пембролизумаба с различными гормональными препаратами анализируется как в группе пациентов с гормонрезистентным заболеванием, так и у больных, ранее не получавших лечения.
Таким образом, несмотря на то что на сегодняшний день недостаточно данных для полной оценки эффективности пембролизумаба при РМЖ, изучение этого препарата вызывает большой интерес, о чем говорят многочисленные клинические исследования, которые ведутся в настоящее время.
Диссеминированная меланома кожи
Лекарственная терапия диссеминированной меланомы кожи (ДМК) до эры открытия BRAF- и MEK-ингибиторов (при наличии мутации BRAF) и ингибиторов иммунных контрольных точек оставалась трудной задачей.
Пембролизумаб является первым зарегистрированным ингибитором иммунных контрольных точек, блокирующим сигнальный путь PD-1, одобренный FDA (Food and Drug Administration) США. Препарат был зарегистрирован на основании проведенных исследований, показавших высокую клиническую эффективность пембролизумаба для пациентов с метастатической меланомой.
C. Robert и соавт. в 2016 г. опубликовали обновленные данные 3-летней ОВ пациентов, получавших лечение в рамках открытого Ib-фазы исследования KEYNOTE-001. Пациенты были разделены на 2 когорты: ранее получавшие ипилимумаб и не получавшие лечения ипилимумабом. Пембролизумаб вводился в дозе 2 или 10 мг/кг каждые 3 недели или 10 мг/кг каждые 2 недели до непереносимой токсичности или прогрессирования болезни. Ответ был оценен по критериям RECIST v. 1.1
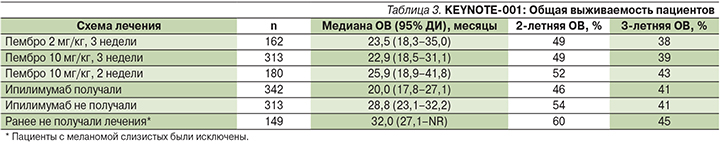
каждые 12 недель. Из 655 оцененных пациентов 24% имели мутацию BRAFV600, у 78% была стадия болезни M1c, у 38% – высокий уровень лактатдегидрогеназы, 75% пациентов имели ≥1 линии предшествовавшей терапии и 52% пациентов ранее получали ипилимумаб. Медиана длительности наблюдения к сентябрю 2015 г. составила 32 месяца (от 24–46 месяцев). И что наиболее важно, 3-летняя ОВ пациентов с ДМК составила 40%, медиана ОВ – 23,8 месяца (95% ДИ – 20,2–29,0), результаты в группах с различными дозами пембролизумаба существенно не различались (табл. 3) [6].
Объективный эффект был достигнут 33% пациентов во всей популяции и 45% ранее не получавших лечения пациентов. Из них 10% пациентов имели полные эффекты. И, что наиболее важно, среди 61 пациента, которому лечение после достижения полного ответа было прекращено (длительность ответа составила от 17+ до 44+ месяцев, медиана длительности не была достигнута), только у 2 пациентов отмечено прогрессирование болезни. Можно предположить, что значительная часть пациентов, получивших лечение пембролизумабом, могут быть излечены [7]. Токсичность лечения была умеренной. У 14% пациентов отмечали 3–4-ю степени токсичности, и не было статистически значимых различий между группами пациентов, получавших и ранее не получавших ипилимумаб. Из наиболее частых иммуно-опосредованных побочных эффектов наблюдались гипотиреоз (9,6%), пульмонит (4,3%), гипертиреоз (2,3%), колит (2,3%), увеит (1,5), гепатит (0,9%), нефрит (0,5%) [8].
Keynote-002 – это второе большое открытое исследование II/III фаз, в котором сравнивались две дозы лечения пембролизумабом со стандартной химиотерапией (паклитаксел, карбоплатин, дакарбазин или темозоломид) у пациентов с ДМК, которые ранее получали ипилимумаб и/или BRAF-ингибиторы (при наличии BRAF V600-мутации) [9] .
В исследовании приняли участие 540 пациентов с ДМК. Все пациенты были рандомизированы в 3 группы 1:1:1. Первая и вторая группы получали пембролизумаб в различных дозах: 2 или 10 мг/кг каждые 3 недели или химиотерапию на выбор исследователя. Шестимесячная безрецидивная выживаемость в двух группах с пембролизумабом была значительно выше, чем в группе химиотерапии, и составила 36 и 16% соответственно, так же как и объективный эффект в группах с пембролизумабом составил 23% (19–28) в отличие от 4% (2–9) в группе с химиотерапией.
В этом исследовании изучалась экспрессия PD-L1 в опухолевых клетках в качестве предиктивного биомаркера эффективности лечения пембролизумабом. Было показано, что в отличие от пациентов с метастатическим НМРЛ экспрессия PD-L1 не является фактором прогноза для пациентов с ДМК.
На основании полученных данных II–II фаз исследования Keynote-002 была инициирована III фаза исследования Keynote-006. В 3-й группе были рандомизированы 834 пациента с ДМК: 2-й группы с пембролизумабом по 10 мг/кг каждые 2 или 3 недели в течение 2 лет до прогрессирования или до непереносимой токсичности или ипилимумаб 3 мг/кг каждые 3 недели в течение 4 циклов до прогрессирования или до непереносимой токсичности. У 80% пациентов определялась экспрессия PD-L1+, у 18% – нет и у 2% пациентов экспрессия PD-L1 была неизвестной. Экспрессия PD-L1 определялась иммуногистохимически (антитела 22C3) и считалась положительной при окраске ≥1% опухолевых клеток. По поводу диссеминированного заболевания ранее не получали лекарственной терапии 66% пациентов и 34% имели 1 предшествовавшую линию лекарственного лечения. Обновленные данные (на март 2015 г.) были опубликованы A. Daud и соавт.
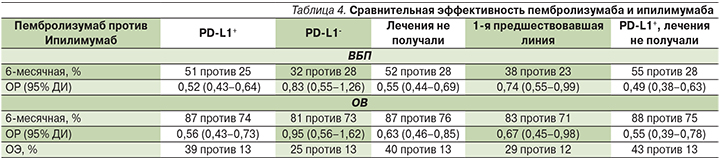
В этом анализе группы с пембролизумабом были объединены. Объективный эффект (ОЭ), ОВ и ВБП были независимо от экспрессии PD-L1 и от линии терапии выше в группе пембролизумаба. Было показано значительное преимущество пембролизумаба над ипилимумабом в лечении пациентов с ДМК (табл. 4) [10].
По данным, опубликованным на ASCO 2016 г., 2-летняя ОВ пациентов в группе пембролизумаба составила 55% по сравнению с 43% пациентов, получавших ипилимумаб (p=0,0008) [11].
Наиболее агрессивной формой является меланома слизистых оболочек. До настоящего времени варианты ее лечения были крайне скудны. Однако, по данным трех исследований KEYNOTE-001, KEYNOTE-002 и KEYNOTE-006, была показана эффективность пембролизумаба: медиана ВБП составила 2,8 месяца, медиана ОВ – 11,3 месяца [12].
Таким образом, на сегодняшний день можно сказать, что иммунотерапия ингибиторами иммунных контрольных точек, блокирующих сигнальный путь PD-1, – наиболее эффективная терапия ДМК, дающая длительные клинические ответы, имеет предсказуемый профиль токсичности.



