Фибрилляция предсердий (ФП) – наиболее частое нарушение ритма, ассоциированное с высокой частотой тромбоэмболических осложнений, особенно инсульта [1, 2]. В последних эпидемиологических исследованиях показано увеличение распространенности ФП в популяции, в первую очередь среди лиц пожилого и старческого возраста [3]. Современные профилактические стратегии в отношении пациентов с ФП предусматривают назначение антикоагулянтной терапии [4]. Рекомендации по диагностике и лечению ФП 2016 г. однозначно определяют ведущее значение антикоагулянтной терапии в качестве первичной и вторичной профилактики [5]. На сегодняшний день использование в условиях реальной клинической практики новых пероральных антикоагулянтов (НПОАК) пациентами с неклапанной ФП, включая прямой ингибитор тромбина (дабигатрана этексилат) или ингибиторы Ха-фактора крови (апиксабан, ривароксабан, эдоксабан), служит альтернативой таковому антагонистов витамина К. Для НПОАК проведены исследования III фазы, в т.ч. с включением в них пациентов с высокими баллами по шкале CHA2DS2-VASc (Congestive heart failure, Hypertension, Age, Diabetes mellitus, Stroke, Vascular disease, Age, Sex category) с отягощенным соматическим статусом, а также больных, уже имевших в анамнезе транзиторные ишемические атаки (ТИА) или кардиоэмболический инсульт (КЭИ).
Высокие показатели смертности среди пациентов с ФП, перенесших инсульт, ставят актуальные задачи всестороннего изучения и предупреждения развития повторных тромбоэмболических осложнений с точки зрения возможностей изучения влияния антикоагулянтов на те патофизиологические изменения, когда уже имеет место процесс ремоделирования сердечно-сосудистой системы с изменениями сосудистой стенки в условиях, как правило, прогрессирующей эндотелиальной дисфункции (ЭД). В ряде исследований показано, что структурные и функциональные изменения в артериях могут иметь большое значение в патогенезе ФП, поддерживая ее патологический паттерн и способствуя развитию тромбоэмболических осложнений [6–8]. В аспекте сердечно-сосудистого континуума в развитии ФП, с одной стороны, имеет место накопление факторов риска, негативно влияющих на миокард, проводящую систему, сосуды, с другой – инволютивные структурные изменения в данных анатомических структурах. С возрастом прогрессирует фиброз, усиливаются процессы апоптоза кардиомиоцитов предсердий, одновременно имеет место высокая степень активации симпатического отдела автономной нервной системы и вагусной модуляции, не только усугубляющих дисфункцию проводящей системы сердца, но и способствующих поддержанию высокой степени вазоконстрикторных реакций сосудистой стенки [9, 10]. Сегодня сосудистая стенка является предметом изучения физиологов, патофизиологов, клиницистов, т.к. морфологические изменения в эндотелии есть ключевой и независимый фактор риска развития сердечно-сосудистых заболеваний (ССЗ), включая ишемическую болезнь сердца, артериальную гипертензию (АГ), а также сахарный диабет (СД) и атеросклероз [11]. В ряде работ рассматривается вопрос рисков тромбообразования у пациентов с ФП в ассоциации с показателями жесткости сосудистой стенки и дисфункцией эндотелия [12–14]. Однако информации о связи между параметрами артериальной жесткости и ЭД у пациентов с ФП, перенесших тромбоэмболическое событие, на доступных информационных ресурсах мы не нашли.
Настоящее исследование посвящено изучению влияния антикоагулянтной терапии препаратом апиксабан на параметры артериальной жесткости и ЭД у больных ФП, перенесших КЭИ.
Материал и методы
В проспективное наблюдательное исследование методом случайной выборки включены пациенты, перенесшие инсульт и выписанные под наблюдение из сосудистых центров Самары (по данным медицинских карт стационарного больного, форма № 033/у) на этап первичной медико-санитарной помощи в период с 01.01.2016 по 31.06.2015. Всего скринированы 889 больных, из которых 113 в соответствии с дизайном исследования отвечали критериям включения, а именно: наличие пароксизмальной или персистирующей формы ФП неклапанного генеза; верифицированный диагноз КЭИ в каротидном бассейне давностью не более 30 дней; результат оценки неврологического статуса на момент выписки из стационара по шкале NIНSS≤10 баллов; возраст ≥65 лет; наличие рекомендаций по приему апиксабана в выписках из медицинской карты стационарного больного после лечения в условиях сосудистого центра; добровольное информированное согласие на включение в исследование и обработку персональных данных.
Из исследования были исключены пациенты с заболеванием щитовидной железы, наличием онкологического заболевания в анамнезе, с постоянной формой ФП, принимавшие антикоагулянты в анамнезе до наступления тромбоэмболического события.
Пациенты были разделены на две группы: 56 больных (1-я группа), принимавших в соответствии с рекомендациями апиксабан (Эликвис) в суточной дозе 5 мг. В группу сравнения (2-я группа) вошли 57 пациентов, не следовавших рекомендациям после перенесенного КЭИ по приему НПОАК. В обеих группах все больные получали антигипертензивные лекарственные средства: ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы кальциевых каналов, диуретики, блокаторы ренин-ангиотензиновой системы (БРА), β-адреноблокаторы, а также ингибиторы ГМГ-КоА-редуктазы. В соответствии с протоколом исследователи не изменяли схем медикаментозной терапии, которую пациенты получали амбулаторно и были назначены на этапе первичной медико-санитарной помощи лечащим врачом (участковый терапевт, и/или кардиолог, и/или невролог). Все пациенты были извещены, что в любой момент они могут выйти из исследования по любой причине.
Длительность наблюдения составила 182,5±5,5 дней, в течение которого проведено 2 визита: первый (V1) – исходно, второй визит (V2) –через 24 недели. Инструментальные исследования проведены в условиях Гериатрического центра ГБУЗ Самарской области «Самарская клиническая гериатрическая больница».
Все исследования проведены в период наличия у больных синусового ритма. На первом и втором визитах пациентам проведена объемная сфигмография на аппарате «VaSera-1000». Анализировали следующие параметры: артериальное (АД) систолическое и диастолическое давление (САД и ДАД соответственно); где RB – правая рука, LB – левая рука, RА – правая нога, LА – левая нога; скорость распространения пульсовой волны (СРПВ) между предплечьем и правой лодыжкой (R-PWV, м/с) и предплечьем и левой лодыжкой (L-PWV, м/с), получаемую с помощью плетизмограммы с использованием манжет, закрепленных на четырех конечностях (согласно инструкции по эксплуатации аппарата); индекс аугментации (AI), где AI-R – показатель отношения ударной волны, возникающей во время увеличения давления в аорте, к отраженной волне, регистрируемой на сонной и плечевой артериях во время систолы (следует отметить, что на AI влияет жесткость аорты и магистральных артерий, он увеличивается с возрастом и при развитии артериосклеротических поражений сосудистой стенки); лодыжечно-плечевой индекс справа/слева (R/L-ABI – ankle-brachial index): R-ABI – отношение САД на правой голени к среднему АД на плечах; L-ABI – отношение САД на левой голени к среднему АД на плечах; сердечно-лодыжечный сосудистый индекс (CAVI – Cardio-Ankle Vascular Index,), который позволяет оценивать жесткость артериальной стенки, обусловленную ее морфологическими изменениями и в меньшей степени – сосудистым тонусом. CAVI – показатель степени выраженности атеросклеротического поражения стенок сосудов, его расчет основан на параметре жесткости, не зависит от уровня АД в момент исследования и отражает истинную жесткость сосудистой стенки. CAVI прямо пропорционален жесткости артериальной стенки: чем выше CAVI, тем больше жесткость артериальной стенки. Все показатели рассчитывались автоматически. Методика измерения показателей соответствует рекомендациям, отраженным в инструкции к аппарату «VaSera-1000».

Для оценки морфометрических характеристик сердца на начало исследования использовали эхокардиографический сканер Vivid 7 – ULTRASOUND SYSTEM (производитель: «General Electric», США). Определяли следующие традиционные параметры эхокардиографии (ЭхоКГ): фракцию выброса левого желудочка (ФВ ЛЖ) по методу Симпсона, объем левого предсердия (V ЛП), переднезадний размер левого предсердия (ЛП), толщину задней стенки левого желудочка (ТЗС ЛЖ), толщину межжелудочковой перегородки (ТМЖП), индекс массы миокарда левого желудочка (ИММ ЛЖ). Кроме того, проведена тканевая допплерография в импульсно-волновом режиме по стандартной методике из верхушечного доступа в 4-камерном сечении сердца с определением следующих показателей: время замедления раннего диастолического трансмитрального потока (DT), за нормальное значение принят показатель 190±20 мс; отношение скоростей трансмитральных диастолических потоков (E/A) – отношение максимальной скорости раннедиастолического потока (Е) к потоку, обусловленному систолой предсердий (А), оценивали как показатель диастолической функции, в норме показатель от 1,07 до 2,35; систолическая скорость движения стенки левого желудочка (Sν ЛЖ), раннедиастолическая скорость движения боковой стенки; ЛЖ (Еν ЛЖ); позднедиастолическая скорость движения боковой стенки ЛЖ (Аν ЛЖ); раннедиастолическая скорость движения боковой стенки ЛП (Еν ЛП); позднедиастолическая скорость движения боковой стенки ЛП (Аν ЛП).
Исходно биохимическое исследование крови проведено на автоматическом биохимическом анализаторе Sapphire-400 (производитель: Hirose Electronic System, Япония), включая определение следующих параметров: уровни глюкозы, креатинина, общего холестерина (ХС), липопротеидов высокой плотности (ЛПВП); триглицеридов (ТГ). Скорость клубочковой фильтрации (СКФ) рассчитана по формуле CRD-EPI. На первом визите и на V2 у всех пациентов оценивались маркеры, отражающие функцию эндотелия. Уровень фактора Виллебранда (ФВ) оценили количественно на автоматическом коагулометре AutoClot (производитель: RAL, Испания), показатели ингибитора тканевого активатора плазминогена-1 (PAI1) в сыворотке крови определены методом твердофазного иммуноферментного анализа на микропланшетном фотометре Bio-Rad 680 (производитель: Laboratories Inc, США), содержание антитромбина III (АТ III) и плазминогена – с использованием хромогенного субстрата на автоматическом анализаторе гемостаза АС-4, (производитель: Helena, Великобритания). Забор венозной крови проведен по стандартной методике, в спокойном состоянии пациента, в одно и то же время и в интервале между 7.30 и 9.30 при помощи силиконизированных вакутейнеров с консервантом.
Результаты исследования были обработаны с использованием стандартных пакетов программ Correspondence Analysis ППП «Statistica 6.0 for Windows» для статистического анализа. Рассчитаны средние величины, их средние стандартные ошибки с оценкой различий по t-критерию Стьюдента. Описание нормально распределенных количественных признаков было приведено с указанием среднего значения признака и среднего квадратичного отклонения (M±SD). Использована описательная статистика с применением параметрического критерия – t-критерия Стьюдента. Для описания признаков с распределением, отличным от нормального, указана медиана – верхний (25-й) и нижний (75-й) квартили – Me [Q25; Q75]. Осуществлены однофакторный корреляционный (в т.ч. непараметрический) и регрессионный анализы с расчетом коэффициента корреляции Спирмена (r). Различия между изучаемыми параметрами признаны статистически значимыми при <0,05.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом Самарского государственного медицинского университета.
Результаты исследования
При сравнении основных демографических показателей в двух группах больных достоверной разницы установлено не было (табл. 1).
Пациенты обеих групп исходно также сравнивались по следующим клиническим признакам: выраженности неврологического дефицита (по шкале NIHSS – National Institutes of Health Stroke Scale), длительности ФП, тяжести риска развития кровотечения (по шкале HAS-BLED), наличию сопутствующей патологии. Большинство больных в обеих группах имели персистирующую форму ФП. Пациенты основной и группы сравнения в 100% случаев имели АГ. Следует обратить внимание на высокий процент СД в обеих группах, являющегося независимым фактором риска развития ЭД и изменений жесткости сосудистой стенки. Обращает на себя внимание высокий удельный вес ХБП в структуре сопутствующей патологии. Именно коморбидность определяла клиническую тяжесть состояния больных и прогностически неблагоприятное течение заболевания пациентов в обеих группах.
Результаты ЭхоКГ, подробно представленные в табл. 2, демонстрируют, что на момент начала исследования у пациентов двух групп имело место изменение всех морфометрических и функциональных параметров сердца.
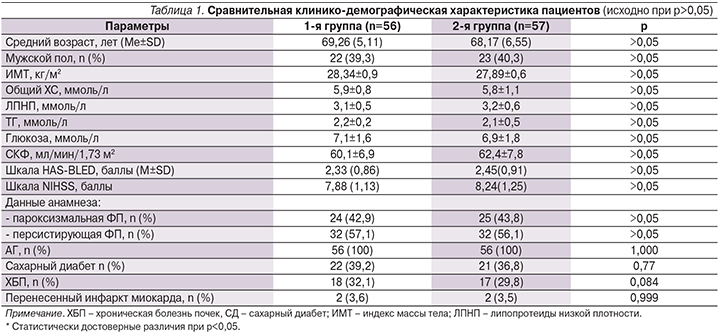
Особенно следует обратить внимание на увеличение размеров ЛП и ЛЖ, а также на увеличение показателя DT с уменьшением отношения скоростей E/A, что свидетельствует о выраженных процессах ремоделирования как желудочков, так и предсердий. Исходно во всех группах были оценены показатели, отражающие параметры артериальной жесткости, которые подробно представлены в динамике в табл. 3.
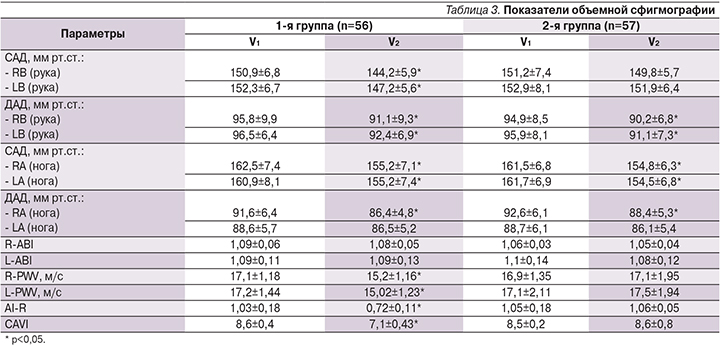
При анализе полученных нами данных отмечено, что у пациентов, принимавших антикоагулянтную терапию, показатели, отражающие артериальную жесткость, имели статистически значимую положительную динамику через 6 месяцев: R-PWV (pV1–V2=0,0025), L-PWV(pV1–V2=0,0021), AI-R (pV1–V2=0,0019), CAVI (pV1–V2=0,0015). В группе сравнения наблюдалось отсутствие изменений всех показателей, за исключением CAVI. Отмечено статистически значимое увеличение CAVI на момент окончания наблюдения (pV1–V2=0,033), что отражает ухудшение параметров артериальной жесткости в отличие от таковых у пациентов основной группы, где было отмечено статистически значимое снижение CAVI. Исходно во всех группах были оценены показатели, отражающие функцию эндотелия, подробно представлены в т.ч. и в динамике (табл. 4).
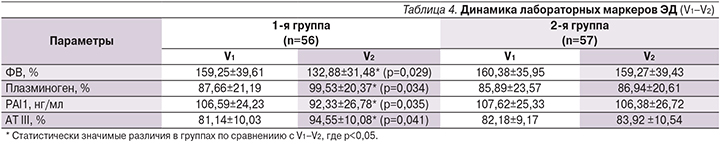
У пациентов 1-й группы за время наблюдения выявлено отчетливое статистически значимое улучшение всех изучаемых маркеров ЭД в отличие от больных 2-й группы, где все показатели не имели статистически значимых изменений. Для уточнения характера взаимосвязи изменений параметров артериальной жесткости с показателями ЭД был проведен корреляционный анализ. Через 6 месяцев наблюдения у больных 1-й группы отмечена сильная корреляционная связь между CAVI и следующими показателями ЭД: ФВ, % (r=0,67; р=0,0022); плазминоген, % (r=0,58; р=0,0026); PAI1, нг/мл (r=0,49; р=0,0014); АТIII, % (r=0,55; р=0,002).
Обсуждение
Методика оценки артериальной жесткости с помощью аппарата «VaSera-1000» проста, удобна и информативна для проведения клинических исследований, а также для использования в условиях реальной клинической практики с учетом неинвазивности и автоматической регистрации всех параметров. Достаточно часто в клинических исследованиях в качестве прогностического маркера используется параметр ABI. Показатель ABI значимо коррелирует с показателями АД, очень чувствителен к изменениям АД в момент исследования, представлял для нас несомненный интерес. В работе J. Gronewold и соавт. (2014) показано, что ABI является объективным показателем, отражающим популяционные риски развития фатального и нефатального ишемического инсульта [15]. Увеличение ABI самостоятельно указывает на прогрессирование артериальной жесткости с высокими рисками развития повреждения сосудов головного мозга, формированием их резистивного типа [16]. Нами в динамике не было отмечено изменения данного параметра в обеих группах с отсутствием корреляции ABI у больных, принимавших антикоагулянты, и пациентов 2-й группы на момент окончания исследования с показателями ЭД. По результатам 26-месячного наблюдения за пациентами с ФП в опубликованном исследовании S.C. Chen и соавт. (2016) представлено заключение, согласно которому СРПВ служит независимым предиктором сердечно-сосудистых событий в проведенном многомерном анализе для данной категории больных [17]. Кроме того, авторы делают следующий вывод: добавление этого показателя в модель Кокс, состоящую из стандартных клинических, биохимических и ЭхоКГ-параметров, позволяет более точно прогнозировать развитие неблагоприятных сердечно-сосудистых событий у пациентов с ФП. Однако в клинических исследованиях у пациентов с коморбидным профилем достаточно сложно объективизировать параметры жесткости сосудистой стенки, т.к. принимаемые лекарственные средства, в первую очередь иАПФ, БРА, β-адреноблокаторы, существенным образом на них влияют. И даже период «отмывки» не гарантирует искажения результатов. Наиболее достоверным параметром является CAVI как показатель, отражающий сосудистую жесткость и независящий от АД [18].
Измерение CAVI позволяет достоверно оценить артериальную жесткость у пациентов с ФП после острого нарушения мозгового кровообращения в сочетании с АГ, ишемической болезнью сердца, хронической сердечной недостаточностью. Более того, воспроизводимость измерений очень высока и может быть легко выполнена в любых клинических условиях. Это особенно актуально для пациентов с нестабильным профилем АД и длительной АГ. Также CAVI является независимым маркером, отражающим истинную артериальную жесткость сосудов мелкого калибра, которые максимально подвержены патофизиологическим изменениям в условиях коморбидной патологии [19]. Считаем, что в условиях нестабильной гемодинамики при ФП, особенно в период возникновения пароксизмов, происходят дополнительные колебания сосудистой стенки на уровне мелких сосудов, которые не успевают адекватно «отреагировать», что приводит к вторичному повышению систолического давления в аорте и дальнейшему нарушению перераспределения крови в паренхиме органов и тканей, в первую очередь в головном мозге и почках. Артериальная жесткость приводит к увеличению дополнительной нагрузки на мелкие церебральные и почечные сосуды, будучи напрямую связанной в т.ч. с атеросклеротическими процессами [20, 21].
Полученные нами данные на начало исследования свидетельствовали о статистически значимом увеличении CAVI по сравнению с номограммами для соответствующего возраста в двух группах больных. Однако мы не ожидали столь высокой разницы по результатам шести месяцев между результатами, полученными от пациентов 1-й и 2-й групп. Наше исследование показало значимые различия между показателями CAVI в двух группах больных, таких как параметр, не зависящий от уровня АД в момент регистрации и отражающий истинную жесткость стенки сосудов. При анализе значений CAVI мы ориентировались на работы, представляющие данные обследований выборок лиц отечественной популяции [19]. Следует отметить, что в нашем исследовании пациенты по своему соматическому статусу были тяжелые, что безусловно делало их заведомо «компрометированными» по тяжести выраженности артериальной жесткости. Отмечено статистически значимое снижение CAVI у пациентов, принимавших антикоагулянты, и его достоверные корреляции с показателями, отражающими функцию эндотелия.
В соответствии с критериями включения в исследование вошли пациенты, у которых в выписках имелись рекомендации по приему НПОАК.
К сожалению, в условиях реальной клинической практики таких пациентов крайне мало из-за низкой приверженности больных антикоагулянтной терапии. Действие антикоагулянтной терапии на систему гемостаза известно. Наше исследование демонстрирует возможности влияния апиксабана на параметры артериальной жесткости и функции эндотелия у пациентов, перенесших КЭИ, с пароксизмальной или персистирующей формами неклапанной ФП.
Заключение
В проведенном исследовании мы получили достоверные результаты по улучшению артериальной жесткости во взаимосвязи с уменьшением выраженности ЭД у лиц с ФП, перенесших инсульт, принимавших апиксабан в течение 24 недель, что позволяет нам предположить наличие дополнительных плейотропных свойств у данного препарата.
Мы признаем, что наше исследование имело ряд ограничений: небольшая выборка, открытый дизайн, что не позволяет полностью исключить влияние сопутствующих факторов и сформулировать популяционные выводы. Тем не менее считаем, что наши данные позволят в дальнейшем направить усилия на проведение исследований, более полно отражающих влияние антикоагулянтной терапии при ФП на риски развития тромбоэмболических событий, в аспекте ее влияния на артериальную жесткость и ЭД, в т.ч. с рассмотрением ее плейотропных эффектов.



