Введение
Фибрилляция предсердий (ФП) является наиболее распространенной аритмией и наджелудочковой тахиаритмией, встречающейся в клинической практике, частота которой увеличивается с возрастом (от <0,5% в возрасте 40–50 лет до 5–15% в возрасте 80 лет) [1]. Согласно недавно опубликованным результатам исследования «Global Burden of Disease, Injury, and Risk Factor Study 2019», включившим в т.ч. информацию о распространенности ФП в 204 странах за период с 1990 по 2019 г., в 2019 г. во всем мире насчитывалось в среднем около 59,7 млн пациентов с ФП, причем 4,7 млн из них диагноз ФП был поставлен впервые и более чем у 0,3 млн наступил летальный исход вследствие данного заболевания [2]. Также установлено, что за последние 20 лет глобальное бремя ФП значительно увеличилось, например прирост по числу вновь заболевших с 1990 по 2019 г. составил 103,9%, по числу летальных исходов – 169,2% [2]. По данным А.С. Колбина и соавт. [3], в Российской Федерации с 2010 по 2017 г. распространенность ФП увеличилась на 44%. При этом следует отметить, что среди лиц в возрасте 45–69 лет (по данным популяционной российской выборки, Новосибирск), оцененной в рамках проекта HAPIEE (Health, Alcohol and Psychosocial factors In Eastern Europe), частота ФП за 13 лет наблюдения при старении увеличилась с 1,6 до 8,3% (2003–2005 гг. – первый скрининг, 2015–2018 гг. – третий скрининг) [4]. По прогнозам, в связи со старением населения и увеличением частоты сочетанной патологии, включая сердечно-сосудистые заболевания (ССЗ), в частности артериальную гипертензию (АГ), сердечную недостаточность (СН), ишемическую болезнь сердца (ИБС) и хроническую болезнь почек (ХБП), сахарный диабет (СД) и ожирение, в ближайшие 50 лет частота ФП в странах Европейского Союза увеличится более чем в 2 раза [1].
Осложнения ФП включают повышенный риск инсульта, СН, деменции и преждевременной смерти [5]. Сопутствующие симптомы ФП включают боль в груди, учащенное сердцебиение, утомляемость, головокружение, обмороки, одышку и снижение переносимости физической нагрузки [6]. В этом контексте следует отметить, что последние данные свидетельствуют также и о растущем бремени симптомов и осложнений, связанных с ФП, на систему здравоохранения. Например, число госпитализаций по поводу ФП в Австралии за последние годы увеличилось практически на 295%, и в настоящее время ФП является наиболее частой причиной госпитализаций по поводу ССЗ в данной стране [7, 8]. В Российской Федерации расчетное число госпитализаций по поводу ФП находится в пределах 435,7–1227,0 тыс. госпитализаций в год, составляя примерно треть от всех госпитализаций кардиологического профиля [3]. По данным скорой медицинской помощи Москвы, на долю вызовов по поводу нарушений ритма сердца от общего числа ССЗ приходилось 17% случаев, при этом из них на ФП – 88% [9].
С 2010 по 2017 г. стоимость госпитализации на одного пациента и затраты на госпитализацию в год в нашей стране увеличились на 47 и 35% соответственно, при этом бремя на лечение ФП за 7 лет выросло на 15% [3]. Эти тенденции вызывают беспокойство и предполагают, что существует необходимость переоценки текущих подходов к профилактике и лечению ФП, а также в изучении новых методов лечения.
Анемия часто встречается у пациентов с ФП, достигая, по данным некоторых исследований, 12–54% [10–14]. В Российской Федерации, по данным амбулаторных и госпитальных регистров РЕКВАЗА (n=3169) [15], анемия отмечена у 6,3% больных ФП, причем среди амбулаторных пациентов встречаемость анемии достигала 9,3% (для сравнения: у госпитальных больных – 5,1%; p<0,05). Как и в случае с ФП, распространенность анемии увеличивается с возрастом [16]. Вместе с тем, с одной стороны, предполагается, что наиболее очевидный вклад в развитие анемии у пациентов с ФП вносят кровотечения, риски которых увеличиваются при применении антикоагулянтов (АК), часто назначаемых пациентам с ФП для предотвращения тромбоэмболических событий (при этом следует отметить, что риски кровотечений у пациентов с ФП разняться в зависимости от АК, что предполагает неравнозначный профиль безопасности конкретных препаратов у больных ФП и в особенности у больных ФП с анемией), а также ХБП (преимущественно у лиц пожилого возраста).
С другой стороны, имеются сведения, согласно котрым более низкие уровни Hb и анемия могут быть связаны с развитием впервые возникшей ФП [17, 18] и у пациентов с анемией также может с большей вероятностью возникать клинический рецидив ФП [19]. Одной из причин последнего рассматривается связь ФП с дефицитом микроэлементов и витаминов, участвующих в эритропоезе, поскольку анемия также распространена при других ССЗ, где она была охарактеризована более полно, и часто вызывается дефицитом железа (ДЖ). Например, было показано, что при СН ДЖ, который может присутствовать независимо от анемии, отмечается у 55% пациентов с хронической СН и у 80% пациентов с острой СН [20]. Кроме того, пациенты с СН и ДЖ имеют неблагоприятные симптомы и сердечно-сосудистые исходы независимо от статуса анемии [20]. Потенциальные воздействия СН и ДЖ на пациентов с ФП изучались в сравнительно меньшем числе исследований. И это несмотря на то что ФП и СН обычно сосуществуют у одного больного, имеют общие ключевые факторы риска и схожие патофизиологические механизмы и предрасполагают друг к другу.
Таким образом, с учетом растущей частоты ФП, высокой распространенности анемии в данной категории больных для клинической практики является крайне важным получить ответы на вопросы: как взаимосвязаны ФП и анемия, как анемия влияет на течение заболевания, включая риски развития кровотечений у больных ФП, принимающих АК, а также какой АК более предпочтителен по профилю безопасности у пациентов с ФП и анемией? Этим вопросам посвящен настоящий обзор.
Взаимосвязь ФП и анемии
Роль анемии в развитии ФП. Анемия является фактором риска ССЗ, но ее влияние на впервые возникшую ФП в настоящее время точно не определено. Вместе с этим имеются сведения, указывающие на наличие данной взаимосвязи. Так, в корейском популяционном исследовании, оценивавшем влияние уровней Hb и их изменений на риск развития ФП у >9,6 млн человек в возрасте ≥40 лет (средний возраст – 55,6±10,6 года; 49,8% мужчин; период наблюдения 7–8 лет), показано, что наличие анемии, определяемой как уровень Hb крови <130 г/л у мужчин и <120 мг/л у женщин, было значимым фактором риска развития ФП (отношение рисков [ОР]=1,39; 95% доверительный интервал [ДИ]: 1,38–1,41; р<0,001) [21]. При этом данная связь оставалась статистически значимой даже после поправки на возраст, пол, индекс массы тела, традиционные факторы риска ССЗ (курение, употребление алкоголя, гиподинамия, АГ, СД, дислипидемия, низкий социальный статус) и такие заболевания, как ИБС, застойная СН, инсульт, ХБП, хроническая обструктивная болезнь легких, обструктивное апноэ сна и заболевания щитовидной железы (ОР=1,06, 95% ДИ: 1,05–1,08; р<0,001) [21]. Кроме того, была установлена U-образная связь между уровнем Hb и риском возникновения ФП после поправки на сердечно-сосудистые факторы риска [21]. При этом заболеваемость ФП была самой низкой при уровне Hb=140–149 г/л у мужчин и 120–129 г/л у женщин. Также исследователи подметили, что среди лиц с уровнем Hb в пределах нормы на первом визите снижение уровня Hb при втором измерении (через 2–3 года) свидетельствовали о повышении риска ФП на 11 и 3% у мужчин и женщин соответственно по сравнению с теми, у кого уровень Hb оставался нормальным [21].
В другом популяционном исследовании, проведенном в Японии и включившем 132 250 человек в возрасте 40–79 лет со средним периодом наблюдения 13,8 года, получены схожие результаты: анемия, оцениваемая как уровень Hb крови <130 г/л у мужчин и <110 мг/л у женщин, увеличивала в 1,5 раза риск развития ФП (скорректированное1 ОР=1,50, 95% ДИ: 1,24–1,83; p<0,0001) [22]. Вместе с тем следует отметить, что ученые также оценили связь ФП с уровнем скорости клубочковой фильтрации (СКФ), соответствовавшей ХБП С1, С2 и С3а, и сочетанное влияние анемии и ХБП на риски развития ФП.
В результате только пациенты с ХБП С2 и С3а (СКФ от 60 до 90 мл/мин/1,73 м2 и <60 мл/мин/1,73 м2) имели статистически значимо в 1,38 и 2,56 раза выше риск развития ФП соответственно (скорректированное ОР=1,38, 95% ДИ: 1,21–1,56; p<0,0001; и скорректированное ОР=2,56, 95% ДИ: 2,09–3,13; p<0,0001), а при наличии анемии взаимосвязь с ФП была сильнее и наблюдалась при всех оцениваемых уровнях СКФ: ХБП С1 (СКФ>90 мл/мин/1,73 м2)+анемия; ОР=1,23 (95% ДИ: 1,04–1,48; р=0,0180); ХБП С2 (СКФ 60≤90 мл/мин/1,73 м2)+анемия; ОР=2,26 (95% ДИ: 1,60–3,17; р<0,0001); ХБП С3а (СКФ<60 мл/мин/1,73 м2)+анемия; ОР=3,22 (95% ДИ: 2,43–4,19; р=0,0003) [22]. Таким образом, был сделан следующий вывод: анемия независимо связана с повышенным риском развития ФП, однако при наличии ХБП этот риск увеличивается в соответствии со снижением СКФ.
В этом контексте следует отметить, что причиной развития анемии у пациентов с ХБП является нарушение выработки эритропоэтина в почках.
В крупном общенациональном когортном исследовании апластической анемии на Тайване, пациенты с апластической анемией также имели более высокий риск возникновения ФП по сравнению с общей популяцией после учета конкурирующего риска смерти (ОР=1,21, 95% ДИ: 0,97–1,50) [23].
Патогенетические механизмы, объединяющие анемию и ФП, сложны и многофакторны, а некоторые аспекты этой взаимосвязи и вовсе не изучены. Тем не менее не вызывает сомнений, что хроническая анемия оказывает значимое влияние на гемодинамику, поскольку она способствует повышению нагрузки на сердце за счет тахикардии и увеличения ударного объема, что в свою очередь вызывает почечную вазоконстрикцию и задержку жидкости, формируя порочный круг между анемией, СН и ХБП [24]. Кроме того, анемия является независимым предиктором развития гипертрофии левого желудочка (ЛЖ) [24]. Например, в субисследовании MONICA Augsburg (MONItoring trends and determinants in CArdiovascular disease) была хорошо продемонстрирована связь между уровнем гематокрита/Hb и геометрией ЛЖ (включая показатели массы миокарда ЛЖ и толщины стенки ЛЖ), имеющая U-образную форму [25].
В этом контексте становится ясным, что ремоделирование ЛЖ чаще развивалось у лиц с низким или высоким уровнем гематокрита/Hb. Вместе с тем следует отметить, что это может быть причиной того, что низкие уровни Hb увеличивают риск ФП, поскольку гипертрофия ЛЖ сама по себе является независимым фактором риска возникновения ФП [26].
Также следствием нарушения функции ЛЖ и повышенного давления наполнения ЛЖ является структурное функциональное ремоделирование левого предсердия (ЛП). Однако ремоделирование ЛП, по-видимому, начинается на ранней стадии ремоделирования ЛЖ или его диастолической дисфункции [27, 28]. T. Katayama et al. [29] показали, что повышенный индекс массы миокарда ЛЖ и низкая концентрация Hb были независимо связаны с увеличением ЛП у пациентов с нормальной систолической функцией ЛЖ. Этот результат свидетельствует о том, что гемодинамические изменения при низком уровне Hb могут влиять на ремоделирование ЛП и развитие ФП до появления заметных изменений, таких как гипертрофия ЛЖ или систолическая дисфункция.
Помимо гемодинамически опосредованных механизмов взаимосвязи анемии и ФП выделяют еще метаболические и воспалительные пути, а также пути, связанные с дефицитом микроэлементов и витаминов, влияющих на эритропоэз. Так, имеются сведения, что в патогенезе анемии одну из ключевых ролей играют ДЖ и повышенный уровень воспалительных цитокинов [24]. Влияние последних было обнаружено и при ФП, например у пациентов с ожирением и наличием эктопической жировой ткани в области эпикарда [1, 30, 31]. Известно, что эпикардиальная жировая ткань обладает доказанной паракринной функцией, которая может быть ассоциирована с воспалительными и фиброзными изменениями миокарда у пациентов с ФП, причем даже без структурных заболеваний сердца, хотя механизмы указанного феномена неясны. Так, например, по данным исследования Е.З. Голуховой и соавт. [31], толщина эпикардиального жира и доля фиброза миокарда, определяемая с помощью магнитно-резонансной томографии, достоверно были связаны с биохимическими маркерами фиброза и воспаления (трансформирующий фактор роста β1, матриксные металлопротеиназы 9, тканевой ингибитор 1) у пациентов с ФП без ИБС.
Данные о ДЖ – наиболее частой причине анемии, при ФП ограниченны, но предварительные результаты указывают на то, что его распространенность не может быть незначительной и может коррелировать с тяжестью ФП и клиническими исходами. Так, по данным международной базы данных «National Inpatient Sample», включающей более 5,9 млн человек, установлено, что у 2,5% пациентов с первичной госпитализацией по поводу ФП был ДЖ [32]. В другом исследовании наблюдались значимо отличные цифры: из 127 пациентов с ФП и без СН у 25,7% отмечалась анемия и у 47,6% был ДЖ (определенный в соответствии с рекомендациями Европейского общества кардиологов по СН), при этом распространенность последнего в контрольной группе того же возраста и пола составила 20% [13]. Частота ДЖ у пациентов с постоянной ФП достигала 50%, а у пациентов с персистирующей ФП – 30% [13]. Кроме того, было установлено, что постоянная и пароксизмальная ФП были статистически значимо связаны с ДЖ по данным однофакторного регрессионного анализа (отношение шансов – ОШ=2,17, 95% ДИ: 0,82–5,69; р=0,011), а при многофакторном анализе лишь постоянная ФП оставалась независимым клиническим признаком ДЖ (ОШ=4,30, 95% ДИ: 0,83–12,07; р=0,039) [13]. Также следует отметить, что исследователями был обнаружен в данной когорте пациентов с ФП без СН не только ДЖ, но и дефицит витамина В12 и фолиевой кислоты, частота которых составила 9,9 и 12,9% соответственно [13]. В связи с полученными результатами этой группой ученых в мае 2019 г. инициировано исследование AID-AF (Prevalence and Clinical Associates of Iron Deficiency in Patients With Atrial Fibrillation), которое должно было завершиться в марте 2022 г.2, однако в настоящий момент связанных публикаций найдено не было. Вместе с тем с учетом накапливающихся данных о связи ДЖ с ФП изучению подлежит и коррекция данного дефицита в этой группе больных. Например, учеными из Австралии в марте 2020 г. было зарегистрировано исследование IRON-AF3, являющееся по дизайну двойным слепым рандомизированным плацебо-контролируемым исследованием по оценке влияния внутривенного введения карбоксимальтозы железа на толерантность к физической нагрузке пациентов с ФП и ДЖ. В настоящее время опубликован только дизайн исследования и его обоснование [33].
Влияние анемии на течение ФП. Все большее число исследований демонстрирует, что наличие анемии связано с повышенным риском кровотечений, сердечно-сосудистых осложнений и общей смертности у пациентов с ФП [10, 12, 15, 16, 34]. Однако причины этих ассоциаций остаются неясными и недостаточно изученными.
Влияние анемии на течение ФП и риски развития осложнений подробно представлены в табл. 1.
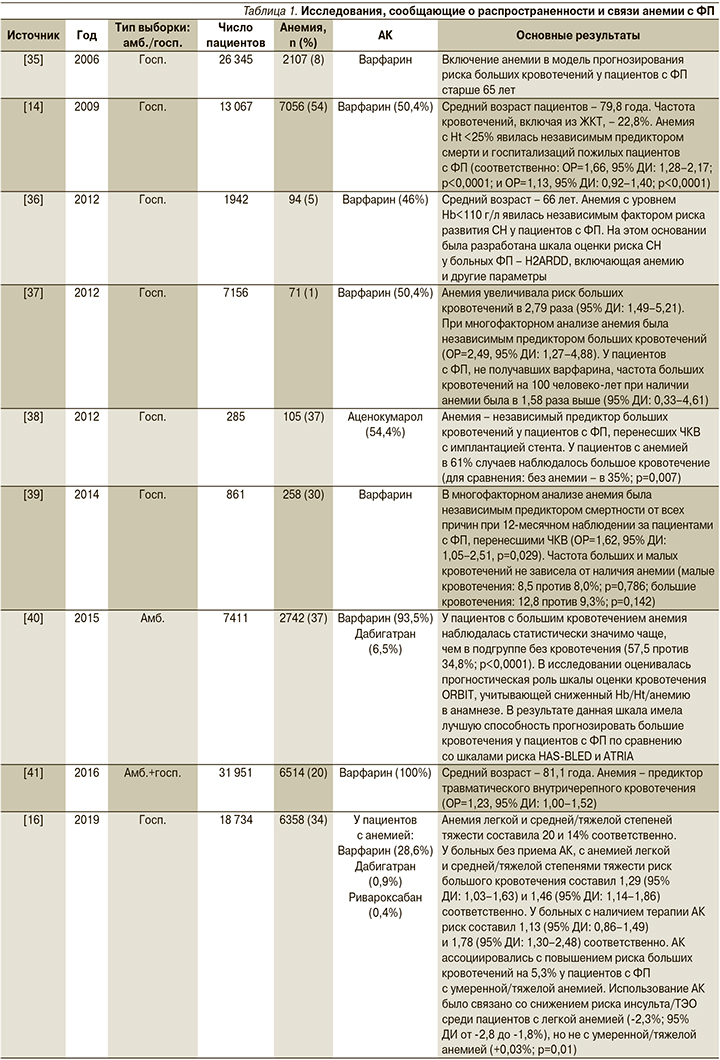
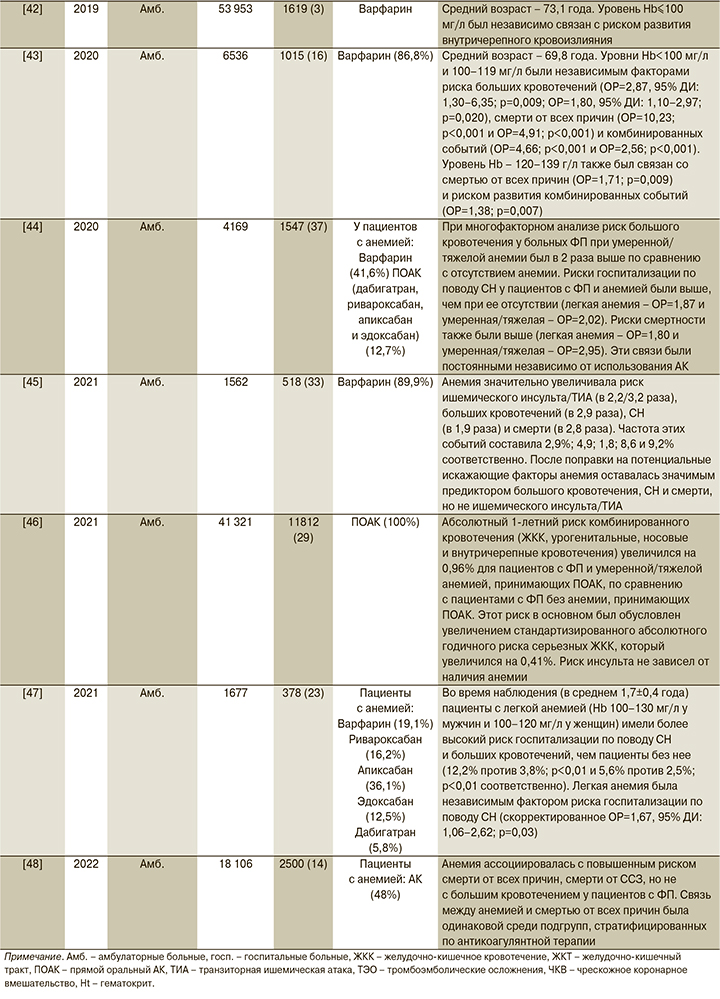
АК при ФП и анемии. Прямые оральные АК (ПОАК) обеспечивают бóльшую безопасность, удобство и эффективность по сравнению с антагонистами витамина К, такими как варфарин [49]. Благодаря этим свойствам ПОАК получают признание в качестве препаратов первой линии для профилактики инсульта при ФП и лечения венозной тромбоэмболии [1, 49]. Однако ПОАК внутри класса имеют различия. Например, в опорных исследованиях ПОАК дабигатран, ривароксабан и режим с более высокими дозами эдоксабана были связаны с повышенным риском развития больших желудочно-кишечных кровотечений (ЖКК) по сравнению с варфарином [50–52], а пациенты, принимавшие апиксабан, напротив, не имели более высоких показателей ЖКК [53]. Вместе с тем между ПОАК существуют еще различия по безопасности, в особенности при применении у больных ФП и анемией. Одни из основных исследований АК, в которых оценивалась анемия и связанные с ней риски осложнений у больных ФП, представлены в табл. 2.
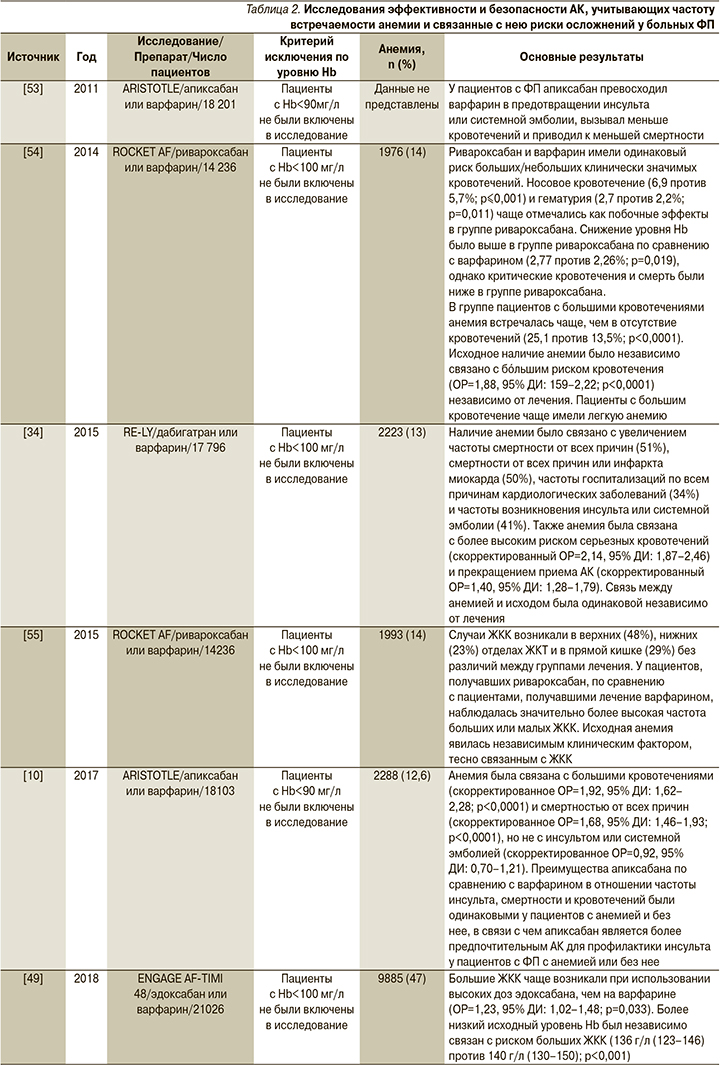
Исходя из табл. 2, видно, что апиксабан у пациентов с ФП с анемией является более безопасным АК, чем варфарин. Кроме того, следует отметить, что по сравнению с другими исследованиями ПОАК апиксабан использовался у пациентов с более низкими пороговыми значениями уровня Hb, что, вероятно, также косвенно указывает на благоприятный профиль безопасности данного препарата у больных ФП и анемией легкой и средней степенями тяжести. Следует отметить, что прямых сравнительных рандомизированных контролируемых исследований между ПОАК не проводилось.
Безопасность и эффективность применения отдельных ПОАК в сравнении как с варфарином, так и друг с другом оценивалась в ряде исследований. Например, в ретроспективном когортном исследовании пациентов с ФП, включенных в программу Medicare в США, которые начали прием варфарина (n=183 318) или стандартной дозы дабигатрана (150 мг 2 раза в день; n=86 198), ривароксабана (20 мг один раз в день, n=106 389) или апиксабана (5 мг 2 раза в сутки, n=73 039), установлено, что частота анемии статистически значимо не различалась между препаратами (р=0,06), хотя процент встречаемости анемии на фоне терапии варфарином был выше, чем при ПОАК (21,5%) [56]. Также показано, что по сравнению с варфарином каждый ПОАК был связан с бóльшим снижением риска тромбоэмболического инсульта (снижение на 20–29%; р=0,002 для дабигатрана, р<0,001 для ривароксабана и апиксабана), внутричерепного кровоизлияния (снижение на 35–62%; р<0,001 для каждого ПОАК) и смертности (снижение на 19–34%; р<0,001 для каждого ПОАК) [56]. Вместе с тем прием ривароксабана по сравнению с апиксабаном был ассоциирован с бóльшим риском развития крупного экстракраниального кровотечения (ОР=2,70, 95% ДИ: 2,38–3,05), большого ЖКК (ОР=2,83, 95% ДИ: 2,47–3,25) и смертности от всех причин (ОР=1,23, 95% ДИ: 1,09–1,38) [56]. Прием дабигатрана по сравнению с апиксабаном также был ассоциирован с бóльшим риском развития крупного экстракраниального кровотечения (ОР=2,04, 95% ДИ: 1,78–2,32) и большого ЖКК (ОР=2,23, 95% ДИ: 1,93–2,58) [56].
В другом сравнительном исследовании ученые хотели получить ответ на вопрос, какой ПОАК имеет наиболее благоприятный профиль безопасности для ЖКТ больных ФП и риском развития ЖЖК, и для этого провели сравнение различий между этими препаратами в данной категории больных [57]. В результате в группе ривароксабана по сравнению с апиксабаном отмечалось больше случаев кровотечений (116 против 32) при среднем времени до события 60–67 дней [57]. Общая частота ЖКК при применении ривароксабана также была выше по сравнению с апиксабаном: 3,54/100 человеко-лет против 1,34/100 человеко-лет соответственно [57]. В целом апиксабан был на 66% безопаснее (ОР=0,33, 95% ДИ: 0,22–0,49), чем ривароксабан [57]. Кроме того, в пожилой возрастной категории (65–74 года, 75 лет и старше) апиксабан вызывал меньше ЖКК, чем ривароксабан: апиксабан был на 82% безопаснее среди пациентов в возрасте 65–74 лет (ОР=0,18, 95% ДИ: 0,07–0,47) и на 61% безопаснее среди пациентов 75 лет и старше (ОР=0,39, 95% ДИ: 0,25–0,61) по сравнению с ривароксабаном [57]. Расчет снижения абсолютного риска и индекса потенциального вреда на основе годовой частоты ЖКК продемонстрировал более благоприятный профиль безопасности апиксабана для ЖКТ по сравнению с ривароксабаном [57].
По данным M. Guo et al. [58], оценивавшим сообщения о геморрагических явлениях при применении ривароксабана, апиксабана и дабигатрана, общее число сообщений о кровотечениях, связанных с применением ривароксабана, составило 53 085, а число сообщений о кровотечениях, связанных с применением дабигатрана и апиксабана – 14 100 и 13 151 соответственно. Общее ОШ (95% ДИ) сообщений о геморрагических явлениях, зарегистрированных для ривароксабана по сравнению с дабигатраном и апиксабана по сравнению с дабигатраном, составило 1,58 (1,54–1,62) и 0,47 (0,46–0,48) соответственно [58]. ОШ (95% ДИ) сообщений о геморрагических явлениях в ЖКТ, нервной системе, почечной и мочевыделительной системах, коже и подкожной клетчатке, а также в глазной системе для апиксабана по сравнению с дабигатраном составили 0,28 (0,27–0,29), 0,69 (0,66–0,73), 0,31 (0,29–0,29–0,34), 0,98 (0,86–1,12) и 1,18 (1,00–1,39) соответственно [58]. Таким образом, можно сделать вывод: применение апиксабана ассоциировано с меньшим числом сообщений о кровотечениях разной локализации, при этом апиксабан более безопасен с этой позиции, чем дабигатран.
Заключение
Между ФП и анемией существует тесная взаимосвязь. Однако ее точные патогенетические механизмы в настоящее время еще до конца не определены.
Сосуществование ФП и анемии увеличивает бремя сопутствующих заболеваний и связано с повышенным риском развития побочных эффектов. В связи с этим при ведении таких пациентов необходимо персонализировать подходы к терапии, в особенности к антикоагулянтной терапии. Так, на основании проведенного анализа литературы представляются убедительными доказательства того, что применение такого ПОАК, как апиксабан, у больных ФП и анемией может рассматриваться как терапия выбора, обладающая оптимальным профилем эффективности и безопасности.



