Введение
Микроорганизм Helicobacter pylori встречается повсеместно. Более половины населения земного шара инфицированы этой грамотрицательной спиралевидной бактерией. Эпидемиологию H. pylori-инфекции изучают на основании данных неинвазивных методов диагностики. К числу наиболее распространенных методик скрининга относятся определение антигена в стуле моноклональными антителами при помощи иммуноферментного анализа, серологический метод (антитела класса IgG к трем и более антигенам микроорганизма) и изотопный 13С/14С-уреазный дыхательный тест. Распространенность H. pylori коррелирует с социально-экономическим статусом региона и составляет от 40 до 80% [1]. Столь высокая частота инфицированности популяции способствовала дискуссии о целесообразности уничтожения микроорганизма. Однако анализ данных по частоте развития рака желудка среди неинфицированных людей и лиц с H. pylori позволил международному агентству по изучению рака (IARC) Всемирной организации здравоохранения опубликовать отчет с красноречивым названием «Эрадикация Helicobacter pylori как стратегия предотвращения рака желудка» [2]. Кроме того, H. pylori является не только канцерогеном 1-й группы, но и лидером среди всех известных доказанных биологических канцерогенов человека, опережая вирус папилломы человека и вирусы гепатита С и В [3]. Этот факт послужил основой для принятия международными экспертами глобального Киотского консенсуса, поставившего точку в споре между сторонниками «хорошего» и «плохого» хеликобактера при H. pylori-ассоциированном гастрите [4]. В российских рекомендациях, посвященных H. pylori, уничтожение патогенного микроорганизма также рекомендовано всем инфицированным с позиции излечения гастрита, снижения риска развития язвенной болезни и рака желудка [5–7].
Расширение показаний к эрадикации хеликобактера требует ответственного подхода к точной диагностике инфекции. Особенно актуален неинвазивный скрининг H. pylori с учетом внедрения в клиническую практику стратегии «тестируй и лечи» для пациентов моложе 45 лет без симптомов «тревоги» для профилактики рака или осложнений язвенной болезни [8].
Целью данной работы было получение эпидемиологических данных по инфицированности H. pylori пациентов гастроэнтерологического профиля в Санкт-Петербурге.
Материал и методы исследования
На наличие H. pylori с определением степени инфицированности микроорганизмом обследован 4181 пациент в возрасте от 18 до 79 лет, обратившийся к гастроэнтерологу или терапевту с жалобами со стороны желудочно-кишечного тракта. Всем больным был выполнен 13С-уреазный дыхательный тест с меченой мочевиной – 13С-карбамидом. Принцип метода основан на высокой субстратной специфичности (уреазно-ферментативной активности) H. pylori, посредством которой происходит ферментативный гидролиз принятой внутрь меченой мочевины до углекислого газа и аммиака (рис. 1). 13С-мочевина представляет собой порошок С-диамид угольной кислоты с замещением одного стабильного изотопа углерода 12С на другой – 13С – до 99%. Международное непатентованное название – 13С-мочевина (код V04cx, согласно анатомо-терапевтическо-химической классификации, рекомендованной Всемирной организацией здравохранения).
В природе углерод встречается в виде двух стабильных нерадиоактивных изотопов: «легкого» с массовым числом 12 (12С) и «тяжелого» с массовым числом 13 (13С). Распространенность 12С составляет 98,89%, 13С – 1,11%. Природное соотношение углеродов составляет 0,01122. Изотопной меткой препарата был стабильный нерадиоактивный изотоп углерода 13. Доказана прямая корреляция между уреазной активностью хеликобактера и приращением 13С в выдыхаемом воздухе после приема субстрата [9, 10]. Содержание в выдыхаемом воздухе СО2 и соотношение 13С/12С стабилизированных изотопов определяли с помощью инфракрасного спектрометра IRIS (Kibion/Wagner, Швеция/Германия).
Кроме того, 129 пациентов в возрасте от 19 до 77 лет прошли более углубленное обследование, позволившее сравнить чувствительность различных методов детекции H. pylori, применяемых в реальной клинической практике. Неинвазивные тесты включали 13С-уреазный дыхательный тест по описанной выше методике и серодиагностику. Для серологической диагностики определяли антитела класса IgG к H. pylori в сыворотке крови человека методом иммуноферментного анализа ELISA (Biohit, Финляндия) с очищенным бактериальным антигеном H. pylori. Также всем пациентам проводилась эзофагогастродуоденоскопия с забором биоптатов из антрального отдела для последующей оценки уреазной активности («Хелпил-тест» ООО «АМА», Санкт-Петербург), гистологического исследования с окраской азур-эозином по Романовскому и выявления ДНК H. pylori методом полимеразной цепной реакции (ПЦР) с использованием тест-системы «Хеликобактер-скрин» OOO «Альфалаб» (Санкт-Петербург, Россия), направленной на идентификацию маркерных генов уреазы (ureC, ureI).
Результаты исследования
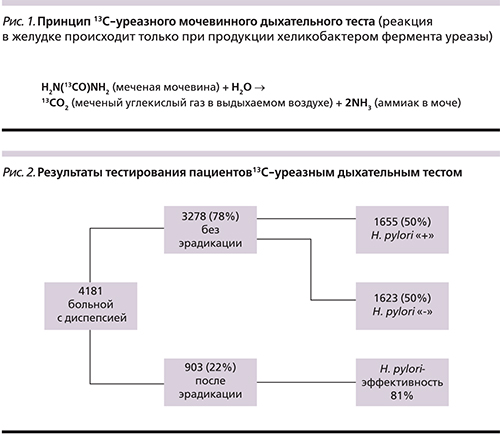
В анализ были включены жители Санкт-Петербурга (n=4181), проходившие амбулаторное обследование с февраля 2014 по июль 2016 г. по направлению гастроэнтеролога или терапевта. Женщины составили 2119 (58%), мужчины – 1536 (42%) человек. Перед выполнением исследования пациентам за 2 недели отменяли антисекреторные препараты и препараты висмута. Кроме того, в течение трех месяцев до исследования пациенты не должны были принимать антибактериальные препараты для лечения инфекций, отличных от хеликобактериоза. Всем пациентам выполнялся четырехточечный 13С-уреазный дыхательный тест. Процедура тестирования включала забор проб выдыхаемого воздуха до приема меченого субстрата (базовый состав воздуха с определением соотношения 13С и 12С), затем через 10, 20 и 30 минут после приема 13С-карбамида с усилителем уреазной активности хеликобактера – лимонной кислотой (для оценки изменений соотношения стабильных углеродов в выдыхаемом воздухе).
Среди тестируемых пациентов 903 человека прошли курс эрадикации в течение 1–5 лет до исследования. Микроорганизм не определялся у 734 ранее пролеченных больных. Эффективность эрадикационной терапии составила 81%.
Из 3278 обследованных пациентов, никогда не проходивших курс эрадикации хеликобактера, 1655 оказались инфицированными H. pylori, что составило 50% (рис. 2).
Группа пациентов, у которых был выявлен хеликобактер, составила 1824 человека. Из них ранее не получали антихеликобактерную терапию 1655 человек, а 169 пациентов оставались инфицированными, несмотря на курс эрадикации. Эти пациенты были распределены в 4 группы на основании уровня уреазной активности микроорганизма [9, 10]. У всех обследованных даже после курса эрадикационной терапии доминировала высокая степень инфицированности (см. таблицу).
Так, 4-я степень инфицированности выявлена у 75 (44%) пациентов после эрадикации в анамнезе и у 910 (55%) без эрадикации. Инфицированность 3-й степени выявлена у 48 (28%) пациентов после курса лечения и у 463 (28%) без эрадикации.
Результаты оценки сопоставимости диагностических тестов на наличие H. pylori
Обследованы 129 пациентов без предшествовавшей эрадикационной терапии с применением всех 5 методик диагностики инфекции.
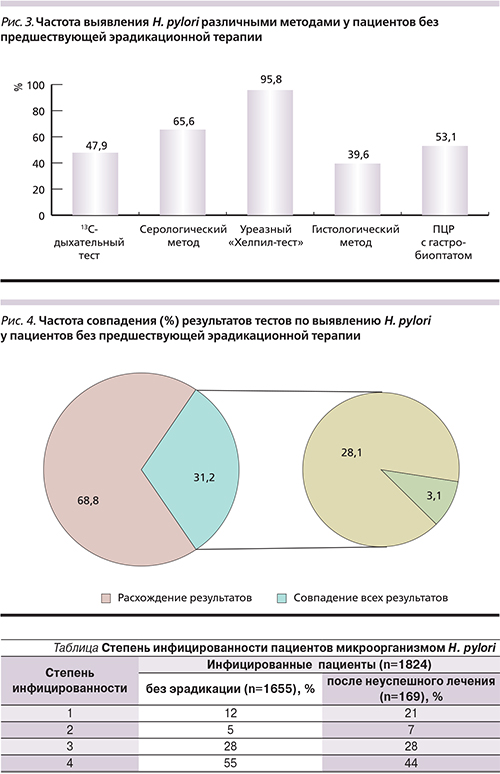
При оценке инфицированности H. pylori пациентов частота выявления бактерии варьировалась в широких пределах в зависимости от метода диагностики (рис. 3). Так, уреазный тест с гастробиоптатами был положительным практически у всех обследованных (94,8%). В то же время положительный результат ПЦР определялся у половины – 53,1%, а гистологически хеликобактер был найден лишь у 39,3% пациентов. При оценке наличия инфекции 13С-уреазным дыхательным тестом результат был положительным в 47,9% случаев. Антитела в диагностическом титре выявлены у 65,6% больных.
Анализ частоты совпадений применяемых в работе тестов показал, что конкордантность результатов 5 методов составила лишь 31,2% (рис. 4). В 23,4% случаев хеликобактер был обнаружен каждым из методов. В оставшихся 71,8% случаев наблюдались расхождения в результатах хотя бы по одному из методов диагностики H. pylori.
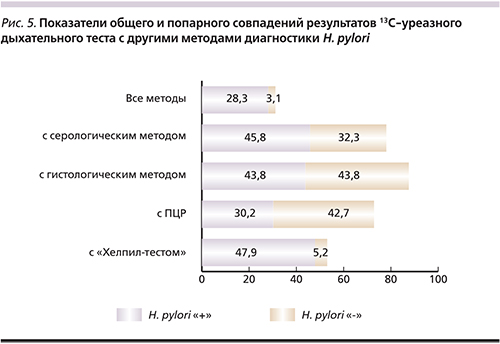
13С-дыхательный тест показал высокие показатели попарного совпадения с другими методами выявления инфекции (рис. 5) за счет как положительных, так и отрицательных результатов. Совпадения с данными гистологического исследования составили 87,6%, с ПЦР – 72,9%, с данными серологического исследования – 78,1% случаев. Исключение составили лишь результаты попарной оценки с уреазным тестом с биоптатом, где низкое число отрицательного результата «Хелпил-теста» привело к закономерному снижению общих показателей совпадений.
Среди всех методов диагностики 13С-уреазный дыхательный тест и ПЦР с гастробиоптатами обеспечили наиболее приближенные к общей выборке значения выявления H. pylori (около 50%).
Обсуждение
Существует много методов диагностики H. pylori. При использовании даже валидизированных тестов чувствительность их колеблется в широких пределах. Так, при постановке быстрого уреазного теста с одним гастробиоптатом чувствительность составляет 57%. Два биоптата повышают чувствительность до 84%. Определение антигенов H. pylori в кале моноклональным иммуноферментным методом обеспечивает чувствительность 94%, а моноклональным иммунохроматографическим методом – до 96%. Антитела IgG к H. pylori в крови (CagA, VacA, GroEL, gGT, HcpC, and UreA) дают чувствительность 75–89%. Чувствительность уреазного изотопного 13С/14С-дыхательного теста составляет 96% [11, 12]. Наибольшие расхождения в нашем исследовании были получены среди инвазивных тестов, где обращают на себя внимание крайне высокие значения инфицированности по данным уреазного «Хелпил-тест» – 94,8%. При этом в 13,5% случаев (13 из 96 человек) положительные результаты диагностики не были подтверждены ни одним из других четырех методов, что, наиболее вероятно, свидетельствует о ложноположительном результате. Если исключить из анализа данные серологического метода диагностики, которые могут свидетельствовать о перенесенной или неактивной инфекции, то среди четырех методов диагностики доля ложноположительных результатов уреазного теста с биоптатом составила 29,2%.
Особый интерес представляло сравнение результатов двух уреазных тестов – с гастробиоптатами и 13С-дыхательного теста. Данные методы относятся к кинетическим и позволяют судить о наличии H. pylori по активности выработки бактерией фермента уреазы, поэтому теоретически их данные должны были быть сопоставимыми. Между тем обнаружены достоверно (р<0,05) большие показатели инфицированности больных при использовании быстрого уреазного «Хелпил-теста» по сравнению с данными 13C-дыхательного теста – 94,8 и 47,9% соответственно. С учетом результатов определения H. pylori другими методами можно констатировать высокую долю ложноположительных результатов при использовании уреазного теста с гастробиоптатом. Причины гипердиагностики в нашем исследовании могут быть связаны как с реактивами, так и с «человеческим» фактором. Кроме того, одной из наиболее вероятных причин гипердиагностики H. pylori при выполнении уреазного теста с гастробиоптатом считается наличие в исследуемых образцах других бактерий – уреазопродуцентов [13–15]. В желудке обнаружен целый ряд штаммов микроорганизмов с уреазной активностью: Staphylococcus epidermidis, Staphylococcus warneri, Staphylococcus capitis, Staphylococcus aureus, Brevibacterium spp. и Klebsiella pneumoniaе [16].
В нашем исследовании применялся наиболее доступный и часто используемый в клинической практике «Хелпил-тест». Полученные результаты не позволяют рекомендовать его использование в качестве единственного метода ни для контроля эрадикации, ни для первичной диагностики инфекции ввиду риска гипердиагностики.
Ранее «золотым» стандартом считали гистологический метод детекции хеликобактера. Однако, несмотря на широкое распространение гистологического метода и его несомненные преимущества в плане оценки состояния слизистой оболочки желудка, его возможности в диагностике H. pylori ограничены методическими погрешностями. В условиях практической работы поликлиник и стационаров ложноотрицательные результаты обусловлены недостаточным количеством (как правило, 1–2) биоптатов, скудностью биоптатов, не содержащих эпителия и слизи с участками кишечной метаплазии, атрофии, и особенностями окраски биоптата [17, 18]. Таким образом, для повышения точности метода требуется забор нескольких биопататов, что не всегда осуществляется в рутинной практике.
Кроме того, следует отметить, что серологический метод также не может свидетельствовать об актуальном инфекционном процессе и подтверждает лишь факт контакта макроорганизма с H. pylori и иммунный ответ на нее. Наибольшую частоту совпадений продемонстрировали 13С-уреазный дыхательный тест, ПЦР с гастробиоптатом и гистологическое исследование гастробиоптатов. Эксперты в качестве приемлемых информативных неинвазивных методик рассматривают 13С-уреазный дыхательный тест с мочевиной и определение антигена H. pylori в стуле моноклональными антителами, что отражено в Маастрихтских рекомендациях IV пересмотра и продемонстрировано в нашем исследовании [8].
В последние годы особое внимание уделяется эпидемиологии H. pylori. Прежде всего это связано с прямой корреляцией между степенью инфицированности популяции и частотой развития рака желудка. Систематический обзор исследований, подтверждающих распространенность H. pylori и ее корреляцию с раком в различных странах мира, был опубликован в 2014 г. [19]. Тридцать семь исследований из 22 стран содержали данные с 1968 по 2011 г. Наибольшая распространенность H. pylori была отмечена в Азии и Латинской Америке. В развитых европейских странах за последние 30 лет инфицированность H. pylory в популяции снизилась, что сопровождается параллельным снижением частоты язвенной болезни и рака желудка [20, 21]. В России существует опыт эпидемиологических исследований лишь в отдельных регионах на основании серологического скрининга. Авторы из Новосибирска включили в международные эпидемиологические исследования MONICA и HAPIEE гастроэнтерологический раздел, оценивая серологические маркеры H. pylori более чем у 1000 человек [22]. Менее крупные эпидемиологические исследования инфицированности хеликобактером были выполнены и в других регионах Сибири (Ханты-Мансийск, Якутия, Тыва, Чукотка, Ямало-Ненецкий АО, Камчатка, Сахалин) [23]. Оказалось, что на всей территории Сибири инфицировано не менее 75–85% взрослого населения, как коренного, так и пришлого. Представленные данные свидетельствуют о том, что практически все (92,2%) монголоиды (эвены, эвенки) на Севере инфицированы или имели контакт с инфекцией H. pylori [23]. С учетом большой территории страны, исторической миграции населения эпидемиологическая ситуация с распространенностью H. pylori требует уточнения в каждом регионе.
В нашем исследовании применялся 13С-уреазный дыхательный тест, позволивший не только выявить факт наличия инфекции, но и судить о степени инфицированности пациентов на основании динамики приращения меченого 13С в выдыхаемом воздухе [9]. Частота встречаемости H. pylori проанализирована у 4181 пациента с жалобами гастроэнтерологического характера. По решению Европейского регионального бюро ВОЗ (Женева, 1967) такой тип эпидемиологических исследований соответствует описательной эпидемиологии. В ходе нашего описательного эпидемиологического исследования инфицированности хеликобактером жителей Санкт-Петербурга выявлена не такая высокая, как в Сибири, распространенность H. pylori даже среди пациентов гастроэнтерологического профиля – 50%. До начала исследования мы предполагали обнаружить более высокую частоту встречаемости H. pylori среди пациентов с диспепсическими жалобами [24]. В данное исследование не включено тестирование здоровых лиц и, следовательно, мы не можем оценить популяционную инфицированность. Но, вероятно, при таком уровне инфицированности пациентов с гастроэнтерологическими жалобами частота встречаемости H. pylori в популяции будет ниже. Настораживает факт преобладания высокой степени обсемененности (III или IV – у 80%) среди инфицированных пациентов. При этом инокулюм-эффект (при высокой концентрации бактерий возбудителя возрастает минимальная ингибирующая концентрация и снижается бактерицидная активность антибиотиков) играет негативную роль, снижая вероятность успешного лечения от инфекции, что, по-видимому, необходимо учитывать при выборе схемы антихеликобактерной терапии [25]. Следует также отметить, что этот факт нашел свое подтверждение при анализе эффективности эрадикации среди 903 пролеченных больных. Излечения от инфекции удалось добиться лишь в 81% случаев.
Выводы
- Среди пациентов в Санкт-Петербурге с жалобами со стороны желудочно-кишечного тракта инфицированность H. pylori составляет 50%.
- Среди инфицированных доминирует высокая степень обсемененности H. pylori.
- Выявлена низкая эффективность эрадикационной терапии – 81%.
- 13С-уреазный дыхательный тест следует рассматривать как наиболее рациональный метод неинвазивной диагностики H. pylori.



