Введение
Обеспечение уровня глюкозы крови, близкого к состоянию нормогликемии, определяет достижение оптимальных краткосрочных и долгосрочных результатов лечения пациентов с сахарным диабетом 1 типа (СД1) [1–5] и, как правило, требует интенсифицированной инсулинотерапии (ИТ) с использованием режима ежедневных многократных инъекций инсулина (МИИ) или непрерывной подкожной инфузии инсулина (НПИИ).
Итенсифицированная ИТ в базисно-болюсном режиме – наиболее эффективный режим лечения пациентов с СД1 для достижения целевых параметров уровня глюкозы крови. Однако его нельзя назвать идеальным.
Значимыми ограничениями МИИ являются:
- невозможность выполнения без мотивации и активного участия пациента в процессе лечения, что является одним из основных барьеров на пути к эффективному лечению;
- выраженные индивидуальные особенности фармакокинетики и фармакодинамики препаратов инсулина нередко обусловливают неудовлетворительные результаты лечения;
- наличие различных состояний, способных оказывать влияние на фармакологические параметры, их вариабельность и, следовательно,эффективность и безопасность проводимой терапии (выраженная инсулинорезистентность, наличие липодистрофий и остаточных уплотнений после организовавшихся воспалительных инфильтратов в местах введения инсулина, ускоренная деградация инсулина в подкожной жировой клетчатке, индивидуальные гормональные особенности, наличие антител к инсулину и др.).
Данные ограничения могут существенно влиять на возможность достижения гликемического контроля и определять тот факт, что менее 15% всех пациентов с СД1 достигают целевых значений уровня гликированного гемоглобина (HbA1c) [6, 7].
Введение инсулина с помощью НПИИ более физиологично по сравнению с МИИ, т.к. наиболее точно имитирует физиологическую секрецию инсулина.
Разработка и внедрение в клиническую практику аналогов инсулина ультракороткого действия (аспарт, глулизин, лизпро), обладающих высокой скоростью всасывания и другими преимуществами по сравнению с рекомбинантными инсулинами человека, дополнительно повысили эффективность и гибкость ИТ и послужили стимулом для ее более широкого использования в лечении СД.
Совершенствование инсулиновых помп, появление программируемых дозаторов для введения инсулина привели к еще большей оптимизации ИТ, позволили не только безопасно улучшить степень компенсации углеводного обмена у пациентов с СД, но и повысить качество их жизни.
В настоящее время использование НПИИ рекомендовано как взрослым, так и детям с СД1 [8, 9]. Наиболее часто помповую терапию назначают при невозможности достижения целевых значений гликемического контроля на режиме многократных ежедневных инъекций инсулина пациентам, склонным к гипогликемии, а также при наличии высокой вариабельности гликемии в течение суток и наличии феномена «утренней зари», неподдающегося коррекции иначе, чем дополнительным введением препаратов инсулина короткого или ультракороткого действия в ночные или ранние утренние часы.
Возрастающий интерес к более широкому использованию помповой терапии в клинической практике обусловлен повышением требований к качеству лечения диабета, а также накопленными доказательствами эффективности и безопасности этого метода ИТ.
Основные преимущества помповой терапии по сравнению с традиционно используемым режимом МИИ [8]:
- высокая точность дозирования;
- низкая вариабельность сахароснижающей активности инсулина;
- управляемая фармакокинетика, обеспечивающая соответствие концентрации инсулина в крови в течение суток потребностям в инсулине;
- использование инсулинов только короткого и ультракороткого действий, что предотвращает создание депо инсулина в подкожной жировой клетчатке и обеспечивает более высокую предсказуемость действия инсулина;
- уменьшение числа проколов кожи по сравнению с использованием МИИ;
- возможность уменьшения суточной дозы инсулина, необходимой для поддержания целевых показателей гликемии у пациентов с СД1, что связано с более полной абсорбцией прандиального инсулина из подкожно-жировой клетчатки по сравнению с инсулинами длительного действия. Для некоторых пациентов это может иметь дополнительные преимущества (контроль массы тела, риск гипогликемий и др.);
- возможность непрерывного мониторирования гликемии (CGM – Continuous-Glucose-Monitoring) в режиме реального времени с автоматическим своевременным изменением дозы инсулина при необходимости, а также возможность хранения и анализа данных.
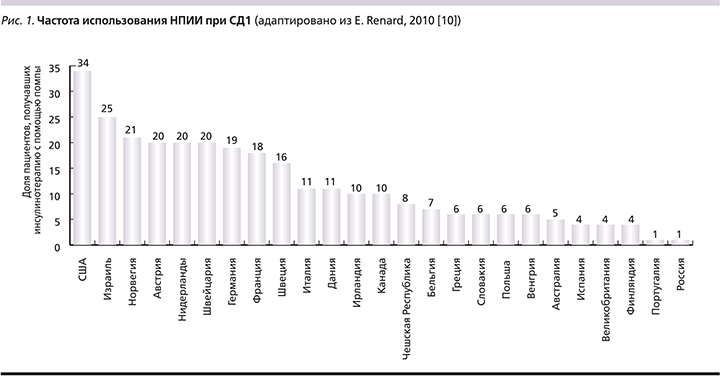
Однако, несмотря на то что помповая ИТ является наиболее простым и физиологичным методом достижения целей гликемического контроля и почти полувековой опыт ее успешного применения в лечении СД, а также наличие четких показаний и ограниченного числа абсолютных противопоказаний к использованию этого варианта интенсифицированной ИТ, с учетом высокой затратности дан-ного метода в настоящее время НПИИ недостаточно часто используется в рутинной клинической практике (рис. 1) [10], и режим МИИ до сих пор является наиболее широко используемым методом достижения целей гликемического контроля при СД1.
Идеальный инсулин для НПИИ должен обладать следующими характеристиками [11]:
- очень быстро всасываться при подкожном введении;
- обеспечивать оптимальный контроль базального и прандиального уровня гликемии, не вызывая при этом гипогликемии;
- обладать буферными (стабильными) свойствами для исключения фибрилляции и окклюзии катетера;
- иметь высокую химическую стабильность для предупреждения образования как активных, так и неактивных метаболитов;
- иметь низкую изоэлектрическую точку преципитации для повышения устойчивости к образованию преципитатов в кислой среде;
- не вызывать образования высокомолекулярных продуктов деградации, которые могут оказывать иммуногенное действие;
- иметь низкие экспозицию и абсорбцию на гидрофобных поверхностях;
- обладать устойчивостью на свету и достаточной продолжительностью хранения;
- иметь возможность широкого использования различными категориями пациентов.
Использование в помповой терапии растворимого человеческого инсулина имеет ряд ограничений. Например, оптимальным считается введение болюсных доз простого человеческого инсулин за 30 минут до еды – так, чтобы пик его действия совпадал с постпрандиальной экскурсией глюкозы крови. Из-за особенностей всасывания простого человеческого инсулина его препрандиальное введение непосредственно или слишком близко к приему пищи может приводить к постпрандиальной гипергликемии, которая сопровождается гиперинсулинемией и риском гипогликемии.
Улучшенный фармакокинетический профиль аналогов инсулина ультракороткого действия определяет их предпочтительное использование в НПИИ.
В настоящее время все доступные аналоги инсулина ультракороткого действия одобрены для использования в помповой терапии взрослых и детей.
Более широкое применение в помповой терапии инсулинов аспарт и лизпро обусловлено наличием большой доказательной базы. Данные многочисленных прямых сравнительных исследований убедительно демонстрируют их преимущества в режиме НПИИ по сравнению с инсулином глулизин (более низкий риск окклюзии катетера, симптоматических гипогликемий, необъяснимой гипергликемии, кетоза/кетоацидоза) [11–14]. Исследование Van Bon и соавт. показало отсутствие различий в снижении уровня HbA1c при использовании всех трех прандиальных аналогов инсулина. Однако общая частота гипогликемий была статистически значимо выше на глулизине (73,8 эпизода/пациента в год), чем на аспарте и лизпро (65,0 и 62,7 эпизода/пациента в год соответственно; p<0,01) [14].
Данные сравнительных исследований инсулинов аспарт и лизпро ограниченны и не так однозначны. Результаты исследований in vitro показали, что инсулин аспарт более устойчив к изоэлектрической преципитации, чем инсулин лизпро [15]. Хотя данные рандомизированного перекрестного исследования аспарта и лизпро в НПИИ не выявили различий в вариабельности суточного профиля гликемии и частоте гипогликемий, но при этом показали более стабильный уровень постпрандиальной гликемии на инсулине аспарт (абсолютная динамика уровня гликемии на аспарте составила 7,04±3,16 и 9,04±4,2 мг/дл на инсулине лизпро; p<0,0019) [16]. Имеются данные, согласно которым НПИИ инсулином аспарт чаще способствует достижению целевых параметров гликемии (HbA1c) некоторыми пациентами с СД1, чем НПИИ инсулином лизпро [17]. Недавно опубликованные результаты еще двух исследований показали, что инсулин лизпро в НПИИ не позволяет поддерживать такой же (non-inferiority) уровень гликемии, как и при использовании инсулина аспарт (на 6-й день уровень глюкозы крови был статистически значимо выше на инсулине лизпро, чем на инсулине аспарт), а также чаще вызывает развитие необъяснимой гипергликемии и диабетического кетоацитоза, чем аспарт [18].
Согласно данным исследования IMS [19], инсулин аспарт (НовоРапид, компания Ново Нордиск, Дания) является самым назначаемым аналогом инсулина ультракороткого действия. Многочисленные клинические исследования и 15-летний опыт успешного использования инсулина аспарт в клинической практике в России предоставили убедительную доказательную базу его безопасности и эффективности для самого широкого круга пациентов с СД, в т.ч. у детей с двух лет, беременных и кормящих грудью пациенток, пожилых пациентов, а также пациентов с нарушением функции печени и почек. Кроме того, среди прандиальных аналогов инсулина аспарт является наиболее стабильным и имеет самый низкий риск изоэлектрической преципитации, соответственно, наименьшую склонность к окклюзии катетера по сравнению с человеческим инсулином и аналогами инсулина лизпро и глулизин [12, 15, 16]. В связи с чем FDA (Food and Drug Administration, США) одобрило продолжительность использования инсулина аспарт (НовоРапид) в течение 6 дней.
Целью данного исследования была оценка эффективности и безопасности использования аналога инсулина ультракороткого действия аспарт в режиме НПИИ и возможность улучшения гликемического контроля с помощью помповой терапии пациентов с СД1 в реальной клинической практике.
Материал и методы
Исследование выполнено в условиях реальной клинической практики. В исследование были включены 56 пациентов с СД1 (11/19,6% мужчин, 45/80,4% женщин), находившихся на стационарном лечении и дальнейшем амбулаторном наблюдении в эндокринологическом отделении ГБУЗ «Челябинская областная клиническая больница» (ГБУЗ ЧОКБ) с 2014 по 2015 г.
Основными критериями включения были наличие СД1 и возраст 18 лет и старше.
Критерии исключения:
- сопутствующие заболевания, оказывающие влияние на течение СД (наличия осложнений, связанных с самим СД1, не было обоснованием для невключения в исследование);
- отказ от обследования.
Все пациенты до перевода на помповую терапию получали интенсифицированную ИТ аналогами инсулина при МИИ (препараты инсулина вводили при помощи шприц-ручек), были обучены системе подсчета хлебных единиц (ХЕ), вели дневники самоконтроля.
Все пациенты были переведены на непрерывную подкожную инфузию инсулином аспарт (НовоРапид, Ново Нордиск, Дания) с помощью инсулиновых помп Медтроник МиниМед Парадигм РЕАЛ-Тайм 722 (Medtronic MiniMed Paradigm® REAL-Time, Нортридж, Калифорния). Перевод на помповую терапию проводился в условиях стационара (продолжительность госпитализации составила 10–12 дней). В дальнейшем пациенты посещали клинику амбулаторно не реже 1 раза каждые 6 месяцев для коррекции ИТ в течение года.

Постановке помпы в каждом случае предшествовало индивидуальное трехдневное обучение пациента. Программирование базального профиля каждому пациенту было проведено по стандартной схеме – путем комбинации нескольких часовых интервалов согласно суточным изменениям чувствительности к инсулину. Расчет болюсных доз каждому пациенту проводился индивидуально с учетом количества потребляемых углеводов (ХЕ), потребности в инсулине на 1 ХЕ и коэффициента чувствительности к инсулину (SF).
Всем пациентам до перевода на НПИИ и в конце исследования было проведено длительное мониторирование гликемии в течение 72 часов с использованием систем постоянного мониторирования глюкозы в режиме реального времени (RT-CGM) (границы измерения уровня глюкозы от 2,2 до 22,2 ммоль/л).
Уровень HbA1c определялся перед началом исследования, а также через 6 и 12 месяцев. Определение уровня HbA1c проведено в лаборатории ГБУЗ ЧОКБ методом жидкостной ионообменной высокоэффективной хроматографии на биохимическом анализаторе D-10 (Bio-Rad, Франция/США).
Общий контроль уровня глюкозы крови и постпрандиальной гликемии оценивали при помощи самоконтроля гликемии в 8 временны'х точках (уровень глюкозы в крови утром натощак, через 2 часа после завтрака, до и через 2 часа после обеда и ужина, а также в 23:00 и 03:00), при необходимости – в любое время в течение всего периода лечения. Полученные данные фиксировали в дневнике мониторирования с указанием точного времени измерения.
Оценка безопасности включала сбор и регистрацию данных о побочных эффектах, а также оценку частоты гипогликемических состояний (общую частоту и отдельно частоту легких, тяжелых и ночных гипогликемий), окклюзии катетера, необъяснимой гипергликемии, гипергликемии с кетозом (по наличию кетоновых тел в общем анализе мочи)/кетоацидозом.
Легкой гипогликемией считали снижение уровня глюкозы крови <4 ммоль/л (независимо от наличия клинических симптомов). В соответствии с Алгоритмами специализированной медицинской помощи больным сахарным диабетом (2015, 7-й выпуск) к тяжелым эпизодам гипогликемии относились случаи снижения уровня глюкозы плазмы <2,8 ммоль/л, сопровождавшиеся клинической симптоматикой (наличие тяжелых симптомов со стороны центральной нервной системы) или <2,2 ммоль/л независимо от наличия симптомов.
Статистический анализ проведен с использованием пакета прикладных программ Statistica 6,0 (StatSoft, Inc.) и SPSS 13.0. Количественные показатели, подчиняющиеся нормальному распределению, представлены в виде среднего значения и стандартного отклонения. При распределении, отличном от нормального, количественные показатели представлены в виде медианы и интерквартильного размаха (Ме [25%; 75%]). Различия считались статистически значимыми при p<0,05.
Результаты исследования
Средний возраст пациентов, участвовавших в исследовании, составил 24,7±7,8 года (от 18 до 46 лет); средняя длительность СД1 – 6,3±5,3 года (от 3 до 20 лет). Все пациенты имели поздние сосудистые осложнения, обусловленные СД1 (в т.ч. один пациент – хроническую болезнью почек 5-й ста-дии), одна пациентка была беременной.
Средний уровень HbA1c исходно составил 8,2±2,3% (от 5,6 до 11,2%). Среднесуточная гликемия, по данным CGM, до начала помповой терапии составляла 9,5±1,2% с колебаниями гликемии: минимальная – 3,3 ммоль/л и максимальная – 20 ммоль/л. Средняя суточная доза инсулина при использо-вании МИИ составила 45 единиц.
После начала помповой ИТ и подбора режима введения инсулина средний уровень HbA1c через 12 месяцев снизился до 7,8±2,1% (среднее снижение уровня HbA1c составило -0,4%).
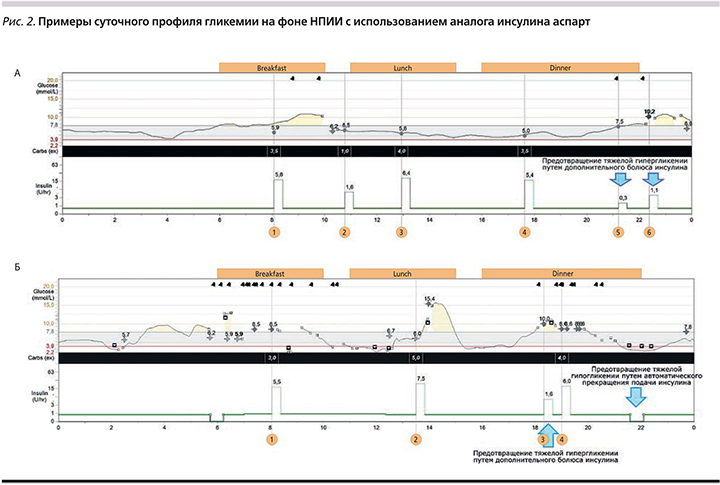
Среднесуточная гликемия через 12 месяцев снизилась с 9,5 до 7,9 ммоль/л с колебаниями уровня гликемии в течение суток в среднем от минимально 3,5 ммоль/л до максимально 13 ммоль/л. По данным 24-часового мониторирования уровня глюкозы крови с помощью системы CGM, уменьшение колебаний гликемии на фоне НПИИ аналогом инсулина аспарт было более выраженным в ночные и утренние часы, а также отмечалось снижение постпрандиального прироста гликемии (рис. 2).
Анализ продолжительности гипергликемии (>11 ммоль/л), эугликемии (4–11 ммоль/л) и гипогликемии (<4 ммоль/л) по данным RT-CGM показал, что через 12 месяцев использования инсулина аспарт в НПИИ по сравнению с началом исследования отмечено значительное снижение процента длительности гипергликемий с 37,3 до 27%, а также уменьшение продолжительности гипогликемий с 4,3 до 1,7% (рис. 3).
Через 12 месяцев после перевода на инсулин аспарт в НПИИ 37 (66%) из 56 пациентов достигли целевых значений углеводного обмена (HbA1c<8,0%). Использование инсулина аспарт в НПИИ позволило поддерживать целевой уровень гликемии в течение 46 и 65% времени через 6 и 12 месяцев после начала исследования соответственно.
Терапия аналогом инсулина аспарт в режиме НПИИ привела к улучшению гликемического контроля без увеличения суточной дозы инсулина. Анализ непрерывного суточного мониторирования гликемии позволил скорректировать дозу болюса на еду, а также базисную дозу инсулина в ночные часы, во время занятий спортом и при других физических нагрузках.
У 17 человек отмечено снижение суточной дозы инсулина в среднем на 10% (р=0,2). При этом базисная доза инсулина для большинства пациентов была больше в вечернее время (в среднем на 0,5%).
За время исследования общее число эпизодов гипогликемии в ночное и дневное время составило 15 и 20 соответственно. Также отмечалось снижение частоты гипогликемических состояний при физических нагрузках.
Ни у одного из пациентов, принявших участие в исследовании, при помповой терапии инсулином аспарт не было тяжелых гипогликемий в течение всего периода наблюдения.
У трех пациентов отсутствовали ночные гипогликемии, у четырех – феномен «ранней утренней зари». Частота легких гипогликемий на помповой терапии значимо не изменялась.
Ни у одного из больных на фоне НПИИ с использованием инсулина аспарт диабетического кетоацидоза зафиксировано не было.
После установки помпы окклюзия катетера была зафиксирована у 15 (26,8%) человек. При анализе возможных причин окклюзии катетера были выявлены следующие причины: поздняя смена (более 3 дней) инфузионного набора – 7 (46,7%) человек, неправильная установка иглы – 2 (13,3%), нарушение техники установки инфузинного набора – 6 (40%) человек. После повторной установки помпы и проведения дополнительных занятий повторной окклюзии катетера не было зарегистрировано ни у одного из пациентов.
Среди преимуществ помповой терапии по сравнению с МИИ все пациенты выделяли следующие:
- отсутствие ежедневных МИИ;
- более ровную гликемию в ночное время с уменьшением риска ночных гипогликемий;
- удобный дизайн, простоту использования, меню на русском языке;
- снижение частоты гипогликемий во время физических нагрузок и занятий спортом благодаря применению временной базисной дозы;
- возможность вводить дополнительный инсулин в болюсном режиме в любое время, в любом месте, не привлекая внимания окружающих.
Обсуждение
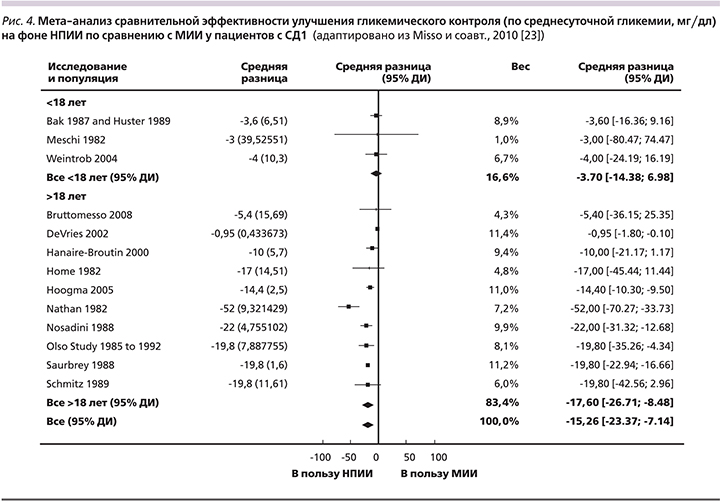
Многочисленные исследования и их мета-анализы показывают, что при лечении СД1 у взрослых пациентов помповая терапия с использованием различных препаратов инсулина короткого и ультракороткого действий является более эффективным методом интенсифицированной терапии, чем режим многократных ежедневных инъекций, в отношении улучшения гликемического контроля и снижения риска гипогликемических состояний (рис. 4) [20–25]. По данным систематического обзора 12 рандомизированных контролируемых исследований, сравнивавших НПИИ и МИИ у взрослых пациентов с СД1, помповая терапия обеспечивает статистически значимо лучший контроль HbA1с (на 0,29%, 95% доверительный интервал [ДИ] – от 0,06 до 0,52%) [23].
При этом лучший гликемический контроль при использовании помповой терапии, как правило, сопряжен с применением более низкой суточной дозы инсулина, чем при МИИ [25].
В настоящем исследовании перевод пациентов с СД1 с ИТ в режиме МИИ на НПИИ инсулином аспарт способствовал как улучшению среднесуточного уровня гликемии, так и уменьшению амплитуды колебаний гликемии в течение суток, что особенно важно для предотвращения развития сосу-дистых осложнений. Так, увеличение базисной дозы инсулина в вечернее время ассоциировалось со снижением постпрандиального прироста гликемии после ужина.
Важно, что улучшение гликемического контроля при переводе на помповую терапию инсулином аспарт не сопровождалось увеличением общей частоты гипогликемий, частоты ночных гипогликемий, а также предупреждало тяжелые гипогликемические состояния.
Комбинация НПИИ в сочетании с системой непрерывного мониторирования гликемии способствовала улучшению контроля гликемии без увеличения частоты и длительности ночных гипогликемий. Снижение частоты ночных эпизодов гипогликемии особенно важно, т.к. происходит в случае, когда пациент может быть не в состоянии быстро и эффективно оказать себе помощь.
Наиболее вероятно, что данные эффекты терапии инсулином аспарт в НПИИ обусловлены уменьшением вариабельности гликемии в течение суток, которая является серьезной проблемой при попытке ужесточить контроль при интенсификации ИТ с использованием МИИ. В свою очередь более низкая вариабельность уровня гликемии связана с возможностью постоянного контроля уровня глюкозы крови и, соответственно, своевременного более точного регулирования базисной дозы инсулина в зависимости от гликемии на время занятий спортом или другой нагрузки.
Кроме того, регулирование базальной скорости подачи инсулина позволяет контролировать феномен «утренней зари» и, возможно, предупредить развитие постпрандиальной гипергликемии после завтрака.
К настоящему времени отсутствуют убедительные данные о влиянии НПИИ на развитие поздних осложнений СД. Тем не менее достижение более строгого контроля гликемии без увеличения риска гипогликемий (в первую очередь ночных и тяжелых) может определять качество метаболического контроля при СД и уменьшать частоту осложнений у некоторых пациентов [26].
Дополнительным преимуществом использования инсулина аспарт в помпе является то, что улучшение контроля гликемии при переводе с режима МИИ на НПИИ не требует увеличения дозы инсулина. В данном исследовании была выявлена тенденция к снижению общей суточной дозы инсулина при переводе на режим НПИИ (в среднем на 10%), хотя данная разница была недостоверной.
Уменьшение потребности в инсулине на фоне НПИИ по сравнению с исходным уровнем – одна из причин уменьшения частоты гипогликемий, может благоприятно влиять на общий прогноз пациентов с СД1, т.к. способствует уменьшению гиперинсулинемии – одного из факторов риска атерогенеза, развития сосудистых осложнений, ишемической болезни сердца и инфаркта миокарда [27–29], некоторых форм рака при СД [30, 31].
Выводы
- Терапия с использованием инсулиновой помпы, также известная как непрерывная подкожная инфузия инсулина (НПИИ), является высокотехнологичным режимом интенсифицированной ИТ, который позволяет улучшать качество контроля у пациентов с СД1.
- Использование инсулина аспарт в помповой ИТ у пациентов с СД1 позволяет улучшать контроль гликемии и снижать риск тяжелых эпизодов гипогликемии (особенно в ночные и утренние часы). НПИИ способствует достижению более низкого уровня HbA1c, чем при использовании МИИ (на -0,4% через 12 месяцев).
- При использовании НПИИ большее число пациентов (%) с СД1 имеют показатель HbA1c <7,0%.
- Инсулин аспарт в НПИИ не увеличивает частоты легких гипогликемий.
- Для минимизации риска осложнений при проведении помповой терапии необходимо проведение тщательного контроля гликемии.
- Комбинация НПИИ в сочетании с системой непрерывного мониторирования гликемии в режиме реального времени приводит к более значимому снижению HbA1c без увеличения частоты и длительности ночных гипогликемий и предупреждает тяжелые гипогликемии.
Дополнительная информация
Исследование выполнено по инициативе авторов в рамках клинической практики на базе эндокринологического отделения ГБУЗ «Челябинская областная клиническая больница» (Челябинск), без привлечения стороннего финансирования.
Авторы заявляют об отсутствии явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов
Е.В. Ковригина – концепция и дизайн исследования, организация исследования, сбор и статистическая обработка данных, анализ полученных данных, написание черновика рукописи; В.Л. Тюльганова – разработка концепции и дизайна исследования, анализ и интерпретация полученных данных.
Все авторы участвовали в критическом пересмотре и одобрении окончательной версии рукописи.
Благодарности
Авторы выражают благодарность медицинскому менеджеру компании «Ново Нордиск» к.м.н. Я.Г. Алексее-вой за помощь в написании и подготовке рукописи к публикации. Компания «Ново Нордиск» не оказывала влияния на сбор данных, анализ и интерпретацию результатов исследования.
Авторы выражают благодарность главному врачу ГБУЗ «Челябинская областная клиническая больница» д.м.н., профессору Д.А. Альтману за помощь и поддержку в проведении исследования.


