Сахарный диабет 2 типа (СД2) – наиболее распространенное эндокринное заболевание с сохраняющейся тенденцией к увеличению числа больных. По данным экспертов ВОЗ, в 2014 г. в мире насчитывалось 387 млн больных СД, а к 2035 г. ожидается уже 592 млн пациентов. Распространенность СД2 среди возрастной группы >65 лет составляет 27% [1], в европейских странах среди возрастной категории населения старше 75 лет – 37,4% [2].
По классификации ВОЗ, пожилые лица – это люди в возрасте 61–75 лет. Пожилые пациенты с СД2 имеют сопутствующие заболевания, такие как ожирение – 43,1%, артериальная гипертензия – 59,1%, дислипидемия – 59,9%, ишемическая болезнь сердца (ИБС) – 9,7%, хроническая сердечная недостаточность – 7,4%, заболевания опорно-двигательного аппарата – 10,7%. Часто у них имеют место болезнь Альцгеймера, заболевания желудочно-кишечного тракта, анемия, хроническая гипоксия, снижение зрения и слуха [3–5].
Гипергликемия или гипогликемия любой степени тяжести являются ведущими факторами, усугубляющими нарушения когнитивных функций, таких как вербальная память, визуальное восприятие, удержание внимания, рабочая память, исполнительная функция и др. [6, 7]. Больные СД2 пожилого возраста в 2 раза чаще имеют депрессию и деменцию сосудистого генеза [8]. В 12 основных исследованиях, включивших более 235 тыс. больных, было показано, что пожилые люди с деменцией, СД, ИБС имеют более высокий, чем пациенты только с деменцией, риск смерти [9]. Было отмечено, что высокие показатели артериального давления, холестерина, избыточный вес не увеличивают риск смерти гериатрической когорты пациентов с деменцией. Поэтому ведущей причиной летального исхода для таких больных являются именно гипергликемия или гипогликемия. У пожилых пациентов риск развития когнитивных нарушений повышается в 4 раза при уровне гликированного гемоглобина (НbА1с) >7% [10]. Лица старше 65 лет часто имеют низкий социально-экономический статус, ведут малоподвижный образ жизни, проживают изолированно от родственников. Все это приводит к снижению мотивации на проведение самоконтроля и соблюдение рекомендаций врача.
У пожилых больных меняется фармакокинетика лекарственных препаратов, что обусловливает возрастание их эффективности при использовании меньших доз. Это часто связано со снижением моторной и секреторной функций желудочно-кишечного тракта: уменьшением кислотности, гипокинезией желудка и кишечника, атрофией слизистых оболочек, снижением абсорбции, нарушением секреторной активности поджелудочной железы. Этому также способствует уменьшение объема циркулирующей крови и содержания альбумина в плазме людей пожилого возраста, что повышает эффективную концентрацию лекарств. Период полувыведения препаратов увеличивается за счет уменьшения массы печени и снижения печеночного кровообращения. С возрастом также ухудшаются параметры функционирования почек со снижением почечной экскреции и элиминации метаболитов лекарств на фоне развития нефросклероза. Пациенты пожилого возраста, как правило, длительно получают большое количество лекарственных средств по поводу нескольких сопутствующих заболеваний. Это снижает комплаентность больных и приводит к неправильному выполнению назначенного режима питания и медикаментозной терапии. Поэтому использование сахароснижающих препаратов (ССП) с минимальной частотой приема в течение суток и низким риском развития побочных эффектов – нефротоксичности, гепатотоксичности и гипогликемии, является важным принципом лечения больных СД2, особенно в пожилом возрасте. Гипогликемия – наиболее серьезное осложнение, которое может возникнуть при использовании ССП, и независимый фактор риска в отношении высокого уровня летальности, связанного с аритмией, инсультом, аспирацией рвотными массами во сне [12]. Именно использование ССП, характеризующихся минимальным риском развития гипогликемии, является ключевым фактором в терапии пожилых пациентов с диабетом.
В настоящее время Американской диабетической ассоциацией разработаны цели терапии пожилых пациентов, страдающих СД2 [13]. Данные представлены в таблице.

При выборе цели терапии пожилого пациента с СД2 необходимо знать о наличии других гериатрических синдромов и имеющихся ограничениях в повседневной жизни, депрессии.
В ретроспективном исследовании Kaiser Permanent of Northern California (2004–2008) оценивались уровни НbА1с у пожилых больных СД2 (71 092 человека в возрасте ≥60 лет). Было показано, что риск смерти ниже при уровне НbА1с в интервале 6,0–9,0%, чем при НbА1с ≤6%. Риск любых нефатальных и фатальных осложнений повышался при НbА1с ≥8%. Таким образом, для пациентов старшей возрастной группы лучше придерживаться уровней НbА1с ≥6% и ≤8 %. Однако необходимы дополнительные исследования для оценки уровня смертности и индивидуализации цели лечения [12].
В 2013 г. Международная диабетическая федерация (IDF) представила алгоритм терапии для пожилых пациентов (70+; рис. 1).
Изменение образа жизни, питания являются важными факторами, позволяющими улучшить контроль СД2.
При оценке данных самоконтроля у пожилых пациентов чаще выявляются высокие показатели постпрандиальной гликемии (ППГ). Одной из возможных причин служат пропуск приемов пищи. В 2015 г. были опубликованы результаты клинического исследования по оценке влияния пропуска завтрака на показатели гликемиии в течение последующих суток при употреблении низкокалорийных (700 ккал) обеда и ужина. В перекрестном исследовании приняли участие 22 пациента с СД2 со средней продолжительностью диабета 8,4±0,7 года в возрасте от 30 до 70 лет, индексом массы тела – 28,2±0,6 кг/м2, уровнем HbA1c – 7,7±0,1%. Пациенты были рандомизированы для проведения двух тестов: один день – с завтраком, обедом и ужином, а другой – с обедом и ужином, но без завтрака. Была проведена оценка динамики ППГ, уровней инсулина, С-пептида, свободных жирных кислот (СЖК), глюкагона, глюкагоноподобного пептида-1 (ГПП-1) в плазме крови. Было показано, что без завтрака площади под кривыми (AUC 0-180) глюкозы, СЖК и глюкагона после обеда были выше на 36,8, 41,1 и 14,8% соответственно. В то же время AUC 0-180 инсулина и ГПП-1 были на 17 и 19% ниже (р<0,0001).
В отсутствие завтрака AUC 0-180 глюкозы, СЖК и глюкагона после ужина были на 26,6, 29,6 и 11,5% выше, а инсулина и ГПП-1 ниже на 7,9 и 16,5% соответственно (р<0,0001). Кроме того, пик секреции инсулина в день, когда завтрак отсутствовал, наблюдался на 30-й минуте после обеда и ужина.
Таким образом, пропуск завтрака приводил к увеличению ППГ в обед и ужин в сочетании со снижением секреции ГПП-1 и инсулина. Это исследование показало значимость долгосрочного влияния завтрака на регулирование содержания глюкозы у больных СД2 в течение дня [13].
Регулярное питание является важным фактором, влияющим на контроль СД2. Однако соблюдение только диетических рекомендаций бывает недостаточным для достижения целей терапии.
Сахароснижающая терапия в соответствии с современными алгоритмами начинается с назначения метформина или ингибиторов дипептидилпептидазы-4 (ДПП-4), препаратов сульфонилмочевины (ПСМ), ингибиторов натрий-глюкозного ко-транспортера 2-го типа. Каждый класс ССП имеет свои особенности. Метформин – наиболее часто назначаемый препарат первой линии для инициации сахароснижающей терапии, сочетающий высокую эффективность с низким риском развития гипогликемии, способствующий снижению массы тела. Он противопоказан пациентам с почечной или выраженной сердечной недостаточностью.
Иногда терапия метформином осложняется побочными эффектами со стороны желудочно-кишечного тракта. Около 35% пациентов в США не используют метформин как препарат первой линии, а инициируют терапию другими ССП [14]. Следует отметить, что ПСМ стимулируют в основном 2-ю фазу секреции инсулина, что приводит к повышению риска развития гипогликемии и увеличению массы тела.
Часто пожилым пациентам с СД2, нормальной массой тела и уровнем НbА1с<8% на старте терапии назначают ингибиторы ДПП-4. Одним из возможных вариантов выбора является саксаглиптин. К настоящему времени проведено 6 международных плацебо-контролируемых исследований по оценке эффективности и безопасности этого препарата у больных СД2 старше 65 лет.
Эффективность саксаглиптина в дозах 2,5 и 5 мг по сравнению с плацебо была изучена в группе пациентов с впервые выявленным СД2. Длительность исследования составила 24 недели. Было показано снижение уровня НbА1с на 0,6 и 0,55% соответственно на 24-й неделе терапии. Уровня НbА1с<7% достигли на фоне терапии саксаглиптином в дозе 2,5 мг 37,8% больных, а при использовании дозы 5 мг – 44,9%. Количество эпизодов гипогликемии было сопоставимым с таковым в группе плацебо.
В 2014 г. были опубликованы объединенные данные трех плацебо-контролируемых исследований по переносимости и безопасности саксаглиптина в дозе 5 мг по сравнению с плацебо в качестве дополнительной терапии к метформину, тиазолиндионам и ПСМ (глибурид) у пациентов с СД2 (подгруппа старше 65 лет – 205 человек) в течение 24 недель с продлением до 12–42 месяцев. Пациенты были разделены на 4 группы: первая – саксаглиптин+плацебо; вторая – саксаглиптин+метформин (1500–2550 мг/сут) в течение 154 недель, третья – саксаглиптин+тиазолидиндионы (пиоглитазон 30–45 мг/сут или росиглитазон 4–8 мг/сут) в течение 76 недель, четвертая – саксаглиптин+ПСМ (глибурид 7,5–20 мг/сут) в течение 76 недель. Критерии включения в исследование: НbА1с≥7 и ≤10%, индекс массы тела ≤40 кг/м2, С-пептид ≥1,0 нг/мл. В ходе исследования уровень НbА1с снизился через 24 недели в 1-й группе на 0,83%, во 2-й – на 0,72%, в 3-й и 4-й – на 0,63%. На 76-й неделе отмечено снижение НbА1с на 0,5% в группе саксаглиптин+метформин, на 0,66 и 0,89% при комбинации саксаглиптина с глибуридом и тиазолидиндионами соответственно.
Подтвержденная гипогликемия (глюкоза плазмы ≤2,8 ммоль/л без симптомов, не потребовавшая экстренной терапии) была отмечена у одного пациента, получавшего саксаглиптин 5 мг,и у двух больных группы плацебо. Острые сердечно-сосудистые события зафиксированы у 3 пациентов на саксаглиптине и у 2 – на плацебо. Было продемонстрировано, что саксаглиптин в качестве дополнительной терапии пожилых пациентов с СД2 хорошо переносится и имеет долгосрочный профиль безопасности, сравнимый с плацебо [15].

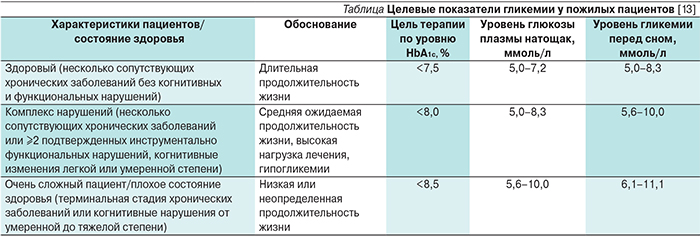
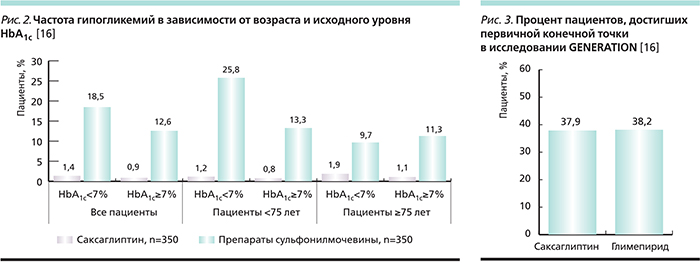
Особый интерес представляет международное многоцентровое рандомизированое двойное слепое исследование GENERATION [16]. В нем приняли участие 720 пациентов с СД2 в возрасте ≥65лет, получавшие метформин в качестве монотерапии не менее 8 недель перед включением в исследование. Проводили сравнение эффективности и безопасности саксаглиптина и глимепирида в комбинации с метформином в течении 52 недель. Первичной конечной точкой исследования была доля пациентов достигших уровня НbА1с≤7% к моменту окончания исследования без подтвержденных или тяжелых случаев гипогликемии. Количество подтвержденных и тяжелых гипогликемических эпизодов было ниже в группе саксаглиптина, чем глимепирида (1,15 против 15,3%; p<0,0001), причем частота гипогликемии не зависела от возраста пациентов и исходного уровня НbА1с (рис. 2). При этом доля пациентов, достигших уровня НbА1с≤7%, была одинаковой (37,9 против 38,2%; p=0,9415), что подтверждает сопоставимую гипогликемизирующую эффективность исследуемых комбинаций (рис. 3) [16]. Результаты исследования показали, что саксаглиптин позволяет достичь хорошего гликемического контроля при низком риске гипогликемии и высоком профиле безопасности у пациентов ≥65 лет для которых метформин в качестве монотерапии недостаточен. С целью минимизации случаев гипогликемии у данной категории больных, саксаглиптин представляется наиболее оптимальным препаратом выбора по сравнению с глимепиридом. Поскольку ключевым условием безопасного применения ССП пожилыми пациентами является отсутствие гипогликемии, становится очевидным преимущество комбинации саксаглиптин+метформин. СД2 ассоциирован с увеличением частоты сердечно-сосудистых событий. Согласно требованиям Управления по контролю за продуктами питания и лекарственными средствами США (FDA), современные препараты, предназначенные для лечения пациентов с СД2, должны обладать доказанной сердечно-сосудистой безопасностью.
В 2013 г. завершилось крупномасштабное многоцентровое рандомизированное проспективное исследование SAVOR (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus Trial), в котором оценивалась сердечно-сосудистая безопасность саксаглиптина. В данном исследовании участвовали 16 492 больных СД2. Исследование продолжалось 2,5 года. Все пациенты были старше 40 лет (из них 52% в возрасте ≥65 лет и 14% ≥ 75 лет), имели в анамнезе сердечно-сосудистые заболевания (около 80% участников) или множественные факторы сердечно-сосудистого риска (возраст ≥55 для мужчин и ≥60 лет для женщин в сочетании с дислипидемией, курением, и/или артериальной гипертензией). Таким образом, эффективность и безопасность саксаглиптина изучалась на большой когорте пациентов разного возраста с широким диапазоном HbА1c (6–12%), длительным стажем СД и высоким риском сердечно-сосудистых событий [17]. Почти 70% пациентов получали метформин в начале исследования. Характеристики пациентов представлены на рис. 4.

Пациенты были рандомизированы в две группы: первую, в которой к базовой терапии добавлялось плацебо, и вторую, получавшую в дополнение к стандартной терапии саксаглиптин по 5 мг/сут. Первичные конечные точки исследования: смерть от сердечно-сосудистых заболеваний, нефатальные инфаркт миокарда и ишемический инсульт. Вторичные конечные точки: госпитализация по причине сердечной недостаточности, нестабильной стенокардии или для проведения коронарной реваску-ляризации.
Полученные в исследовании SAVOR данные показали, что применение саксаглиптина больными СД2 с сердечно-сосудистыми заболеваниями или множественными факторами сердечно-сосудистого риска не сопровождалось увеличением частоты развития нефатального инфаркта миокарда и ишемического инсульта, а также сердечно-сосудистой смерти по сравнению с пациентами, принимавшими плацебо (рис. 5). Одним из важнейших выводов, полученных в ходе этого исследования, было заключение об отсутствии влияния возрастных характеристик на профили эффективности и безопасности саксаглиптина. Данная работа также показала, что саксаглиптин хорошо подходит в качестве средства комбинированной терапии с широким перечнем гипогликемических препаратов, в т.ч. инсулином [17].
Однако был отмечен дисбаланс количества госпитализаций по поводу сердечной недостаточности между группами саксаглиптина и плацебо: 289 (3,5%) и 228 (2,8%) соответственно (относительный риск – 1,27; 95% доверительный интервал – 1,07–1,51; p=0,007), хотя причинно-следственной связи установлено не было. Абсолютная разница между группами была небольшой (61 пациент) и не было увеличения смертности по причине сердечной недостаточности (рис. 6). Вместе с тем частота госпитализаций с увеличением длительности приема саксаглиптина существенно снижалась, а у лиц, госпитализированных по поводу хронической сердечной недостаточности, не отмечено разницы в смертности из-за сердечной недостаточности при применени саксаглиптина и плацебо: 44 (0,5%) и 40 (0,5%) соответственно [18, 19].
После публикации основных результатов исследования SAVOR был дополнительно проведен субанализ данных, полученных у пациентов старше 65 лет. Данные свидетельствуют о том, что у пожилых пациентов, подобно более молодой когорте, прием саксаглиптина не связан с увеличением риска ишемических сердечно-сосудистых событий. Частота госпитализации по причине сердечной недостаточности и частота гипогликемических событий также не зависела от возраста пациентов [20].
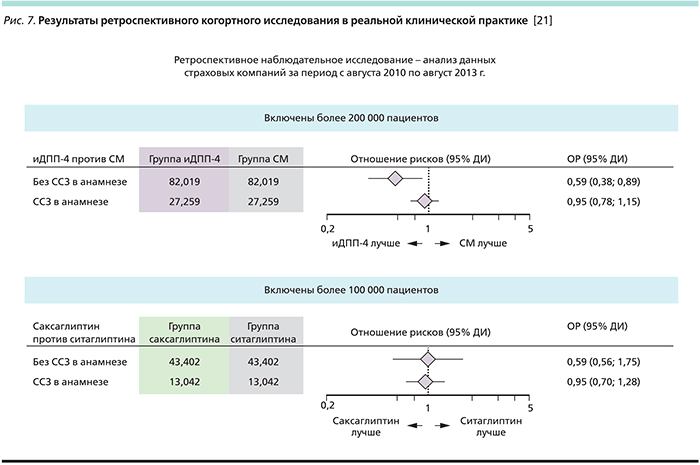
Для того, чтобы оценить риск госпитализации по причине сердечной недостаточности в популяции больных с СД 2 типа, получающих ингибиторы ДПП-4, в частности саксаглиптин, по сравнению с ПСМ, а также получающих саксаглиптин по сравнению с ситаглиптином было спланировано и проведено ретроспективное когортное исследование [21]. С этой целью был проведен анализ данных, полученных в реальной клинической практике (Real World Evidence (RWE) с участием более чем 200 тыс. пациентов. В когорте больных без сердечно-сосудистых заболеваний терапия ингибиторами ДПП-4 была ассоциирована с достоверно более низким риском госпитализации по причине сердечной недостаточности (ОР 0,59; 95% ДИ –0,38–0,89; р=0,013) по сравнению с терапией препаратами СМ. Данное исследование не выявило статистически достоверных различий по риску госпитализаций по причине сердечной недостаточности между больными, получавшими саксаглиптин и ситаглиптин, как в когорте с исходным наличием СС заболеваний (ОР 0,95; 95% ДИ–0,70–1,28), так и в когорте без исходных СС заболеваний (ОР 0,99; 95% ДИ–0,56–1,75). Результаты исследования представлены на рис. 7.
Таким образом, лечение СД у пожилых пациентов осложняется рядом факторов и требует индивидуального подхода. Больным старше 65 лет необходима безопасная терапия при поддержании более высоких целевых показателей гликированного гемоглобина. В заключение можно сказать, что саксаглиптин (Онглиза), дважды доказал сердечно-сосудистую безо-пасность в исследованиях с участием более 200 тыс. пациентов с СД2 типа, в т.ч. у пациентов старше 65 лет в исследованиях SAVOR и RWE. В исследовании SAVOR с участием более 16 тыс. пациентов было показано отсутствие повышения риска крупных ссердечно-сосудистых событий: нефатального инфаркта миокарда, нефатального ишемического инсульта или смерти от сердечно-сосудистых причин; в исследовании RWE с участием более 200 тыс. пациентов было доказано отсутствие повышения риска госпитализаций по причине сердечной недостаточности, а также повышения риска сердечно-сосудистых осложнений по сравнению с ситаглиптином и ПСМ. Анализ проведенных к настоящему времени исследований позволяет расценивать терапию саксаглиптином и комбинацией саксаглиптин+метформин у пожилых пациентов с СД2 типа как эффективную и безопасную в отношении риска развития гипогликемий и сердечно-сосудистых осложнений.


