Проблема ожирения приобрела глобальные масштабы в современном обществе. Бесплодный брак также относится к числу актуальных проблем современной медицинской науки и практики. Частота бесплодного брака в России составляет 15–17%, при том что показатель, равный 15%, считается критическим с демографической точки зрения. Бесплодие и патология беременности во многих случаях этиологически связаны с ожирением. Также при ожирении снижается эффективность различных видов терапии, направленных на восстановление фертильности.
Увеличение числа женщин с избыточной массой тела и ожирением приводит к тому, что все чаще индукцию суперовуляции в рамках программы экстракорпорального оплодотворения (ЭКО) проводят на фоне имеющихся метаболических нарушений. Подходы к использованию вспомогательных репродуктивных технологий (ВРТ) в отношении пациенток с ожирением в разных странах неодинаковы. Например, в Новой Зеландии обязательным условием для применения ВРТ у пациенток с индексом массы тела (ИМТ)>32 кг/м2 является предварительное снижение массы тела [22]. В Великобритании в 2006 г. было проведено анкетирование всех зарегистрированных центров ЭКО на предмет тактики ведения пациенток с ожирением при использовании ВРТ, причем было выявлено, что единая и общепринятая тактика отсутствует [36]. Существуют исследования, в которых связи между ИМТ и эффективностью ЭКО не обнаружено. Так, по данным H. Lashen и соавт. (1999), исследовавших результаты ВРТ 333 пациенток, 76 из которых страдали ожирением, последнее не влияет на исходы ЭКО. Это согласуется с данными и некоторых других исследователей [28, 31].
Однако в литературе встречаются и работы, свидетельствующие о неблагоприятном влиянии ожирения на исходы ЭКО. J.X. Wang и соавт. (2000) оценили влияние массы тела на частоту наступления беременности в программах ВРТ (3586 пациенток с различной массой тела, 8822 цикла переносов эмбрионов – ПЭ). Вероятность наступления беременности за весь период лечения у пациенток с нормальной массой тела оказалась почти на 60% выше, чем у таковых с выраженным ожирением, а логистическая регрессия подтвердила, что масса тела остается независимым фактором, влияющим на частоту наступления беременности. По результатам многих других более поздних исследований [19, 24, 27] женщины с высокой степенью ожирения имеют меньшие шансы наступления беременности при использовании ВРТ, в т.ч. за счет большей частоты отмены циклов стимуляции из-за плохого ответа на стимуляцию и меньшей частоты оплодотворения [10, 33, 35]. J.X. Wang и соавт. (2000) предполагают, что причиной снижения частоты наступления беременности может являться нарушение рецепторной чувствительности эндометрия, в то время как S. Wattanakumtornkul и A. Styne-Gross на модели донорских ооцитов показали отсутствие неблагоприятного влияния ИМТ на толщину эндометрия. В любом случае дальнейшее изучение данного вопроса актуально, а накопление данных может иметь ценность для будущего мета-анализа.
Цель исследования: изучить особенности индукции суперовуляции у пациенток с ожирением, выявить варианты ожирения, неблагоприятные для успешной реализации программ ЭКО.
Материал и методы
Проведен ретроспективный анализ лечения методами ВРТ 31 пациентки с ИМТ>25 кг/м2 (38 циклов стимуляции). Критерии включения: возраст 18–38 лет; бесплодие, являющееся показанием к выполнению ЭКО/ИКСИ (ICSI – Intra Cytoplasmic Sperm Injection); отсутствие противопоказаний к индукции суперовуляции и вынашиванию беременности. Группу сравнения составили 20 пациенток в возрасте 18–38 лет без эндокринных нарушений и с нормальной массой тела (ИМТ – 18,5–24,9 кг/м2), показанием к использованию ВРТ у которых стало трубно-перитонеальное бесплодие в результате непроходимости или отсутствия маточных труб или мужской фактор бесплодия. Возраст пациенток был сопоставимым в обеих группах (33,3±3,9 и 31,2±3,6 года соответственно; p=0,23). Средний ИМТ у пациенток с избыточной массой тела и ожирением составил 30,8±3,6 кг/м2, у женщин с нормальной массой тела – 20,7±1,6 кг/м2. Распределение пациенток основной группы в зависимости от ИМТ было следующим: ИМТ в интервале 25–29,9 кг/м2 был у 17 (54,8%), в интервале 30–34,9 кг/м2 – у 9 (29,1%), в интервале 35–39,9 кг/м2 – у 4 (12,9%), ИМТ более 40 кг/м2 – у 1 (3,2%) женщины. У 14 (45,1%) пациенток основной группы был диагностирован андроидный тип распределения жировой клетчатки (окружность талии/окружность бедер>0,85), у остальных жировая ткань распределялась по женскому типу; 92,9% пациенток с андроидным типом имели избыточную массу тела и ожирение I степени. У пациенток с ожирением II и III степеней преобладал феминный характер распределения жировой ткани.
У 3 (10%) пациенток была выявлена предгипертензия, у 4 (13%) больных имела место артериальная гипертензия 1-й степени (по JNC– Joint National Committee VII, 2003). Метаболический синдром (МС) был диагностирован у 9 (29,0%) пациенток основной группы.
Возраст наступления менархе у пациенток основной группы варьировался от 10 до 15 лет, составив в среднем 10,2±1,5 года, у пациенток контрольной группы – 12,2±1,6 года. У всех пациенток с нормальной массой тела менструальный цикл был регулярным и овуляторным. Среди пациенток с избыточной массой тела и ожирением регулярный и овуляторный менструальный цикл имел место в 16 (51,6%) случаях. Для этих женщин ожирение лишь сопутствовало бесплодию (трубно-перитонеальному или мужскому), гормональные нарушения отсутствовали. У остальных 15 (48,4%) пациенток наблюдалась олиго-/аменорея на фоне хронической ановуляции. Таким пациенткам был установлен эндокринный фактор бесплодия, и обращение в клинику ЭКО этих женщин было обусловлено неэффективностью ранее проведенной терапии или наличием сочетанных факторов бесплодия. Большинство из них отмечали прямую зависимость между нарастанием массы тела и нарушениями менструального цикла. У каждой 6-й (17,6%) пациентки в анамнезе встречалась гиперплазия эндометрия.
У 86,6 % женщин этой подгруппы были выявлены эхографические признаки поликистозных яичников, а в 75% случаев обнаружена гиперандрогения. ИМТ у таких пациенток был относительно невысоким, в среднем составив 30,5±4,7 кг/м2, при этом преобладал (73,3%) андроидный тип распределения жировой ткани. Из 9 случаев МС 8 были выявлены именно у пациенток этой подгруппы. Таким образом, у каждой 4-й (25,8%) женщины было выявлено сочетание МС и синдрома поликистозных яичников (СПКЯ), соответственно, лишь 51,6% больных страдали «простым» ожирением, не ассоциированным с этими патологическими состояниями. У пациенток с СПКЯ преобладало первичное бесплодие (71,4%), в то время как у пациенток с сопутствующим ожирением первичное бесплодие встречалось лишь у 23,5%. В контрольной группе первичное бесплодие наблюдалось у 60,0% женщин. Роды в анамнезе были лишь у 3 пациенток основной группы и у 2 – контрольной. Частота самопроизвольных абортов у пациенток с избыточной массой тела и ожирением составила 9,7%, у пациенток с нормальной массой тела самопроизвольных прерываний беременности не было ни в одном из наблюдений, однако у 10% отмечена неразвивающаяся беременность. В основной группе частота неразвивающейся беременности оказалась несколько выше и составила 12,9% (у 1 пациентки с избыточной массой тела и у 3 – с ожирением I степени, по 2 пациентки в каждой подгруппе). Внематочная беременность в анамнезе встречалась у 4 (12,9%) пациенток основной группы и у 3 (15% женщин) контрольной группы. У 77,4% пациенток основной группы и 85% контрольной ЭКО или ЭКО/ИКСИ проводилось впервые.
У пациенток с избыточной массой тела и ожирением среднее число неудачных попыток ЭКО составило 2,4, у пациенток с нормальной массой тела – 1,0.
Индукция суперовуляции для всех пациенток осуществлена по стандартному длинному протоколу. Агонисты гонадотропин-рилизинг-гормона начинали вводить в середине лютеиновой фазы цикла – через неделю после овуляции (как правило, на 21-й день цикла, предшествующего стимуляции). На 2–3-й день цикла начинали введение высокоочищенного человеческого менопаузального гонадотропина. Для завершения процессов созревания ооцитов при среднем диаметре двух лидирующих фолликулов ≥18 мм вводили 10 тыс. ЕД хорионического гонадотропина человека – ХГЧ. Пункцию фолликулов выполняли пункционной иглой под ультразвуковым контролем через 35–36 часов после введения ХГЧ. В зависимости от качества спермы партнера выполняли инсеминацию ооцитов in vitro или ИКСИ (интрацитоплазматическая инъекция сперматозоида). Эмбрионы переносили в полость матки женщины на 3-й или 5-й день культивирования. Поддержка лютеиновой фазы цикла проведена с помощью интравагинального введения натурального микронизированного прогестерона по схеме 200 мг 3 раза в сутки начиная со следующего дня после пункции фолликулов. Через 12 дней после ПЭ определена концентрация ХГЧ в сыворотке крови, а на 21-й день после переноса проведено первое ультразвуковое исследование (УЗИ) для визуализации плодного яйца. Учтены как положительные только те случаи, когда при последующем УЗИ регистрировали сердцебиение плода. Влияние избыточной массы тела и ожирения на индукцию суперовуляции оценено по таким показателям, как суммарная доза гонадотропинов, продолжительность стимуляции, толщина эндометрия в день ПЭ, число полученных ооцитов, частота развития синдрома гиперстимуляции яичников (СГЯ).
Результаты исследования и обсуждение
Были проанализированы основные параметры индукции суперовуляции у пациенток обеих групп (табл. 1).
Продолжительность контролируемой индукции суперовуляции у пациенток основной группы оказалась статистически значимо выше, чем у пациенток контрольной группы, составив 12,9±2,17 и 11,3±1,7 дня соответственно (p=0,0321). Самая продолжительная стимуляция в группе с ожирением длилась 17 дней. Суммарная доза гонадотропинов, необходимая для одного цикла индукции суперовуляции, у пациенток основной группы также оказалась значимо выше (2840±794 МЕ) по сравнению с группой с нормальной массой тела (2239±440 МЕ; p=0,007). Среднее число полученных за пункцию ооцитов у пациенток с избыточной массой тела и ожирением оказалось ниже (13,8±8,7), чем у пациенток с нормальной массой тела (14,5±6,0), однако различия были статистически незначимыми (p=0,368). Значимых различий по толщине эндометрия в день ПЭ выявлено не было.
Для выявления возможных особенностей индукции суперовуляции все пациентки были подразделены на подгруппы в зависимости от степени, типа ожирения, наличия или отсутствия МС и СПКЯ (табл. 2–4).
При анализе особенностей индукции суперовуляции в зависимости от степени ожирения была выявлена прямая положительная корреляционная связь между ИМТ и суммарной дозой гонадотропинов (р=0,57, p=0,0003). Самая большая доза гонадотропинов (4550 МЕ) потребовалась пациентке с самым большим ИМТ (40 кг/м2). Значимых различий по продолжительности стимуляции в подгруппах с избыточной массой тела и ожирением различных степеней выявлено не было, однако с ростом ИМТ наблюдалась тенденция к увеличению числа дней стимуляции. Среднее число полученных ооцитов у пациенток с ожирением высокой степени оказалось ниже, чем у пациенток с избыточной массой тела. Толщина эндометрия в день ПЭ была одинаковой во всех подгруппах.
При анализе особенностей индукции суперовуляции в зависимости от типа ожирения оказалось, что у пациенток с феминным типом распределения жировой ткани отмечается тенденция к большей дозе гонадотропинов по сравнению с пациентками с андроидным типом ожирения, у которых в свою очередь имела место тенденция к получению большего числа ооцитов. Pазличий по продолжительности стимуляции и толщине эндометрия в день ПЭ выявлено не было (см. табл. 4).
Пациенткам с «простым» ожирением требовалась бо'льшая доза гонадотропинов (2977±710 МЕ), чем больным СПКЯ и МС (2655±889 МЕ и 2481±625 МЕ соответственно; p>0,05), но при этом достоверно получали меньшее число ооцитов (р=0,006). Различий по продолжительности стимуляции и толщине эндометрия в день ПЭ в подгруппах выявлено не было (см. табл. 4).
Частота наступления биохимической и клинической беременности у пациенток с нормальной массой тела составила 40,0%, у женщин с избыточной массой тела и ожирением – 31,6%, частота прогрессирующей беременности и родов живым плодом – 35 и 28,9% соответственно. Однако различия не являются статистически достоверными, т.к. группы не сопоставимы по причинам бесплодия. Был также проведен сравнительный анализ клинических исходов лечения в зависимости от степени и типа ожирения, отсутствия или наличия МС и СПКЯ, при этом были получены весьма интересные данные (табл. 5–7).
Самая высокая частота имплантации (30,8%) оказалась у пациенток с ожирением высокой степени (ИМТ≥35 кг/м2). У пациенток с андроидным типом распределения жировой ткани частота имплантации оказалась значительно ниже (17,6%), чем у пациенток с феминным ожирением (28,0%). Чрезвычайно низкой была частота имплантации у пациенток с МС (11,1%) и СПКЯ (16,2%), у пациенток с «простым» ожирением этот показатель оказался значительно выше (26,0%).
Частота наступления клинической беременности (в расчете на начатый цикл стимуляции) в подгруппе с избыточной массой тела составила 25%, что оказалось статистически значимо ниже, чем у пациенток с ожирением. Причем у пациенток с высоким ИМТ (≥35 кг/м2) частота наступления клинической беременности оказалась самой высокой (66,6%). При сравнении частоты наступления клинической беременности у пациенток с андроидным и феминным типами распределения жировой ткани оказалось, что у последних этот показатель выше, чем у первых (17,6 и 42,9% соответственно). Частота родов живым плодом у пациенток с андроидным ожирением оказалась еще ниже (11,8%), т.к. одна беременность перестала развиваться. При анализе клинических исходов лечения в зависимости от наличия или отсутствия СПКЯ и МС выяснилось, что наличие этих двух сопутствующих патологий крайне негативно отражается на частоте наступления клинической беременности, составив в подгруппе ожирения с СПКЯ 23%, а в подгруппе с МС еще меньше – 18,2%. Для сравнения частота наступления клинической беременности у пациенток с «простым» ожирением оказалась равной 40,0%, что считается достаточно высоким показателем. К одним из наиболее важных характеристик лечения с помощью ВРТ относится частота такого серьезного осложнения, как СГЯ. Мы учитывали все степени проявления этого состояния (рис 1–3).
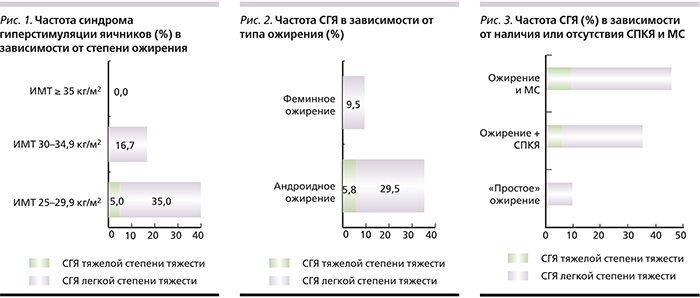
Частота СГЯ в основной группе оказалась выше, чем у пациенток контрольной группы (26,7 и 12,0% соответственно). С увеличением ИМТ частота СГЯ снижалась. Так, у пациенток с ожирением высокой (II–III) степени не наблюдалось ни одного случая развития СГЯ, у пациенток с ожирением I степени частота СГЯ составила 16,7%, у женщин с избыточной массой тела – 40%, у 1 (5%) пациентки этой подгруппы развился СГЯ тяжелой степени, потребовавший лечения в условиях стационара. Это была пациентка с МС, андроидным ожирением и СПКЯ, при этом СГЯ развился, несмотря на то что ПЭ в этом цикле был отменен. И у остальных пациенток в подгруппе с андроидным ожирением частота СГЯ была значимо выше, чем у пациенток с феминным типом распределения жировой ткани (35,3 и 9,5% соответственно). Самой высокой (45,5%) частота СГЯ оказалась у пациенток с МС, при этом частота СГЯ тяжелой степени составила 9%. Сочетание с СПКЯ также оказалось неблагоприятным фактором риска (35,3%, тяжелой степени – 5,9%). В тех случаях, когда ожирение лишь сопутствовало бесплодию («простое» ожирение), частота СГЯ была наименьшей (10%).
Заключение
По данным нашего исследования, имелись существенные различия в контролируемой стимуляции суперовуляции между пациентками с избыточной массой тела и женщинами контрольной группы (при ожирении требовались более высокие дозы гонадотропинов, а продолжительность стимуляции была больше). Но число полученных ооцитов было статистически значимо больше при сопутствующем МС или СПКЯ по сравнению с «простым» ожирением. На клинические исходы также оказывал влияние тип отложения жировой ткани.



