Атопический дерматит (АтД) – один из наиболее распространенных хронических рецидивирующих дерматозов, встречающийся во всех странах у лиц обоего пола и в разных возрастных группах. Согласно современным данным, заболеваемость АтД среди взрослого населения непрерывно растет и, кроме того, в последнее время клиницисты единодушно отмечают трансформацию клинической картины АтД в сторону утяжеления течения заболевания его и упорства к проводимой терапии.
К настоящему времени основные звенья патогенеза АтД достаточно хорошо изучены. Установлено, что АтД – это полиэтиологическое, генетически детерминированное заболевание, в основе патогенеза которого лежит взаимодействие генетических и экзогенных факторов. При АтД передается по наследству не болезнь как таковая, а совокупность генетических факторов, что обусловливает предрасположенность к сенсибилизации и способствует формированию аллергической патологии [1]. Дефекты иммунного ответа у больных АтД, обусловленные генетической предрасположенностью, реализуются через разнообразные триггерные механизмы, причем провокаторами этой сенсибилизации могут служить любые факторы окружающей среды и не в последнюю очередь – пищевые аллергены.
Пищевая аллергия является одним из важнейших механизмов реализации иммунного ответа у больных АтД. Традиционно подчеркивается неоднозначная значимость пищевой аллергии как патогенетического фактора для пациентов с АтД разных возрастных категорий: т.н. пищеиндуцированные обострения АтД имеют место примерно у трети детей раннего возраста, у 5–10% детей старшего возраста и традиционно считаются не самыми значимыми для взрослых больных. При этом, однако, признается, что значимость пищевой аллергии возрастает при средней и тяжелой степенях тяжести течения АтД [2].
Известно, что классическая сенсибилизация к пищевым антигенам происходит через желудочно-кишечный тракт (ЖКТ). Поэтому нарушение барьерной функции кишечника и дефект биоценоза кишечной микрофлоры, отмеченный у 80–95% больных АтД [3], неминуемо будут способствовать повышению абсорбции пищевых аллергенов у больных АтД и, следовательно, усугублению протекания аллергических реакций на коже [4–7].
Эпидемиологические исследования последних лет указывают на высокую частоту поражения органов пищеварительной системы у людей, страдающих воспалительными заболеваниями кожи. По-видимому, схожее физиологическое устройство кишечного и эпидермального барьеров предопределяет близость их функций и может лежать в основе общих анатомо-физиологических нарушений. Органы пищеварительной системы принимают активное участие в общем обмене веществ и его регуляции. В частности, в настоящее время изучаются гормональные и опосредованные через микрофлору пути регуляции межорганного обмена, при этом нарушение деятельности этого сложного ауторегуляторного механизма чревато развитием патологии как в ЖКТ, так и в других органах и системах, в т.ч. на коже.
АтД формируется как заболевание в возрасте 2–6 месяцев примерно у 45% больных, в течение первого года жизни – более чем у 60%. К 7 годам у 65% детей, а к 16 годам у 74% подростков с АтД наблюдается спонтанная ремиссия заболевания [8]. Таким образом, примерно четверти заболевших АтД в раннем детском возрасте вынуждены сосуществовать с этим хроническим дерматозом в течение своей взрослой жизни. Следовательно, пациенты с АтД подросткового возраста (10–19 лет) составляют особую категорию больных, терапевтические подходы к которой должны заключаться не только в успешном купировании обострений кожного процесса и удлинении межрецидивного периода, но и в раннем выявлении и превентивной коррекции сопутствующей патологии внутренних органов, имеющей патогенетическое значение для течения АтД.
Для абсолютного большинства подростков с АтД (более чем 75% больных) традиционно подчеркивается сохранение значимости пищевой аллергии. Более чем у 57% больных АтД подросткового возраста пищевые продукты остаются ведущим триггерным фактором обострения кожного процесса. При этом заболевания ЖКТ являются фактором, поддерживающим хроническое течение АтД и усугубляющим проявления пищевой аллергии. Органические заболевания ЖКТ (хронический гастрит, хронический поверхностный гастродуоденит, дисфункция желчевыводящих путей, дуоденогастральный рефлюкс, нарушение биоценоза кишечника, дисфункция поджелудочной железы и т.п.) были выявлены при обследовании почти у 80% больных [9]. В исследовании О.В. Булиной (2004) [10] у 71% пациентов в возрасте от 10 до 16 лет была установлена сопутствующая патология органов пищеварения и гепатобилиарной системы. Особенно часто диагностировали хронический гастродуоденит, ассоциированный с хеликобактерной инфекцией, различные варианты дискинезии желчевыводящих путей. В исследовании З.А. Алискандиевой (2012) [11] болезни органов пищеварения были диагностированы у всех обследованных детей школьного возраста с АтД; преобладали болезни желудка, 12-перстной кишки и дискинезия толстого кишечника по гипомоторному типу, проявлявшаяся запорами.
Таким образом, с учетом патогенетического значения патологии ЖКТ для больных АтД подросткового и молодого возраста ее своевременное выявление и коррекция позволят пролонгировать межрецидивный период, уменьшить степень выраженности обострений кожного процесса, а также предотвратить переход кожного процесса в более тяжелую стадию течения.
При наличии жалоб и явных симптомов патологии органов ЖКТ диагностика ее, как правило, не представляет особых трудностей, равно как и подбор адекватной терапии. Основные диагностические проблемы связаны с обнаружением ранней субклинической патологии или стертых форм того или иного заболевания. Кроме того, следует учесть, что подростки и молодые люди, страдающие АтД, обычно не настроены на длительное, трудоемкое и малоприятное по субъективным ощущениям обследование органов ЖКТ, включающее такие манипуляции, как эзофагогастродуоденоскопия, ультразвуковое исследование органов брюшной полости, анализ кала и т.п., особенно если для проведения такого обследования нет достаточных оснований. Следовательно, особую важность приобретает применение для этой категории пациентов скрининговых методов исследования органов ЖКТ, обладающих достаточно высокой чувствительностью для обнаружения ранних симптомов неблагополучия органов ЖКТ.
В современной превентивной медицине важную роль играет возможность оценки риска развития заболевания. В осуществлении раннего прогнозирования отмечается роль важнейших специфических биомаркеров, каковыми являются параметры физиологического (естественного) иммунитета.
В 1990-х гг. у пациентов с АтД впервые было показано, что иммунный ответ, первично индуцированный аллергенами внешней среды, может поддерживаться эндогенными антигенами.
В настоящее время таких аутоантигенов известно уже около 140; были обнаружены аутоантитела (ААТ) к тканевым антигенам, таким как миозин, кератин, коллаген, эластин, гистон, и к «фактору роста эпителия хрусталика глаза», локализованному также в ядрах клеток базального слоя эпидермиса, – этот фактор рассматривается как главный аутоантиген при АтД [12]. При этом показано, что уровни этих ААТ прямо коррелируют со степенью тяжести кожного процесса [13]. Исследования уровней различных ААТ к тканевым аутоантигенам у больных АтД могут иметь высокую диагностическую ценность для обнаружения ранней скрытой патологии внутренних органов, в частности органов ЖКТ.
К настоящему времени убедительно показана важная физиологическая роль естественных ААТ. В оптимальных концентрациях естественные ААТ класса IgG разной органной специфичности синтезируются в организме здорового человека. Это нормальные регуляторные молекулы, выполняющие в организме ряд важных функций: они удаляют продукты физиологической гибели (апоптоза) из органов и тканей, являются регуляторами пролиферации и могут являться маркерами ранних изменений в органах, что позволяет выявлять дополнительные звенья патогенеза при различных заболеваниях [14–16]. Развитие любой болезни, как правило, сопровождается патологической активацией апоптоза клеток определенных органов и увеличением выброса соответствующих тканевых антигенов, что влечет за собой изменения продукции ААТ соответствующей специфичности. Изменения уровней отдельных ААТ, таким образом, указывают на изменения в соответствующих органах и тканях. Показано клинико-диагностическое значение определения физиологического аутоиммунитета при ряде заболеваний [17–19]. Изменения в содержании ААТ могут предшествовать клинической манифестации патологии, что позволяет использовать их в прогностических целях. Также было отмечено большое патогенетическое значение нарушений сывороточных концентраций естественных ААТ к ряду тканевых аутоантигенов при дерматозах различных типов патогенеза [20].
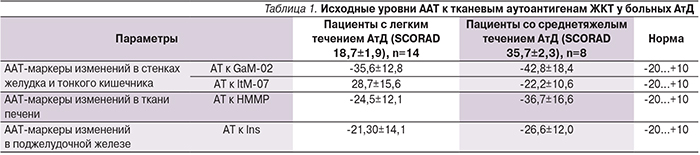
Было проведено комплексное клинико-лабораторное исследование больных АтД, включившее определение параметров физиологического (естественного) иммунитета с целью обнаружения скрытой патологии органов ЖКТ и последующей ее коррекции. В процессе обследования, в частности, определяли ААТ к мембранному антигену клеток стенки желудка (GaM-02), ААТ к мембранному антигену стенок тонкого кишечника (ItM-07), ААТ к мембранному антигену митохондрий гепатоцитов (HMMP) и ААТ – маркеры воспаления ткани поджелудочной железы.
Препараты для коррекции сопутствующих хронических заболеваний органов ЖКТ, за исключением традиционно назначаемых пробиотиков, не входят в обязательную схему лечения больных АтД. Лечение ЖКТ, таким образом, проводится гастроэнтерологами в случае наличия жалоб или выявления в результате проведения традиционных лабораторных и/или инструментальных диагностических методов патологии, в то время как очевидно, что более рано начатая коррекция нарушений ЖКТ, возможно, является гарантией большей эффективности комплексного лечения АтД.
Материал и методы
В исследование были включены 22 больных АтД обоего пола в возрасте от 15 до 18 лет с легким и среднетяжелым течением кожного процесса. Важным критерием включения в группу исследования было отсутствие указаний на какую-либо патологию органов ЖКТ на момент начала исследования или в анамнезе: отсутствие жалоб, признаков диспепсии, нарушений стула и т.п. В процессе обследования тщательно собирался анамнез, определен индекс тяжести процесса SCORAD (scoringof atopic dermatitis), а также проведено комплексное исследование физиологического (естественного) иммунитета методом иммуноферментного анализа (ИФА): определение сывороточных уровней ААТ различной специфичности, в т.ч. к аутоантигенам органов ЖКТ до и после курса лечения.
Критерии исключения из исследования: беременность, лактация, тяжелая онкологическая и инфекционная патология, сопутствующая соматическая патологии в стадии декомпенсации, проведенная 3 месяца назад, и позже системная терапия кортикостероидными и/или цитостатическими препаратами. Стабильность ремиссии оценивалась по прошествии 3 и 6 месяцев после окончания курса лечения.
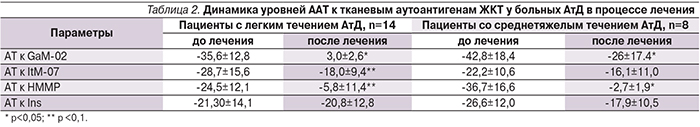
Определение уровня ААТ-маркеров в сыворотке крови проведено до начала курса лечения и через 2–3 недели после его окончания методом ИФА. Методологическим обоснованием исследования стали отечественные тест-системы для оценки состояния естественного аутоиммунитета, прошедшие международную сертификацию.
Лечение пациентов с АтД проведено в соответствии с Федеральными клиническими рекомендациями по ведению больных атопическим дерматитом (2015) [21], предусматривающими ступенчатость терапии: каждая ступень соответствует тяжести протекания заболевания и является дополнением к следующей. Всем пациентам вне периода обострения дерматоза было предписано соблюдение гипоаллергенной диеты и применение эмолиентов. В период обострения кожного процесса пациентам с легкой степенью тяжести АтД назначали топические глюкокортикостероиды и/или блокаторы кальциневрина. Пациентам со средней степенью тяжести дополнительно назначали пероральные антигистаминные препараты и УФ-терапию. Дополнительно с целью коррекции выявленных изменений органов ЖКТ пациентам назначали органотропные препараты животного происхождения.
В работах, посвященных проблеме лечения хронических мультифакториальных дерматозов, к которым относится и АтД, представлены результаты и клинико-патогенетическое обоснование применения в составе комплексной терапии средств метаболической коррекции, повышающих эффективность проводимой терапии [22–24].
Коррекция структурно-функцио-нальных повреждений органов ЖКТ органотропными препаратами предусмотрена представлениями об интегральных взаимодействиях органов ЖКТ, микрофлоры печени и кожи. Для компенсации выявленных изменений органов ЖКТ применены органотропные препараты животного происхождения, нормализующие кишечную микробиоту и энтерогепатическую циркуляцию.
Для коррекции микробно-тканевого комплекса кишечника рекомендуется органопрепарат, чьи лечебные эффекты обусловлены высокой биологической совместимостью с человеческим организмом, поскольку препарат вырабатывается из лиофилизата природной смеси полимеризированного секрета желудка птиц. Для метаболической коррекции нарушенной печеночной функции рекомендуется гепатопротектор-детоксикант, лекарственный препарат животного происхождения, изготовленный на основе лиофилизата клеток печени свиньи.
Проведенный курс метаболической коррекции эффективен и безопасен, поскольку применяемые лекарственные средства в своем составе содержат компоненты, аналогичные биомолекулам организма человека, к колебаниям концентраций которых он приспособлен и адаптирован [25].
Результаты исследования
У 77,3% обследованных подростков с АтД (17 человек из 22) в отсутствие жалоб и явных клинических признаков неблагополучия со стороны того или иного органа ЖКТ уровни ААТ к тканевым антигенам одного или нескольких из них (тонкого и толстого кишечника, поджелудочной железы, печени и желудка) были достоверно (р<0,05) снижены (табл. 1). Степень снижения общего среднего уровня ААТ коррелировала с тяжестью течения АтД.
Все больные перенесли лечение без побочных эффектов. Особо следует отметить хорошую переносимость органотропных препаратов 5 (22,7%) больными, у которых при обследовании была выявлена пищевая гиперчувствительность по замедленному (IgG4) типу продуктов животного происхождения, в т.ч. куриного мяса и/или свинины, что подтверждает надежную гипоаллергенность этих препаратов и безопасность их приема для пациентов с АтД.
После проведения курса лечения констатировано клиническое излечение (купирование обострения кожного процесса) всех обследованных пациентов или значительное улучшение. Среди пациентов с легкой степенью тяжести течения АтД индекс SCORAD уменьшился до 12,4±1,4, среди пациентов со среднетяжелым течением – до 24,3±3,9. По результатам повторных тестов на содержание ААТ к тканевым аутоантигенам ЖКТ констатирована их нормализация (табл. 2), что коррелировало со стойкой клинической ремиссией кожного процесса на протяжении 3 месяцев у 14 (63,6%) больных и 6 месяцев у 36,4% больных.
Выводы
Диагностика ранней субклинической патологии ЖКТ у больных АтД подросткового и молодого возраста имеет особое значение для успеха комплексного лечения. В этой возрастной категории пищевой фактор сохраняет важную роль в индуцировании обострений кожного процесса, следовательно, важность своевременной коррекции патологии ЖКТ, способствующей повышенной абсорбции пищевых аллергенов, трудно переоценить. Однако в отсутствие жалоб и явно выраженной симптоматики этому важнейшему патогенетическому фактору обострений АтД зачастую не уделяется должного внимания.
Изменение показателей аутоиммунитета является одним из наиболее тонких стигматов раннего поражения органов и систем. Динамика сывороточных уровней ААТ к тканевым аутоантигенам может служить маркером патологии органов ЖКТ у больных АтД и может быть использована для определения субклинической патологии органов ЖКТ при формировании комплексного персонализированного лечения пациентов с АтД, а также служить показателем его эффективности. Выявленные при помощи данной методики изменения (пониженные уровни специфических ААТ к тканевым аутоантигенам органов ЖКТ), скорее всего, носили метаболический характер и оказались следствием ухудшения клиренса соответствующих органов от продуктов естественного катаболизма. Нормализация уровней ААТ после проведенной терапии свидетельствовала о раннем функциональном характере этих нарушений. Таким образом, коррекция выявленной субклинической патологии органов ЖКТ с помощью органотропных средств метаболической коррекции Энтеросан и Гепатосан, нормализующих кишечную микробиоту и энтерогепатическую циркуляцию, позволяет повышать эффективность лечения АтД, сохранять более стойкую ремиссию и предотвращать переход заболевания в более тяжелую клиническую форму.


