Введение
Эректильная дисфункция (ЭД) – это постоянная или временная (не менее трех месяцев) неспособность достигнуть или сохранить эрекцию, достаточную для проведения успешного полового акта.
Риск развития ЭД повышается с возрастом, но не за счет процесса естественного старения, а вследствие возникновения серьезных сопутствующих заболеваний, в частности артериальной гипертензии, заболеваний сердца, гипогонадизма (как первичного, так и вторичного) и сахарного диабета.
Хотя ЭД – и распространенное нарушение, поражающее мужчин пожилого возраста, она часто не поддается правильной диагностике и лечению. К основной причине недостаточной диагностики ЭД относится стигматизация, характерная для любого нарушения половой функции.
Выявление, лечение ЭД и сопутствующих заболеваний на ранней стадии могут предотвратить их прогрессирование, развитие диабета и сердечно-сосудистых заболеваний.
В результате могут быть предотвращены инвалидизация пациентов, сохранены их здоровье и работоспособность, а также достигнута экономия бюджетных средств на оперативных пособий и последующем лечении инвалидов.
В результате изучение половой функции, дисфункции и методов ее лечения признано важной задачей научной и клинической медицины. Кроме того, т.к. ЭД связана с состоянием здоровья, врачи считают, что ее диагностика и лечение могут приводить к обнаружению угрожающих жизни заболеваний, которые в противном случае могли остаться недиагностированными.
На наш взгляд, в современных условиях большинство урологов диагностируют ЭД преимущественно в случае жалоб со стороны пациента, не проводя направленного опроса на предмет наличия симптомов ЭД. Нередко, занимаясь лечением ЭД, практические урологи не обращают достаточного внимания на жалобы больного или симптомы, указывающие на гипогонадизм. Также не все урологи активно используют препараты первой линии лечения ЭД, в результате более 50% пациентов с ЭД, посещающих урологов, остаются нелеченными или получают неэффективную терапию.
Целью данного исследования было выяснить, какие методы диагностики и лечения указанных заболеваний используются в различных медицинских центрах РФ с учетом возраста, стажа и места работы (амбулатория, ВУЗ, стационар) врачей-урологов; а также проследить зависимости и корреляции между методами обследования и лечения больных указанной патологией и местом работы, опытом специалиста.

Материал и методы
Методика исследования: анонимное анкетирование. Инструменты исследования: анкета – опросник врача-уролога. Анкета не содержала вопросов, способных служить для идентификации объекта исследования. Время заполнения анкеты было неограниченным.
Популяцией для данного наблюдательного многоцентрового исследования явились врачи-урологи, ведущие прием больных ЭД в наиболее густонаселенных регионах РФ. В опросе участвовали все специалисты из 11 центров Москвы, европейской части России, Урала и Западной Сибири. В отдельную группу были выделены 27 анкет из разных городов РФ, присланных из ГБОУ ВПО «Московский государственный медико-стоматологический университет им. А.И. Евдокимова». Центры были заслеплены и обрабатывались анонимно с присвоением номеров от 1 до 12 в случайном порядке.
После исключения из обработки неправильно заполненных (невалидных) все заполненные анкеты были подвергнуты статистической обработке. Неправильно заполненной считалась анкета, содержащая пропущенные вопросы (незаполненные) либо содержащие более одного ответа в вопросе, предполагающем только один ответ.
Статистические методы
На первом этапе использовалась описательная статистика, т.к. приведенные выше цифры по генеральной совокупности допускают использовать арифметические вычисления, сводящиеся к нахождению процентного соотношения между различными показателями.
Следует отметить, что т.к. в центрах работает различное число врачей и, соответственно, поступило разное количество анкет, то наиболее весомыми при расчете сводных показателей будут более многочисленные учреждения.
На втором этапе было принято решение выделить из общего массива анкет два подмножества с учетом больших колебаний частотных характеристик практически по всем вопросам анкет во всех медицинских центрах:
- врачей, практикующих в клиниках Москвы, – 210 анкет («Москва»);
- специалистов, работающих в иных центрах России, – 576 анкет («Не Москва»).
Кроме того, на втором этапе стандартными методами математической статистики была оценена корреляция для двух рассматриваемых подмножеств («Москва и «Не Москва») между следующими пунктами анкет:
- возраст врача и используемые методы лечения ЭД;
- стаж работы по специальности и используемые методы лечения ЭД;
- стаж работы по специальности и время на прием одного пациента;
- место работы и время на прием одного пациента;
- место работы и методы диагностики;
- место работы и методы лабораторной диагностики.
Результаты
В табл. 1 приведены вычисленные средние значения абсолютных величин по обработанным центрам следующих пунктов анкет: возраст врача, стаж работы по специальности, время на прием одного пациента, число пациентов с ЭД в месяц, число пациентов с гипогонадизмом в месяц.
Желтым цветом выделены минимальные значения показателей среди группировок, зеленым – максимальные.
Из анализа данных табл. 1 следует, что по всем средним величинам медицинские учреждения различаются, так:
- возраст врача колеблется от 40 до 55 лет;
- стаж работы от 16 до 29 лет;
- время на одного пациента от 21 до 26 минут;
- число пациентов с ЭД в месяц от 12 до 24;
- число пациентов с гипогонадизмом в месяц от 11 до 17.
Такие результаты, на наш взгляд, говорят о значительных различиях в рассматриваемых медицинских центрах в кадровом составе и опыте работы с рассматриваемыми заболеваниями.
Таким образом, среднестатистический уролог РФ выглядит следующим образом: врачу за сорок лет, после окончания высшего учебного заведения он специализируется в урологии порядка 20 лет, на одного пациента он тратит до 25 минут, пациентов с ЭД в месяц у него бывает около 20, а пациентов с гипогонадизмом в месяц около 15, если он не специализируется на подобных заболеваниях.
Далее следуют итоги, характеризующие место работы, какие методы постановки диагноза использует и как лечит ЭД среднестатистический уролог.
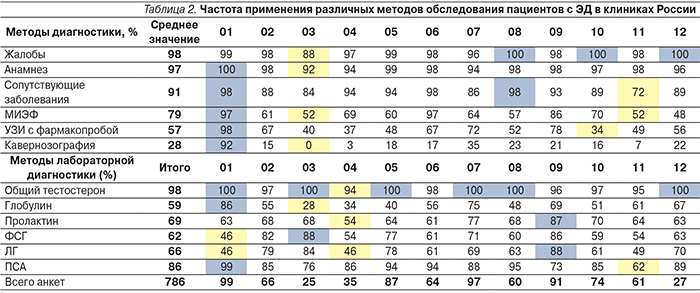
В табл. 2 приведены данные в процентах от общего числа опрошенных врачей о методах диагностики (жалобы, анамнез, сопутствующие заболевания, международный индекс эректильной функции – МИЭФ, общий тестостерон, глобулин, связывающий половые стероиды, пролактин, ФСГ, ДГ, общий ПСА, УЗИ с фармакопробой, кавернозография), используемых в клиниках России.
Как следует из табл. 2, практически все врачи, принявшие участие в исследовании, при установке диагноза ориентируются на жалобы пациента (98%), анамнез (97%) и сопутствующие заболевания (91%), из методов лабораторной диагностики в основном используются результаты анализов на общий тестостерон (98%) и общий ПСА (86% в случае, когда возраст пациентов превышает 40 лет).
Такие методы диагностики, как анкетирование с помощью опросника МИЭФ (79%), УЗИ с фармакопробой (57%) и кавернозография (28%), лабораторные исследования уровня глобулина, связывающего андрогены (59%), пролактина (69%), ФСГ (62%) и ЛГ (66%), пользуются популярностью в гораздо меньшей степени.
Однако, как и в случае с данными табл. 1, имеет место значительный разброс результатов в зависимости от места работы специалистов.
Так, по различным клиникам, использование отдельных методов диагностики врачами колеблется:
- МИЭФ – от 53% в центре № 3 до 97% в центре № 1;
- УЗИ с фармакопробой – от 34 до 37% в прочих городах РФ и центре № 4, до 98% в центре № 1;
- кавернозография – от 0% в центре № 3 до 92% в центре № 1.
Из приведенных результатов видно, что в полном объеме методами диагностики пользуются только урологи центра № 1.
Что же касается лабораторной диагностики, то колебания по различным методам следующие:
- глобулин, связывающий половые стероиды, – от 28% врачей в центре № 3 до 86% в центре № 1;
- пролактин – от 54% в центре № 4 до 87% центре № 9;
- ФСГ – от 46% в центре № 1 до 88% в центре № 3;
- ЛГ – от 46% в центре № 1 и в центре № 4 до 87% в центре № 9.
Подобные результаты свидетельствуют, как и в случае табл. 1, о неоднородности подхода к диагностике рассматриваемых заболеваний в опрошенных медицинских центрах.
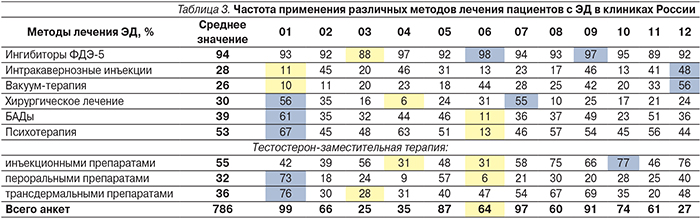
В табл. 3 представлены частотные характеристики использования специалистами различных методов лечения ЭД в процентах по представленным медицинским центрам.
Как следует из анализа данных табл. 3, практически все врачи используют при лечении ингибиторы ФДЭ-5 (94%). Что же касается остальных методов лечения, психотерапию и тестостерон-заместительную терапию инъекционными препаратами применяют более 50% врачей (53 и 55% соответственно), но и для этих методов имеется значительное колебание в частоте применения в различных клиниках:
- психотерапия – от 13% в центре № 6 до 67% в центре № 1;
- тестостерон-заместительная терапия инъекционными препаратами – от 31% в центрах № 4 и №6 до 77% в центре № 9;
- БАДы – 39% (от 11% в центре № 6 до 61% в центре № 1);
- тестостерон-заместительная терапия трансдермальными препаратами – 36% (от 28% в центре № 3 до 76% в центре № 1);
- тестостерон-заместительная терапия пероральными препаратами – 32% (от 6% в центре № 6 до 73% в центре № 1);
- хирургическое лечение – 30% (от 6% в центре № 4 до 55–56% в центрах № 7 и № 1);
- интракавернозные инъекции – 28% (от 11% в центре № 1 до 48% в остальных регионах РФ);
- вакуум-терапия – 26% (от 10% в центре № 1 до 56% в остальных регионах РФ).
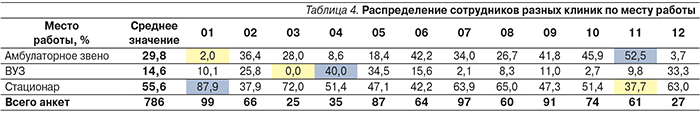
В заключение первого этапа целесообразно приводить статистические данные по месту работы врачей: в амбулаторном звене работают 30%, в вузах – 15%, в стационарах – 55% урологов.
Контроль лечения не проводят 6% врачей, а не направляют больного выявленной ЭД на обследование к кардиологу – 22% специалистов-урологов России.
В табл. 4 приведены данные по месту работы врачей в различных медицинских центрах.
Как и в случае с предыдущими результатами, анализ данных табл. 4 показывает крайнюю неоднородность распределения сотрудников разных клиник по месту работы. Говорить о среднем значении или определенном тренде в проценте врачей, работающих в том или ином звене медицинской помощи одного учреждения в зависимости от города или клиники, не имеет смысла.

Далее приводятся результаты обработки двух подмножеств:
- врачей, практикующих в клиниках Москвы, – 210 анкет;
- специалистов, работающих в иных центрах России, – 576 анкет.
В табл. 5 приведены вычисленные абсолютные величины средних значений по этим двум группировкам следующих пунктов анкет: возраст врача; стаж работы; время, затрачиваемое на одного пациента; число пациентов с ЭД в месяц; число пациентов с гипогонадизмом в месяц.
Как видно из табл. 5, все перечисленные параметры различаются не более чем на 1–2 единицы, т.е. практически показатели равны. Таким образом, можно принять предположение о схожести обоих подмножеств по рассматриваемым показателям.
Что же касается статистических данных по месту работы врачей, то в амбулаторном звене в Москве работают 19% специалистов, в других городах – 30%, в вузах соответственно – 16 и 15%, в стационарах – 65 и 55%.
Контроль лечения в Москве не проводят 4,3% врачей, в других городах – 6,8%, не направляют больного выявленной ЭД на обследование к кардиологу 22% урологов России как в Москве, так и в иных городах.
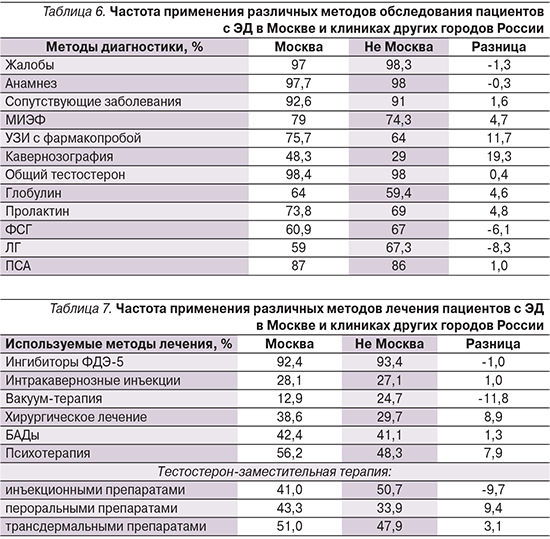
В табл. 6 представлены сравнительные итоги подсчета использования врачами тех или иных методов диагностики и лабораторной диагностики.
Из табл. 6 следует, что процент врачей, использующих такие методы диагностики, как сбор жалоб, анамнеза, уточнение наличия у пациента сопутствующих заболеваний, в Москве и других городах России практически не различается. Доля врачей, использующих опросник МИЭФ, различается уже на 4,7%, а для УЗИ и кавернозографии разница составляет уже 11,7 и 19,3% соответственно. В Москве урологи гораздо чаще используют вышеуказанные методы.
При анализе используемых методов лабораторной диагностики различий в частоте исследования уровней общего тестостерона и общего ПСА практически нет. Анализ уровня глобулина, связывающего половые гормоны и пролактина, в Москве назначается примерно на 5% чаще, ФСГ и ЛГ пользуются в Москве меньшей популярностью, чем в других городах России, причем более чем у 5% врачей (разница в частоте назначения составляет 6,1 и 8,3% соответственно).
В табл. 7 представлены сравнительные итоги подсчета использования урологами Москвы и других городов России тех или иных методов лечения ЭД.
Анализ данных табл. 7 говорит о том, что как в Москве, так и вне Москвы более 90% врачей используют ингибиторы ФДЭ-5. Все остальные методики лечения ЭД применяются урологами в гораздо меньшей степени.
В Москве и за ее пределами достаточно часто для лечения пациентов с ЭД используется тестостерон-заместительная терапия трансдермальными препаратами (51 и 47,9% соответственно) и психотерапия (56,2 и 48,3% соответственно).
Вне Москвы значительно чаще назначаются тестостерон-замести-тельная терапия инъекционными препаратами (50,7 против 41,0% в Москве) и вакуум-терапия (24,7 против 12,9%). В Москве же по сравнению с регионами большей популярностью пользуются хирургические методы коррекции ЭД (38,6 против 29,7%), тестостерон-заместительная терапия пероральными препаратами (43,3 против 33,9%).
Интракавернозные инъекции и БАДы урологами России везде назначаются примерно с одинаковой частотой – в Москве 28,1 и 42,4%, вне Москвы – 27,1 и 41,1% соответственно.
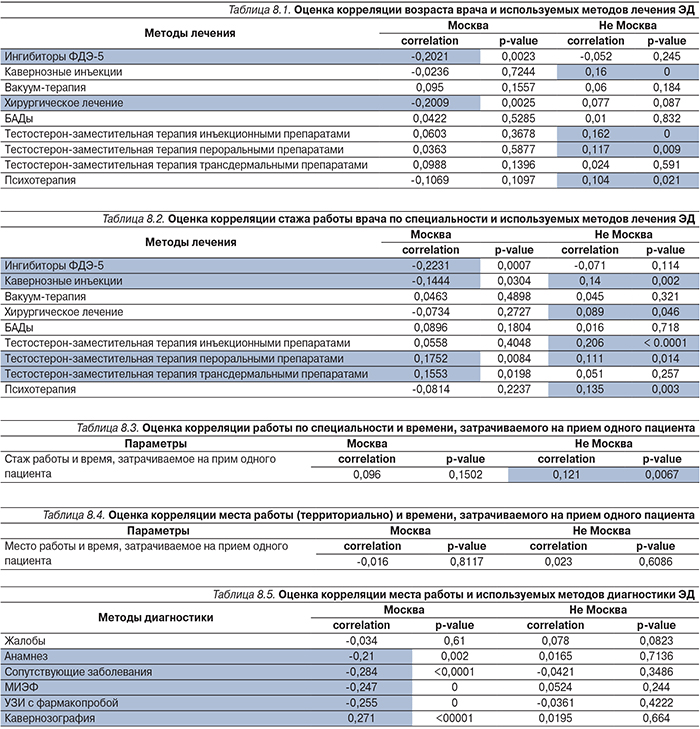
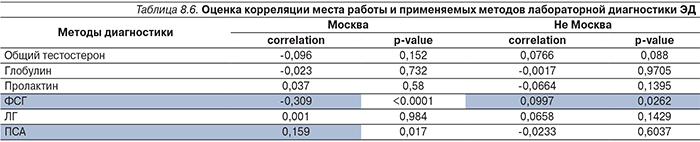
В табл. 8.1–8.6 продемонстрирована корреляционная оценка для двух рассматриваемых подмножеств («Москва» и «Не Москва») для следующих пунктов анкеты: возраст врача и используемые методы лечения ЭД; стаж работы по специальности и используемые методы лечения ЭД; стаж работы по специальности и время на прием одного пациента; место работы и время на прием одного пациента; место работы и методы диагностики; место работы и методы лабораторной диагностики. Зеленым цветом выделены пункты, для которых удалось установить устойчивую связь (p<0,05).
Выявить определенные тенденции, зависимости между центрами, различными пунктами анкет на основании полученного материала представляется достаточно сложным.
Полученные корреляции или слишком малы (<0,4–0,5 при p<0,05), или вообще отсутствуют (вероятность ошибки p>0,05).
Обсуждение
Термин «эректильная дисфункция» применим к широкому спектру состояний различной степени выраженности: от частичной недостаточности эрекции перед эякуляцией до полной ее утраты. По разным оценкам, примерно 30 млн мужчин в США и 90 млн во всем мире страдают этим патологическим состоянием различной степени тяжести. При этом распространенность ЭД увеличивается с возрастом: если среди мужчин 21 года проблемы с эрекцией испытывает каждый 10-й, то среди мужчин 40–69 лет с ЭД сталкиваются уже 33,9% [1]. Отмечаются и географические особенности в распространенности ЭД. Так, в Голландии у мужчин 50–80 лет частота ЭД составляет 11,0% [2], в аналогичной возрастной группе в Германии – 34,5% [3]. Анализ распространенности ЭД в Российской Федерации показал, что нормальная эректильная функция отмечается лишь у 10% респондентов, 71,4% испытывают симптомы ЭД легкой степени, 6,6% – умеренной и 12% – тяжелой [4].
Хотя термин ЭД используется как эквивалент импотенции, применение термина «эректильная дисфункция» более корректно, поскольку он указывает только на неспособность достигать и поддерживать эрекцию и не затрагивает личностные особенности мужчины. Термин «импотенция» имеет оскорбительный оттенок, который смущает пациентов и затрудняет обсуждение сексуальных проблем. Помимо этого импотенция может сопровождаться снижением полового влечения и способности достигать оргазм и эякуляцию, не обязательно сопутствующие заболеванию ЭД.
По механизму развития выделяют психогенную, васкулогенную, гормональную, нейрогенную, медикаментозную, кавернозную и смешанную формы ЭД. Из органических форм ЭД наиболее распространенные васкулогенная и гормональная.
Доказана связь между васкулогенной ЭД и гипертонической болезнью, диабетом, атеросклерозом, сердечно-сосудистыми заболеваниями [5, 6].
В основе всех перечисленных заболеваний лежит общий базовый патологический процесс – эндотелиальная дисфункция.
Эндотелиальная дисфункция – это генерализованный процесс, возникающий вследствие оксидативного стресса, нарушения метаболизма оксида азота, процессов окислительно-восстановительного фосфорилирования в стенке сосудов, в частности эндотелия. Проявлением эндотелиальной дисфункции может быть нарушение механизмов нормального кровотока в малом тазу, а также в системе коронарного кровообращения [7]. Нарушения кровотока могут манифестировать как ЭД в малом тазу и как атеросклероз коронарных артерий. ЭД – проявление нарушения функции эндотелия без промежуточных стадий, в то время как атеросклероз коронарных артерий может развиваться длительное время бессимптомно, не манифестируя ишемической болезнью сердца (ИБС) и острым коронарным синдромом [8]. Таким образом, ЭД как проявление эндотелиальной дисфункции может быть предиктором более опасной сосудистой патологии, а значит, может быть использована в качестве скрининговой оценки мужчин после 40 лет.
Другие методы скрининга ИБС на ранних стадиях, такие как анализ липидов крови, определение перфузии миокарда, толерантности к физической нагрузке, сократимости миокарда и др., являются значительно более дорогостоящими и инвазивными. Вследствие этого кардиологическая настороженность в отношении мужчин с ЭД может потенциально снизить затраты на диагностику и лечение с использованием высокотехнологичной медицинской помощи [9].
Распространенность кардиоваскулярных заболеваний, рост частоты ЭД, социальный и психологический дискомфорт современного мира обозначили эту «Mutually reinforcing triad» – «взаимно потенцирующую триаду» – главной проблемой здоровья мужчин в XXI в. [10].
В основе гормональной формы ЭД лежит гипогонадизм – заболевание, при котором снижена выработка мужских половых гормонов – андрогенов. Как правило, оно выражается в недоразвитии не только внутренних или наружных половых органов, но и вторичных половых признаков.
Клинические проявления гипогонадизма зависят от возраста, в котором появилось заболевание, и степени андрогенной недостаточности [11]. Нарушение продукции андрогенов во внутриутробном периоде может приводить к развитию двуполых наружных половых органов.
Признаков дефицита андрогенов множество. В частности, к ним относятся различные расстройства сексуальной функции: снижение либидо, ЭД, расстройства оргазма и эякуляции, снижение фертильности эякулята [12].
Проявлениями заболевания могут быть вегетососудистые и психоэмоциональные расстройства. Это внезапное покраснение (гиперемия) лица, шеи, верхней части туловища, а также чувство жара («приливы»), колебания уровня артериального давления, головокружение и ощущения нехватки воздуха. А из психоэмоциональных проявлений – это повышенная раздражительность, быстрая утомляемость, ослабление памяти и внимания, бессонница, депрессивные состояния, снижение общего самочувствия и работоспособности.
Сопровождать заболевание могут такие соматические проявления, как уменьшение мышечной массы и силы, увеличение жировой ткани, гинекомастия, уменьшение количества волос на лице и теле, истончение и атрофия кожи [13].
Гипогонадизм бывает первичным (гипергонадотропным) и вторичным (гипогонадотропным). Первичный гипогонадизм вызван дефектом самих яичек, т.е. нарушением функции тестикулярной ткани, причиной которой стали хромосомные нарушения. В результате выработка андрогенов затрудняется или ее нет вовсе, что приводит к недоразвитию половых органов. Возникновение вторичного гипогонадизма обусловлено нарушением структуры гипофиза, снижением его гонадотропной функции или поражением гипоталамических центров, регулирующих деятельность гипофиза. Первичный гипогонадизм обычно развивается в раннем детском возрасте и сопровождается задержкой психического развития, вторичный – психическими расстройствами. Как первичный, так и вторичный гипогонадизм может быть врожденным и приобретенным [14].
К причинам развития гипогонадизма относят недостаточность андрогенов, вызванную снижением количества вырабатываемых гормонов или нарушением их биосинтеза из-за патологии самих яичек. Это происходит в результате врожденного недоразвития половых желез, связанного с генетическими дефектами, например дисгенезии (нарушение тканевой структуры) семенных канальцев, дисгенезии или аплазии яичек (анорхизм, монорхизм). Возникновению врожденной патологии способствует прием ряда лекарств во время беременности. К гипогонадному состоянию также может приводить нарушение опущения яичек – крипторхизм [15]. К другой распространенной причине, способствующей снижению выработки андрогенов, относится токсическое воздействие химиотерапии, пестицидов, алкоголя, лекарственных средств (тетрациклинов и больших доз гормональных препаратов). К аналогичному результату могут приводить тяжелые инфекционные заболевания – эпидемический паротит, коревой орхит, эпидидимит, деферентит, везикулит, а также лучевое поражение, возникшее в результате рентгеновского облучения или лучевой терапии. Различные повреждения яичек – травмы, перекрут семенного канатика, варикоцеле – также играют не последнюю роль в уменьшении выработки тестостерона [14].
К вторичному гипогонадизму приводят воспалительные процессы, опухоли и сосудистые нарушения.
Гипергонадотропный гипогонадизм характеризуется повышенной секрецией тропных гормонов гипофиза, а гипогонадотропный – пониженной.
При некоторых формах гипогонадизма возможны проявления, характерные исключительно для данной патологии. Они зависят от возраста, в котором возникло заболевание, и степени андрогенной недостаточности. Если поражение яичек произошло до полового созревания, у больного развивается типичный евнухоидный синдром. Это высокий непропорциональный рост с удлинением конечностей, недоразвитием грудной клетки и плечевого пояса. Слабо развита скелетная мускулатура, подкожная жировая клетчатка распределена по женскому типу. Кожные покровы бледные, а вторичные половые признаки развиты слабо. Волосяной покров на лице и теле отсутствует, гортань недоразвита, голос высокий. Половые органы недоразвиты: малый размер полового члена, нет складок на мошонке, предстательная железа не определяется с помощью пальпации [15].
Кроме симптомов андрогенной недостаточности при вторичном гипогонадизме часто наблюдается ожирение и недостаточность функций других желез внутренней секреции – щитовидной и коры надпочечников. Практически отсутствуют половое влечение и потенция.
Если нарушение функции яичек произошло после полового созревания, симптомы заболевания выражены меньше, поскольку половые органы и костно-мышечный скелет уже сформировались. Но характерным признаком остаются уменьшение яичек, снижение оволосения лица и тела, истончение кожи и утрата ее эластичности, развитие ожирения по женскому типу, нарушение половых функций, бесплодие, вегетативнососудистые расстройства [15].
Важным признаком гипогонадизма служит мужское бесплодие: статистика говорит о том, что почти в 50% случаев мужского бесплодия его причиной остается именно гипогонадизм.
Гипогонадизм – хроническое заболевание, которое полностью вылечить не удается, но возможно уменьшить симптомы андрогенной недостаточности. Лечение направлено на устранение причин, вызвавших заболевание. Оно назначается строго индивидуально.
Основная цель лечения – профилактика отставания полового развития и бесплодия, если заболевание развилось, когда половое созревание уже завершено. Бесплодие, возникшее на фоне врожденного гипогонадизма или в период до завершения полового созревания, неизлечимо.
Выбор терапии зависит от клинической картины заболевания и степени выраженности его симптомов. Большое значение имеет наличие сопутствующей патологии, времени возникновения болезни и возраста, когда был поставлен диагноз.
Лечение взрослых пациентов состоит в коррекции недостаточности андрогенов и половой дисфункции. Длительная и постоянная терапия позволяет возобновить рост вторичных половых признаков и восстановить выработку андрогенов [16].
При врожденном и приобретенном гипогонадизме с сохраненной секреторной способностью яичек применяется стимулирующая терапия. Для лечения мальчиков используются негормональные препараты, а взрослых пациентов лечат гормональными средствами – небольшими дозами гонадотропинов или андрогенов. В отсутствие резервной способности яичек назначают прием тестостерона в течение всей жизни.
Заключение
Целью данного исследования было выяснить, какие методы диагности-ки и лечения ЭД используются в различных медицинских центрах РФ с учетом возраста, стажа и места работы (амбулатория, вуз, стационар) врачей-урологов.
По всем группировкам анкет, каждому центру и каждому вопросу анкеты были вычислены среднее значение, минимальные (min), максимальные (max), наиболее часто встречающиеся (moda) значения, среднее квадратичное отклонение.
Эти величины дают полное представление о состоянии вопроса в том или ином медицинском центре РФ, в которых проводилось анкетирование.
Однако выявить определенные тенденции, зависимости между центрами, различными пунктами анкет на основании полученного материала представляется достаточно сложным.
Полученные корреляции или слишком малы (<0,4-0,5 при p<0,05), или вообще отсутствуют (вероятность ошибки p>0,05).
Кроме того, полученные в результате расчетов статистические величины для каждого центра в большинстве случаев настолько различаются (см. представленные таблицы), что говорить о какой-то однородности кадрового состава врачей разных клиник и одинаковом подходе к диагностике и лечению ЭД не представляется корректным.
Можно сказать, что типичный (но не средний статистический) уролог РФ, который принял участие в этом исследовании, выглядит следующим образом:
- врачу за сорок лет, после окончания вуза он специализируется в урологии около 20 лет, на одного пациента с ЭД он тратит до 25 минут;
- работает уролог чаще всего в стационаре, но может вести или совмещать работу в вузе или амбулаторном звене;
- пациентов с ЭД в месяц у него бывает около 20, а пациентов с гипогонадизмом в месяц около 15. Если он не специализируется на подобных заболеваниях, тогда подобных больных может быть значительно меньше;
- для диагностики он использует в основном сбор жалоб пациента (98% врачей), анамнеза (97%) и данных о сопутствующих заболеваниях (91%), а из методов лабораторной диагностики использует результаты анализов на уровень общего тестостерона (98% врачей) и общего ПСА (86%) в случае, когда возраст пациентов превышает 40 лет;
- в лечении чаще используются ингибиторы ФДЭ-5 (94%), что же касается остальных методов лечения, только психотерапия и тестостерон-заместительная терапия инъекционными препаратами применяют более чем 50% врачей.
Выявить какие-либо значительные связи между пунктами анкет удалось далеко не по всем пунктам. Даже когда p-value <0,05 (т.е. вероятность ошибки при расчете корреляции меньше 5%), само значение корреляции мало и не превышает 0,2–0,3.
При анализе явно выделяется группа специалистов из центра № 1, имеющих наибольшие показатели практически по всем методам обследования и лечения. Те же специалисты имеют максимальные показатели по хирургической активности при лечении больных ЭД. Вместе с тем странно, что 73% специалистов центра № 1 применяют в качестве тестостерон-заместительной терапии пероральные препараты, эффективность которых довольно спорна и противоречива. По крайней мере объяснить этот факт исходя из данных анкетирования довольно сложно.
Без сомнения, необходима унификация обследования и лечения больных ЭД и гипогонадизмом, чтобы в любом регионе РФ больные получали квалифицированную медицинскую помощь.



