За последние десятилетия ожирение и избыточная масса тела стали достигать масштабов эпидемии. По данным Всемирной организации здравоохранения (ВОЗ) на 2014 г., 1,9 млрд взрослых имели избыточный вес [1]. Распространенность ожирения среди детей и подростков также растет; так, в 2007 г. эти показатели превысили данные 1970 г. в 9–10 раз [2]. В настоящее время проблема избыточной массы тела у лиц молодого возраста особенно актуальна, т.к. именно в этой возрастной группе отмечен неуклонный рост ожирения и связанных с ним гормонально-метаболических нарушений. Жировая ткань относится к активным эндокринным органам, синтезирующим ряд пептидных гормонов, одним из которых служит лептин. Лептин подавляет чувство голода и секрецию инсулина [3]. Его антагонист – грелин, продуцируется слизистой оболочкой желудка – напротив, стимулирует появление чувства голода [4]. Целью настоящего исследования стало изучение взаимосвязи грелина, лептина и метаболических показателей у юношей с ожирением и избыточной массой тела до и после проведения орального глюкозотолерантного теста.
Обследован 91 мужчина. Основную группу составили 76 юношей с ожирением и избыточной массой тела, средний возраст – 19,5 ± 1,6 года.
В контрольную группу включены 15 здоровых лиц, средний возраст – 20,3±0,8 года. Большинство (72,4%) больных ожирением не считали себя таковыми и жалоб не предъявляли. Жалобы выявлялись при активном расспросе: 60% больных беспокоили головные боли различного характера, 53,8% – одышка и колющие боли в области сердца, 30,4% – потливость, 3,4% – повышенный аппетит, 16,2% – жажда, 3% – головокружение. Из анамнеза: 72% пациентов отмечали хаотичное питание с поздними ужинами и избытком в рационе углеводов и жиров; 81,7% больных имели близких родственников, страдавших ожирением: один или оба родителя, брат, сестра. У 30% лиц в анамнезе выявлен хронический тонзиллит, у 9% пациентов четко прослеживалась связь начала заболевания с произведенной тонзилэктомией, 5% больных перенесли сотрясение головного мозга; у 13,6% обследованных не было выявлено четкой взаимосвязи ожирения с наследственностью и перенесенными ранее заболеваниями.
Избыточная масса тела наблюдалась у всех 76 больных, причем у 68,6% масса тела продолжала прогрессировать, у остальных 31,4% оставалась стабильной в течение последних 2–3 лет заболевания. Таким образом, в группе юношей преобладали пациенты с прогрессирующим течением болезни.
У 24,3% больных избыточная масса тела имелась с раннего детского возраста и нарастала постепенно; 12,2% пациентов отмечали на фоне уже имевшейся с раннего детства избыточной массы тела новую ощутимую прибавку в течение первого года пубертатного периода; у 63,5% пациентов ожирение впервые возникло в пубертатный период; 25% больных отмечали, что масса тела легко увеличивалась на фоне снижения двигательной активности, увеличения калорийности пищи и снижалась при повышении физической нагрузки, уменьшении калорийности питания. Рост обследованных колебался от 165 до 196 см, составив в среднем 180±0,10 см. Мелкие розовые полосы растяжения на коже встречались у 92,3% пациентов. У большей части (87,3%) больных ожирение и высокорослость сочетались с гинекомастией истинного, ложного или смешанного характера, что подтверждалось данными ультразвукового исследования молочных желез. У 12,8% юношей гинекомастия отсутствовала.

Индекс массы тела (ИМТ) рассчитывали по формуле: ИМТ=масса тела (кг)/рост (м2). Степень ожирения определяли по рекомендациям экспертов ВОЗ (1997): при ИМТ=25,0–29,9 кг/м2 диагностировали избыточную массу тела; ожирение I степени устанавливали при ИМТ=30,0–34,9 кг/м2, II степени при ИМТ=35–39,9 кг/м2, III степени при ИМТ ≥40 кг/м2.
В группе пациентов I степень ожирения была выявлена у 31, II – у 30, III – у 10. Избыточная масса тела диагностирована у 5 пациентов. Для определения характера распределения жира использован показатель отношения окружности талии (ОТ) к окружности бедер (ОБ). При значении ОТ/ОБ более 1 у юношей констатировали абдоминальный тип ожирения. У 63 (83%) пациентов с ожирением было отмечено глютеофеморальное ожирение, у 13 (17%) – абдоминальное. Длительность заболевания составила 5–14 лет.
Натощак в сыворотке крови измеряли концентрации грелина, лептина, инсулина, гормона роста, триглицеридов (ТГ), холестерина (ХС), холестерина липопротеидов высокой (ХС ЛПВП) и низкой плотности (ХС ЛПНП), глюкозы. Десяти пациентам утром на фоне не менее чем трехдневного неограниченного питания (более 150 г углеводов в сутки) и обычной физической нагрузки проводился стандартный оральный глюкозотолерантный тест (ОГТТ). Тесту предшествовало ночное голодание в течение 10–12 часов. После забора крови натощак пациент не более чем за 5 минут принимал 75 г безводной глюкозы, растворенной в 250–300 мл воды. Повторный забор крови осуществлялся через 60 и 120 минут. Диагностика нарушений углеводного обмена проведена в соответствии с диагностическими критериями ВОЗ 1999 г.
Концентрации грелина и лептина определены методом иммуноферментного анализа (ИФА) на аппарате Expert Plus (Asys, Австрия) c помощью иммуноферментного набора фирмы Diagnostic System Laboratories (США). Уровни липидов измерены спектрофотометрическим методом на полуавтоматическом биохимическом анализаторе Screen Master plus компании Hospitex diagnostic (Швейцария). Инсулин, гормон роста определены методом ИФА на аппарате Axsym (Abbott, Германия). Содержание глюкозы измерялось глюкозооксидазным методом на биохимическом анализаторе Liasys компании АМS (Италия). Индекс инсулинорезистентности рассчитан по методике Каро как величина отношения уровней глюкозы к инсулину, измеренных в состоянии обследуемого натощак [5].
Статистическая обработка полученных данных осуществлена методом вариационного и корреляционного анализа. Рассчитывали среднее арифметическое значение (М), стандартное отклонение (σ), коэффициент корреляции Пирсона (r). Достоверность различий определена по t-критерию Стьюдента с поправкой Бонферрони. Результаты в тексте и таблицах представлены в виде М±σ. Критический уровень значимости при проверке статистических гипотез в данном исследовании принят равным 0,05. Математическая обработка проведена на IBM PC в среде электронных таблиц Exel фирмы Microsoft и с помощью программы SPSS Statistica.
Результаты исследования липидного спектра приведены в табл. 1.
Содержание общего ХС у пациентов с ожирением практически не отличалось от показателей контрольной группы. Уровень ТГ и холестерина ЛПНП имел лишь тенденцию к повышению (р=0,50 и р=0,56 соответственно).
В то же время показатель холестерина ЛПВП достоверно снижался (р=0,001). По-видимому, этим можно объяснить некоторое повышение коэффициента атерогенности (р=0,14). Н.Т. Старкова и Е.В. Бирюкова в своих исследованиях также подчеркивают отсутствие значимых липидтранспортных нарушений плазмы у юношей с ожирением в состоянии натощак [6].
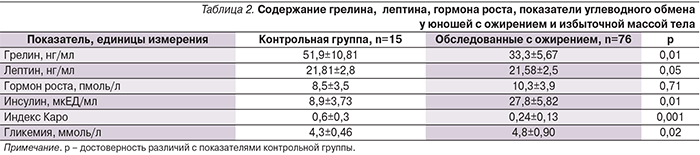
Установлено достоверное повышение гликемии у обследованных юношей, но при этом этот показатель находился в пределах нормального диапазона (табл. 2).
Снижение индекса Каро (р=0,001) свидетельствует об инсулинорезистентности. Нами выявлены корреляции уровня инсулина с ростом юношей (r=0,31; р=0,01), ИМТ (r=0,28; р=0,02), ОТ (r=0,31; р=0,01), ОБ (r=0,36; р=0,001), индексом Каро (r=-0,61; р=0,001). Рядом авторов также обнаружена инсулинорезистентность при данной патологии [6, 7].
У обследованных с ожирением и избыточной массой тела выявлено достоверное снижение уровня грелина (33,3±5,67 нг/мл, р=0,01) по сравнению с контрольной группой (51,9±10,81 нг/мл).
По данным S. Kanumakala и соавт. [9], уровень грелина у лиц с ожирением также снижен. Аналогичное снижение грелина при этой патологии обнаружили также G. Mingrone, L. Granato и соавт. [10]. Снижение уровня грелина сопровождалось увеличением концентрации гормона роста в крови юношей с ожирением относительно показателей контрольной группы, однако это повышение было недостоверным (p=0,71). Полученные данные согласуются с исследованием M. Misra и соавт. [11], в котором также отмечается отсутствие зависимости грелина и гормона роста при воздействии на энергетический баланс. В работе же M.R. Druce и соавт. (2005), напротив, обнаруживается взаимосвязь уровней грелина и гормона роста при ожирении.
Содержание лептина у пациентов с ожирением практически не отличалось от контрольных показателей (p>0,05). У юношей с ожирением установлена прямая слабая корреляция лептина (r=0,22; p=0,06) с инсулином и обратная слабая зависимость с индексом Каро (r=-0,26; p=0,02). Вероятно, что лептин принимает участие в формировании инсулинорезистентности, но при этом он не является определяющим фактором.
У юношей с пубертатным ожирением нами был проведен оральный глюкозотолерантный тест. Из табл. 3 видно, что уровень глюкозы сыворотки крови в ходе ОГТТ значительно возрастает через 60 минут (p<0,01) и через 120 минут возвращается к исходному уровню, при этом оставаясь в пределах нормальных значений на всем протяжении теста. Концентрация иммунореактивного инсулина (ИРИ) также значимо возрастает через 60 минут (p<0,0001). К 120-й минуте происходит снижение гормона, но его уровень все равно превышает исходное значение более чем в 2 раза (p<0,05).
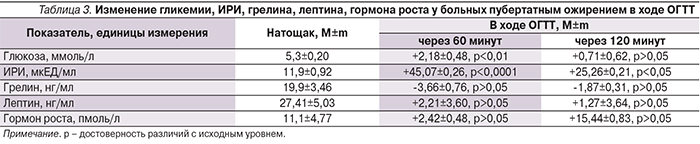
В ответ на повышение глюкозы крови через 60 минут содержание грелина, как это отмечено у здоровых людей (Shiya T., Nakasato M., Mizuta M., 2002; Murdolo G., Lucidi P., DiLoreto C. et al., 2003), должно было бы снизиться. Однако уровень грелина у больных ожирением в ходе теста практически не менялся (p>0,05), оставаясь практически на прежнем уровне через 120 минут ОГТТ. По литературным данным, в ответ на нагрузку с глюкозой гормон роста должен уменьшаться [11, 14]. Однако у юношей с ожирением на фоне выраженной гиперинсулинемии уровень гормона роста через 60 минут практически не менялся, отмечена лишь незначительная тенденция к его повышению (p>0,05). Эта тенденция к увеличению становится более значительной через 120 минут, когда содержание глюкозы в крови фактически пришло к норме, но, по-видимому, из-за разброса данных статистической значимости не достигает. Это свидетельствует о том, что прием глюкозы, а значит, и пищи не подавляет выброс грелина, сопровождается повышением гормона роста, что, по-видимому, служит одним из механизмов развития ожирения в юношеском возрасте.
Через 60 минут ОГТТ обнаружена положительная корреляция между уровнем грелина и ИРИ (r=0,82; p<0,05). Взаимосвязь грелина натощак с ИРИ не прослеживалась (p>0,05). По-видимому, это связано с преобладанием пациентов с глютеофеморальным типом распределения подкожно-жировой клетчатки. Аналогичные результаты были получены в исследовании F. Bacha, S.A. Arslanian (2005): подавление грелина, вызванное ОГТТ, прямо коррелировало с ИРИ в группе подростков с ожирением, несмотря на значительно более высокий ответ инсулина на нагрузку глюкозой для этой категории пациентов.
В ответ на введение глюкозы, как и приема пищи, концентрация лептина должна повышаться [16]. У обследованных больных отмечается лишь незначительное повышение гормона через 60 минут. Через 120 минут его содержание остается практически на том же уровне, что и через 60 минут. У больных с пубертатным ожирением нарушен, по-видимому, физиологический ответ лептина на введение глюкозы.
Проведенное исследование позволило сформулировать следующие выводы:
- У юношей с ожирением и избыточной массой тела выявлены гиперинсулинемия и снижение индекса Каро, что свидетельствует о наличии у них инсулинорезистентности.
- У больных с ожирением и избыточной массой тела выявлено достоверное снижение концентрации грелина и тенденция к повышению гормона роста. Уровни грелина и гормона роста в ходе проведения ОГТТ практически не меняются, что может свидетельствовать об их участии в развитии ожирения в юношеском возрасте.
- Физиологический ответ лептина на введение глюкозы юношам с ожирением и избыточной массой тела нарушен.



