Впоследние годы в клинической практике все большее признание получают препараты, обладающие сорбционно-детоксикационными свойствами энтеросорбентов. Энтеросорбция – метод, основанный на связывании и выведении естественным путем из желудочно-кишечного тракта (ЖКТ) с лечебной или профилактической целью эндогенных (токсические метаболиты, тяжелые металлы, токсины бактерий и т.д.) и экзогенных веществ, надмолекулярных структур и клеток (бактерий, вирусов и др.). Энтеросорбенты – это вещества, обладающие сорбционной емкостью, не разрушающиеся в ЖКТ, эффективно связывающие и выводящие из организма эндогенные и экзогенные токсичные соединения, надмолекулярные структуры и клетки, используемые с целью лечения и профилактики болезней [1–3].
Лечебный эффект энтеросорбентов осуществляется в результате их прямого и опосредованного воздействия на патогенетические механизмы. Прямое действие энтеросорбентов направлено на связывание и элиминацию из ЖКТ токсичных продуктов обмена и воспалительного процесса, патогенных бактерий и их токсинов, вирусов, биологически активных веществ (нейропептидов, простагландина, серотонина, гистамина), связывание газов, образующихся в избытке при бродильном или гнилостном процессе. Опосредованное действие обусловлено предотвращением или ослаблением клинических проявлений эндотоксикоза, токсико-аллергических реакций, диарейного синдрома, а также восстановлением целостности и проницаемости слизистых оболочек, улучшением кровоснабжения, стимуляцией моторики кишечника. Энтеросорбенты снижают метаболическую нагрузку на печень и почки, способствуют нормализации моторной, эвакуаторной и пищеварительной функций ЖКТ, положительно влияют на функциональное состояние иммунной системы и микробиоценоз кишечника [2, 4–7].
Метод энтеросорбции был известен еще нашим предкам, которые для лечения различных отравлений и токсических состояний использовали древесную золу, древесный уголь, ряд глинистых алюмосиликатов. Из них к 70–80 гг. нашего столетия в качестве официально зарегистрированного препарата пришел широко известный активированный уголь, а затем и другие углеродные энтеросорбенты (Карболонг, Микросорб, препарат СКН-1 и др.). Углеродные сорбенты увеличивают количество плотных компонентов в кишечном содержимом, оказывая положительное действие на моторику кишечника, адсорбируют газы, алкалоиды, токсины. Однако они не обладают выраженной селективностью связывания и при длительном их применении возможны побочные эффекты (запоры, снижение в организме уровня витаминов, гормонов, жиров, белков, некоторых микроэлементов), что может повлечь за собой серьезные метаболические нарушения.
Начиная с конца 1980-х – середины 1990-х гг. в медицинскую практику были введены энтеросорбенты из волокнистых форм пиролизованной целлюлозы – лигнина (Полифепан, Фильтрум-СТИ, Лактофильтрум, Лигносорб и др.), химические (Энтеродез, Энтеросгель и др.).
А также энтеросорбенты на основе высокодисперсной окиси кремния (Полисорб-МП), полученные по специальной технологии из морских бурых водорослей или альгинатов (Альгисорб), препараты на основе алюмосиликатов и глиноземов (Смекта, Неосмектин, Каопектат). Среди перечисленных энтеросорбентов в первую очередь заслуживают внимания препараты, способные абсорбировать или адсорбировать в ЖКТ и выводить с испражнениями не только токсические метаболиты, но и патогенные бактерии и вирусы. Доказано, что этим свойством обладает Смекта [43]. Энтеросорбенты широко используются в клинической практике как средства патогенетической, а в последние годы и как альтернатива этиотропной антибиотико- и химиотерапии кишечных инфекций как бактериальной, так и вирусной этиологии [8–11].
При выборе энтеросорбента для включения его в состав комплексной терапии острой кишечной инфекции (ОКИ) необходимо учитывать не только их способность к адсорбции и элиминации патогенных бактерий и вирусов, но и наличие побочных эффектов. Например, при длительном приеме углеродных сорбентов (активированный уголь, Микросорб П) возможны запоры, диарея, снижение в организме уровня витаминов, гормонов, жиров, белков и микроэлементов; препаратов на основе лигнина гидролизного (Полифепан, Энтегнин, Фильтрум) может нарушаться всасывание витаминов и кальция в ЖКТ, Энтеросгеля – усиление тошноты и метеоризма. Важным критерием выбора сорбента является также его сорбционная емкость и скорость поглощения эндо- и экзотоксинов патогенных бактерий. Как показали проведенные исследования [15], наибольшей скоростью поглощения эндотоксина Salmonella abortus th. обладает смектит диоктаэдрический (Смекта), сохраняя лидирующее положение в течение первого часа сорбции. Второе и третье место по скорости поглощения разделяют между собой Энтеросгель, Полисорб и Фильтрум (см. рисунок).
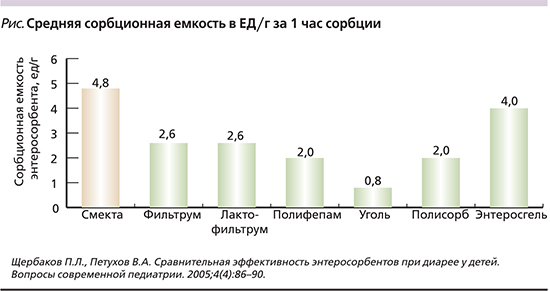
При анализе среднесуточной сорбционной емкости энтеросорбентов, которая определялась как отношение концентрации токсина после сорбции к объему сорбента, было показано, что Смекта и в этой группе также занимает лидирующую позицию, на втором месте стоят Фильтрум, Полисорб и Энтеросгель. При этом широко используемые в клинической практике Полифепан и активированный уголь не показали удовлетворительных результатов и занимают предпоследнее и последнее места соответственно как по скорости поглощения эндотоксина, так и сорбционной емкости.
Благодаря многоплановому и многофакторному характеру действия широко используемым энтеросорбентом в клинической практике является Смекта – диоктаэдрический смектит, который относится к числу сорбентов, высокостандартизированных по сырью, из которого его получают, имеет прочную полимерную кремнеорганическую основу, содержащую в качестве гетероатомов алюминий и магний, и обладает высокой сорбционной активностью. Внедрение метода энтеросорбции в клиническую практику при различных патологических состояниях позволило существенно повысить клиническую эффективность традиционной базисной терапии, в т.ч. и при кишечных инфекциях у детей [12–14].
С появлением на отечественном рынке в середине 1990-х гг. нового энтеросорбента Смекта (Ipsen, Франция) нами было проведено изучение его клинической эффективности в комплексной терапии кишечных инфекций бактериальной этиологии на 30 больных со среднетяжелыми и тяжелыми формами заболевания [16]. Было установлено, что у большинства (80%) больных, получавших в комплексной терапии антибиотики и Смекту, уже в 1-е сутки от начала лечения существенно уменьшается выраженность симптомов интоксикации и эксикоза. Одновременно уменьшаются частота и объем испражнений, на 3-й день – у 32%, а на 5-й – у 64% больных наступает клиническое выздоровление со стойкой нормализацией стула, в то время как в группе больных, не получавших Смекту, клиническое выздоровление в эти сроки имело место только в 20 и 45% случаев. При включении в базисную терапию ОКИ у детей энтеросорбента Смекта средняя продолжительность острого периода заболевания сокращалась с 5,6±0,8 до 4,8±0,6 дня (р<0,05). Вторым этапом наших исследований явилось изучение клинической эффективности и возможности использования Смекты как единственного средства этиотропной «стартовой» терапии легких и среднетяжелых форм ОКИ у детей [17].
Материал и методы
Под нашим наблюдением находились 66 больных ОКИ в возрасте от 6 месяцев до 14 лет с легкими (18,2%) и среднетяжелыми (81,8%) формами заболевания. Основную группу (63,6%) составили дети раннего (24,3%) и дошкольного (39,3%) возраста. Этиологический диагноз ОКИ с учетом результатов лабораторных исследований (бактериологического, серологического, диагностики с помощью полимеразной цепной реакции) установлен у 27 (40,9%) больных, в т.ч. сальмонеллез (3), шигеллез (2), клебсиеллез (6), энтеробактериоз (4) и ротавирусно-бактериальная ко-инфекция (12 больных). У большинства (81,8%) больных установлен «инвазивный» и лишь в 18,2% случаев смешанный «инвазивно-осмотический» тип диареи; 48,5% составили кишечные инфекции, протекавшие с клиническими проявлениями энтерита или гастроэнтерита и 51,5% – колита или энтероколита.
В зависимости от проводимой этиотропной терапии больные были разделены на три группы: 1-я (основная) – 22 ребенка, получали Смекту 3–5-дневным курсом, другие препараты с этиотропным действием этим больным не назначались; 2-я (группа сравнения) – 20 больных, получали фуразолидон 5-дневным курсом и 3-я группа (24 больных) – фуразолидон и Смекту.
Результаты исследования
Установлено, что при этиотропной монотерапии энтеросорбентом Смекта в отличие от лечения только фуразолидоном достоверно (р<0,05) сокращается средняя продолжительность симптомов интоксикации (с 3,80±0,18 до 3,01±0,16 дня), лихорадки (с 2,51±0,29 до 1,95±0,15 дня) и абдоминальных болей (с 2,58±0,16 до 1,70±0,11 дня). Средняя продолжительность острого периода заболевания с нормализацией стула сокращается с 5,30±0,36 до 4,22±0,18 дня (р<0,05).
В группе больных ОКИ, получавших комбинированную этиотропную терапию (фуразолидон+Смекта), клиническая эффективность была достоверно выше, чем монотерапия фуразолидоном. Клиническое выздоровление по окончании 3–5-дневного курса лечения энтеросорбентом Смекта имело место в 72,7%, только фуразолидоном – в 60%, а в сочетании со Смектой – в 83,3% случаев заболеваний. Анализ результатов исследования испражнений на дисбактериоз кишечника у 25 детей показал, что в группе больных, получавших только фуразолидон, дисбиотические изменения в микрофлоре кишечника в динамике заболевания прогрессировали, а при сочетании со Смектой практически оставались без изменений. В то время как при монотерапии Смектой имела место отчетливая тенденция к нарастанию lg-концентрации бифидо- и лактобактерий, полная санация или снижение титра представителей условно-патогенной микрофлоры до 102–3 КОЕ/гр.
Таким образом, полученные результаты исследования свидетельствуют о том, что этиотропная «стартовая» монотерапия легких и среднетяжелых форм ОКИ бактериальной и вирусно-бактериальной этиологии у детей энтеросорбентом Смекта является эффективной и дополнительного назначения антибактериальных препаратов, как правило, не требуется. Однако, как показали наши дальнейшие исследования, при среднетяжелых и тяжелых формах ОКИ бактериальной этиологии применение антибиотиков в сочетании с энтеросорбентами существенно повышает клиническую и санирующую эффективность терапии и препятствует дальнейшему прогрессированию дисбактериоза кишечника.
Обсуждение
В клинических исследованиях установлено, что энтеросорбенты способны оказывать не только патогенетическое, но и этиотропное действие за счет сорбции и элиминации из кишечника патогенных бактерий и вирусов. В экспериментальных исследованиях были подтверждены адсорбирующие свойства Смекты в отношении грамотрицательных микроорганизмов и их токсинов (Echerichii coli, Vibrio cholerae, Campylobacter jejuni, Clostridium difficile), а также ротавируса [18].
В ходе исследований in vitro было обнаружено воздействие этого препарата на механизм репликации ротавирусов. В опытах in vivo было установлено, что Смекта эффективно ограничивает проникновение ротавирусов через защитный слизистый барьер кишечника животных, а также обладает высокой связывающей способностью в отношении ротавирусов – до 90% вирусных частиц удаляется при минимальной концентрации сорбента в первые минуты после их контакта [19, 20]. В опытах на животных была установлена не только интестинальная абсорбция ротавируса, холерного токсина и кампилобактера, но и регулирующее влияние смектита на амплитуду перистальтических сокращений гладкой мускулатуры кишечника [21–23]. Результаты этих исследований свидетельствуют о том, что Смекта в сочетании с регидратацией и диетой может использоваться не только как средство патогенетической, но и этиотропной терапии при вирусных диареях [24, 25]. По данным проспективного рандомизированного контролируемого исследования, в которое были включены 804 ребенка, доказано, что Смекта способствовала существенному повышению эффективности проводимой регидратации и качества жизни при энтеритах и гастроэнтеритах [26, 27].
Данные других активных фармакологических исследований также показали, что клиническая эффективность Смекты основывается на ее способности фиксировать на себе и выводить желчные кислоты (за счет чего восстанавливается физиологическая энтерогепатическая циркуляция), а также кишечные газы [28]. Не менее важными являются и уникальные свойства препарата – способность фиксировать и выводить из кишечника непереваренные углеводы, играющие ключевую роль в патогенезе ротавирусной диареи, увеличение энзиматической активности гликокаликса и уменьшение потерь воды и электролитов с испражнениями [29].
В 2008 г. совместная рабочая группа ESPGHAN и ESPID опубликовала научно обоснованные рекомендации по применению противодиарейных препаратов, которые оправданно использовать в качестве дополнительной терапии диарейного синдрома у детей. Среди энтеросорбентов был рекомендован диоктаэдрический смектит (Смекта®) с высоким уровнем доказательности (II, B) в комплексе с пероральной регидратацией [30]. Диоктаэдрический смектит обладает текучестью и обволакивающей способностью, предохраняет слизистую оболочку кишечника от воздействия агрессивных и токсических факторов. Диоктаэдрический смектит проникает в муциновый слой и изменяет физические свойства слизи, увеличивая энзиматическую активность гликокаликса, тем самым снижая потерю электролитов и воды с калом [31]. Являясь селективным сорбентом, смектит выводит из организма бактерии, вирусы, токсины, желчные кислоты, избыточное количество углеводов и уменьшает количество газа [32].
В исследованиях М.С. Григорович [33] было установлено, что в группе детей с затяжной диареей при ротавирусной инфекции, получавших Смекту в реконвалесцентном периоде, нормализация частоты стула происходила на 3-й день реабилитационной терапии, тогда как у больных группы сравнения диарея купировалась на 5–6-й день лечения. Патологический характер стула в реконвалесцентном периоде сохранялся в среднем в течение 4,9±0,4 дня у детей на фоне приема Смекты и 6,3±0,6 дня у детей контрольной группы. В целом общая продолжительность кишечной дисфункции у детей, получавших Смекту, была на 2,8±0,2 дня короче, чем у детей группы сравнения.
В последние годы Смекта с успехом используется в лечении не только острой, но и хронической гастроэнтерологической патологии, что обусловлено протективными и адсорбирующими свойствами этого препарата.
Показаниями к назначению Смекты являются больные, перенесшие инфекционный колит и имеющие склонность к неустойчивому стулу с преобладанием поносов; при воспалительных заболеваниях кишечника (неспецифическом язвенном колите и толстокишечной форме болезни Крона в период нестойкой ремиссии); при антибиотико-ассоциированной диарее и псевдомембранозном колите в составе комплексной терапии. По данным Г.А. Григорьевой и соавт. [34], применение Смекты больными инфекционным колитом уже на 1-й неделе лечения (по 1 порошку 3 раза в сутки за 30 минут до еды) происходят нормализация стула, уменьшение метеоризма и улучшение психоэмоционального состояния. Тем не менее длительность курса должна определяться индивидуально и варьироваться от 3 до 5–6 недель для закрепления полученного результата.
С точки зрения доказательной медицины важным качеством Смекты является также способность препарата нейтрализовывать энтеротоксины A и B Clostridium difficile, что позволяет использовать ее в профилактике и лечении антибиотико-ассоциированных диарей у детей [35–38].
Проведенные научные исследования свидетельствуют о том, что Смекта является мукоактивным препаратом, предпочтительной мишенью для которого являются деструктуризированные муцины. Обладая высокой аффинностью к ним, препарат ингибирует деструкцию и тем самым приводит к восстановлению физических и реологических свойств слизи [39]. Благодаря возможности потенцировать защитные функции кишечного слизистого барьера Смекту считают цитопротектором поверхностного типа. Проспективные рандомизированные исследования показали, что благодаря своим мембрано-стабилизирующим свойствам Смекта препятствует разрушительному действию цитокинов воспаления, включая фактор некроза опухоли, что существенно для больных язвенным колитом и болезнью Крона.
Данные литературы подтверждают эффективность применения Смекты в качестве профилактического средства, в составе комплексной терапии и при другой гастроэнтерологической патологии. Так, в одном из исследований К.В. Арифуллина [40] включала Смекту в эрадикационные схемы терапии детей с хроническим хеликобактер-ассоциированным гастродуоденитом. Было установлено, что дополнительное применение Смекты позволяет устранять побочные эффекты, связанные с антибиотикотерапией. Одновременно Смекта сдерживает бурный рост патогенной микрофлоры и предупреждает развитие клинических симптомов клостридийного и стафилококкового дисбиозов. В другом исследовании Г.А. Григорьева и соавт. [41] получили хорошие результаты при добавлении Смекты в комплексную терапию псевдомембранозного колита.
В исследованиях А.А. Корсунского и соавт. [42] было проведено изучение эффективности Смекты на 19 детях с Helicobacter pylori-позитивных и 11 негативных гастритах и гастродуоденитах. Смекту назначали курсом 21 день в возрастной дозировке 3 раза в сутки через 60 минут после еды. Клиническая эффективность препарата выражалась в уменьшении болевого синдрома и других диспепсических явлений (тошноты, изжоги, отрыжки и метеоризма), которые в различной степени присутствовали до начала лечения у всех больных. Через неделю от начала лечения положительная динамика была отмечена у 78% больных, у 56% пациентов боль исчезла. Максимальный эффект от лечения достигался уже к концу 2-й недели. Объективным подтверждением эффективности Смекты явилось улучшение эндоскопической картины слизистой оболочки желудка. Отмечена и положительная динамика распространенности воспалительного процесса – после терапии ни у одного из детей не было обнаружено пангастрита и/или эрозий. Частота присутствия в желудке желчи (признак нарушения моторики) после лечения уменьшалась в 4 раза, признаки гастроэзофагеального и дуоденогастрального рефлюксов отмечались реже в 2,5 раза. Динамические исследования показали значительное увеличение вязкости желудочной слизи (p<0,01).
Заключение
Таким образом, смектит диокта-эдрический (Смекта) является одним из энтеросорбентов с доказанной клинической эффективностью. Включение Смекты в комплекс лечебных мероприятий при различных заболеваниях и патологических состояниях, в первую очередь сопровождающихся диареей, оказывает быстрые и выраженные дезинтоксикационный, гипотермический и антидиарейный эффекты. Сокращение частоты и объема испражнений быстро приводит к купированию эксикоза и, соответственно, симптомов интоксикации. Кроме того, Смекта обладает не только патогенетическим, но и этиотропным воздействием в отношении как патогенных бактерий, так и вирусов. Она препятствует прогрессированию дисбактериоза кишечника на фоне антибиотикотерапии и тем самым способствует более быстрому купированию функциональных нарушений со стороны ЖКТ. Цитомукопротективное и трофическое действия Смекты способствуют восстановлению морфологических нарушений в ЖКТ и купированию воспалительного процесса. Смекту следует рекомендовать в качестве стартовой терапии при диареях любой этиологии и типа (секреторный, осмотический, инвазивный и др.).


