Гонококковая инфекция (ГИ) до настоящего времени остается одной из наиболее распространенных, передаваемых половым путем (ИППП). В Российской Федерации (РФ) заболеваемость ГИ в последние годы характеризуется заметной тенденцией к снижению (с 129,7 на 100 тыс. населения в 2001 г. до 28,5 случая на 100 тыс. населения в 2014 г.), однако сохраняются существенные различия уровня заболеваемости в отдельных федеральных округах и субъектах страны [1].
Эпидемиологические факторы распространения ГИ во многом зависят от социальных, возрастных и гендерных особенностей лиц «групп риска» по распространению заболевания. Вместе с тем имеется масса научных публикаций, свидетельствующих о немаловажном значении в распространении ГИ, свойств ее возбудителя, в т.ч. биологических (фено- и генотипических) особенностей штаммов, циркулирующих в отдельных популяциях. Выявление биологических особенностей штаммов возбудителя ГИ Neisseria gonorrhoeae и изучение закономерностей их распространения являются современным направлением эпидемиологического контроля уровня заболевания [2].
Одной из наиболее актуальных проблем в лечении ИППП, в т.ч. ГИ, служит неуклонный рост резистентности возбудителей к антибактериальным препаратам. Появление и распространение резистентных штаммов микроорганизмов не позволяют достигать их эрадикации, способствуют длительному течению заболевания и развитию его осложненных форм.
Согласно рекомендациям Все-мирной организации здравоохранения (ВОЗ), при назначении антибактериальных препаратов следует учитывать региональную картину резистентности, т.е. опираться на данные, полученные в конкретной стране и ее регионах. Препараты, предназначенные для терапии ГИ, должны быть активными в отношении как минимум 95% (нижняя граница 95% доверительного интервала ≥95%) штаммов, выделяемых в регионе заражения, а в особых группах, связанных с высоким риском распространения ГИ, эффективность выбранного режима антибактериальной терапии должна приближаться к 100% [3]. В связи с этим во многих странах мира существуют свои национальные (региональные) программы по мониторингу резистентности N. gonorrhoeae, в РФ данной программой является RU-GASP (The Russian gonococcal antimicrobial susceptibility programme), реализуемая с 2002 г. Государственным научным центром дерматовенерологии и косметологии Минздрава России.
В настоящее время уровень устойчивости N. gonorrhoeae к антимикробным препаратам, применяемым для лечения ГИ, в различных географических регионах значительно варьируется. Наибольший уровень резистентности возбудителя к пенициллину (до 80–90%) наблюдается в странах Юго-Восточной Азии и Африки, при этом в ряде стран преобладают штаммы, продуцирующие β-лактамазу. Уровень устойчивости возбудителя к тетрациклину в мире остается также высоким и сравним с таковым устойчивости к пенициллину [4]. Одной из групп антимикробных препаратов, к которым N. gonorrhoeae начали приобретать резистентность относительно недавно (в конце 1990-х гг.), являются фторхинолоны. По данным ВОЗ на 2010 г., в странах Юго-Восточной Азии процент штаммов N. gonorrhoeae, резистентных к ципрофлоксацину, составлял от 10 (в Индии) до 97,6% (в Таиланде); в странах Западной части Тихого океана – от 0,6 (на Фиджи) до 95,1% (в Корее). На протяжении последних лет высокий уровень резистентности возбудителя ГИ к фторхинолонам отмечен в абсолютном большинстве стран мира (от 29,2 в Новой Зеландии до 98,6% в Гонконге), в странах Европы показатели резистентности варьировались в широких пределах и составили от 1,0 (в Латвии) до 90,9% (в Словакии).

До 2000 г., согласно результатам большинства многоцентровых исследований, проведенных в Европе и Северной Америке, не было выявлено резистентности гонококков к спектиномицину. В последующие годы сообщения об устойчивости возбудителя к антибактериальному препарату поступали в основном из Азиатско-Тихоокеанского региона [5].
Первые случаи выделения штаммов N. gonorrhoeae со сниженной чувствительностью к цефалоспоринам III поколения были зарегистрированы в 2001–2003 гг. В своих исследованиях M. Ito и соавт. (2004), N. Goire и соавт. (2012), S. Takahashi и соавт. (2013) отметили снижение чувствительности возбудителя ГИ к цефтриаксону, а рост резистентности к цефалоспоринам III поколения был первоначально зарегистрирован на Гавайях, в Японии, Канаде и Швеции [6–8].
Согласно данным о профиле резистентности гонококка в РФ, за последние годы наблюдаются однонаправленные тенденции роста устойчивости микроорганизма к пенициллинам, тетрациклинам, фторхинолонам, азитромицину, в меньшей степени – к спектиномицину. До настоящего времени среди выделенных N. gonorrhoeae не было выявлено штаммов, не чувствительных к препаратам группы цефалоспоринов: цефтриаксону и цефиксиму, уровень чувствительности как в целом по России, так и в отдельных Федеральных округах составил 100% (см. рисунок).
Результаты мониторинга уровня резистентности N. gonorrhoeae в РФ позволили научно обосновать выбор препаратов для терапии ГИ и включение их в Федеральные клинические рекомендации, согласно которым препаратом выбора для лечения ГИ нижних отделов мочеполового тракта, гонококкового фарингита и ГИ аноректальной области является цефтриаксон в дозе 500 мг внутримышечно однократно или цефиксим в дозе 400 мг перорально однократно, а альтернативным препаратом – спектиномицин в дозе 2,0 г внутримышечно однократно [1].
Лечение осложненных форм ГИ осуществляется по следующей схеме: цефтриаксон 1,0 г внутримышечно или внутривенно каждые 24 часа в течение 14 дней или цефотаксим 1,0 г внутривенно каждые 8 часов в течение 14 дней, или спектиномицин (альтернативный препарат) 2,0 г внутримышечно каждые 12 часов. Через 24–48 часов после начала парентеральной антибактериальной терапии при условии исчезновения клинических симптомов заболевания возможно продолжение терапии по схеме: цефиксим 400 мг 2 раза в сутки перорально с общей продолжительностью терапии 14 дней.
Таким образом, единственным пероральным цефалоспорином, рекомендованным для лечения урогенитальной, фарингеальной и ректальной ГИ, является цефиксим (Панцеф) – цефалоспориновый антибактериальный препарат III поколения для приема внутрь с выраженной антибактериальной активностью в отношении большинства грамположительных и грамотрицательных микроорганизмов.
Механизм действия препарата обусловлен угнетением синтеза клеточной мембраны микроорганизма. Кроме выраженной активности в отношении возбудителя ГИ Панцеф также высокоактивен в отношении условно-патогенных микроорганизмов, нередко вызывающих инфекционно-воспалительные процессы урогенитальной системы, в т.ч. в ассоциации с возбудителями ИППП – Streptococcus pyogenes, Streptococcus agalactiae, Escherichia coli, Proteus mirabilis, Proteus vulgaris и др.
Цефиксим в однократной дозе 400 мг включен в альтернативные режимы терапии ГИ в рекомендациях Sexually Transmitted Diseases Treatment Guidelines, CDC (The Centers for Disease Control and Prevention), а также рекомендуется в качестве альтернативного препарата в European Guideline on the Diagnoses and Treatment of Gonorrhoeae in Adults в дозе 400 мг перорально однократно совместно с азитромицином 2,0 г (в отсутствие цефтриаксона или отказа пациента от парентерального введения препарата) [9, 10].
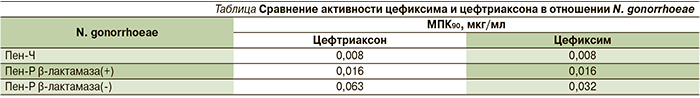
В сравнительных исследованиях активности цефиксима и цефтриаксона в отношении N. gonorrhoeae были получены результаты, подтверждающие сопоставимый профиль минимальной подавляющей концентрации (МПК) данных препаратов (см. таблицу).
Кроме того, в современных исследованиях установлена сопоставимая эффективность цефиксима (400 мг) и цефтриаксона (125 мг) при лечении ГИ у беременных: 95 и 96% соответственно [11]. Food and Drug Administration относит цефиксим к препаратам категории В для беременных, отмечая, что применение цефиксима беременными, больными ГИ безопасно и уменьшает частоту инфицирования новорожденного [12].
Необходимо отметить, что в литературе описана возможность развития инъекционных осложнений после введения цефтриаксона, таких как уплотнение и напряжение (отек) тканей, гиперемия, индурация кожи и подкожной клетчатки (при внутримышечном введении раствора в концентрации 250 и 350 мг/мл). Кроме того, введение цефтриаксона в подкожную жировую клетчатку может приводить к развитию абсцесса, некроза тканей, неэффективности терапии вследствие недостаточной концентрации препарата в очаге инфекции, в связи с чем более предпочтительна пероральная терапия [13–15].
К одним из неоспоримых преимуществ препарата Панцеф относится его выпуск в форме суспензии. После приема внутрь всасывание цефиксима составляет 40–50% независимо от приема пищи; однако отмечено, что максимальные концентрации препарата в сыворотке крови достигаются быстрее при приеме препарата вместе с пищей. При этом установлено, что после приема суспензии максимальная концентрация препарата выше на 25–50% по сравнению с таковой при приеме таблетированной формы. Высокие концентрации препарата длительно сохраняются в сыворотке крови, желчи, моче, а период полувыведения из здоровых добровольцев составляет в среднем 3–4, в отдельных случаях – 9 часов.
Продолжительный период полувыведения делает возможным однократное дозирование цефиксима.
В настоящее время имеются доказательства связи между кратностью приема лекарственного средства и приверженностью пациента врачебным рекомендациям. Так, в частности, при однократном приеме препарата приверженность составляет 98,3%, в то время как при 2–3-кратном приеме в сутки его приверженность – 75 и 63,3% соответственно. Прием антибактериального препарата 1 раз в сутки позволяет достигать наибольшей приверженности, что особенно важно при лечении пациента в амбулаторных условиях. Результаты современных исследований свидетельствуют, что в случае выполнения всех врачебных рекомендаций, в т.ч. и в отношении антибактериальной терапии, достигаемая терапевтическая эффективность существенно выше, чем при «неподчинении» пациента предписанному режиму лечения [16].
Таким образом, цефиксим (Панцеф) полностью соответствует современным требованиям ВОЗ и CDC, предъявляемым к антибактериальным препаратам для лечения ИППП, к которым относятся:
- клиническая эффективность >95%;
- низкая стоимость;
- хорошая переносимость;
- низкий уровень резистентности (<5%);
- эффективность терапии однократной дозой (для неосложненных форм заболеваний);
- наличие пероральной лекарственной формы;
- возможность применения во время беременности и лактации.



