Среди костных заболеваний наиболее распространенным и драматичным по последствиям остается остеопороз (ОП). С клинических позиций развитие ОП определяется многочисленными факторами: возрастом, массой тела, наступлением менопаузы, приемом глюкокортикоидов и других препаратов, влияющих на костный метаболизм, сопутствующими заболеваниями, др. На тканевом уровне эти факторы приводят к дисбалансу остеокластопосредованной костной резорбции и остеобластопосредованного костного формирования с нарушением нормального гомеостаза костной системы и как следствие – к потерям костной массы.
Современные концепции фармакологического лечения ОП фокусируют свое внимание на усилиях по ограничению остеокластопосредованной костной резорбции. Наиболее изученными и распространенными препаратами являются азотсодержащие бисфосфонаты, которые индуцируют апоптоз остеокластов. Активность остеокластов ограничивают также кальцитонин, эстрогены, селективные модуляторы эстрогеновых рецепторов, а также новый утвержденный антирезорбтивный препарат деносумаб, представляющий собой гуманизированное антитело против рецептора активатора нуклеарного фактора κВ (NF-κВ), который функционирует как ингибитор образования остеокластов.
В США, Канаде, России, некоторых странах Европы утвержден анаболический агент терипаратид, который пока в единственном числе выступает в качестве противовеса всей армаде антирезорбтивных препаратов. Однако последние экспериментальные и клинические исследования указывают на то, что данная ситуация должна коренным образом измениться в ближайшем будущем. Это связано в первую очень с открытием новых молекул, регулирующих костный гомеостаз. Среди таких молекул выгодно выделяется склеростин [1]. В самом деле, последние доклинические и ранние клинические исследования склеростина могут открыть широкий путь к созданию новых анаболических препаратов, что пополнят существующий фармакологический арсенал.
Склеростин (SOST) является эндогенным ингибитором канонического Wnt/β-катенин-сигнального пути. В его присутствии предшественники остеобластов не подвергаются воздействию Wnt-сигнала, в результате процесс дифференциации остеобластов приостанавливается. В последние годы внимание к Wnt-сигнальному пути приковано в связи с открытием его влияния на процессы формирования и регенерации костной ткани, а модуляция этого пути может оказаться полезной в лечение ОП и других костных заболеваний [8, 12, 16]. Одновременно изучение ряда редких генетических заболеваний, в частности остеосклерозирующих, позволило выявить участие Wnt-сигнального пути в регуляции формирования костной ткани [1].
С другой стороны, склеростин, который продуцируется остеоцитами, ограничивает процесс формирования костной ткани во избежание избыточного окостенения. Например, при генетически детерминированных заболеваниях костной ткани, проявляющихся избыточным окостенением (склеросклероз, болезнь ван Бухема), установлен дефект гена, отвечающего за экспрессию склеростина. Дефект, приводящий к склеростерозу, был определен в гене, названном SOST, который локализуется в хромосоме 17q12-21 и кодирует белок склеростин [10].
Сегодня известно, что склеростин представляет собой циркулирующий ингибитор сигнального пути Wnt, который продуцируется остеоцитами и подавляет функцию рецептор-связывающего протеина LPR5. Антитела, направленные против склеростина, должны, таким образом, обладать анаболическими свойствами (рис. 1). Склеростин-нейтрализующие моноклональные антитела (Scl-Ab) блокируют остеоцит-продуцированный склеростин, который является антагонистом Wnt-сигнального пути и предотвращает связывание Wnt и корецептора LRP5/6. Связанный/блокированный склеростин позволяет связаться Wnt с комплексом LRP5/6, тем самым стимулируя активность Wnt/β-катенин сигнального пути в остеобластах, что приводит в конечном итоге к увеличению их остеосинтетической активности и повышению костеобразования.
За последние две декады появилось огромное количество работ о ведущей роли Wnt/β-катенин-сигнального пути в дифференциации остеобластов, пролиферации, выживании и в конечном счете в формировании новой костной ткани [12, 13, 26, 32]. Как множество подобных регулирующих сетей, Wnt-сигналлинг модулируется комплексом агонистов и антагонистов, соотносительное действие которых определяет, будет ли Wnt-сигнальный путь стимулироваться или же ингибироваться. Склеростин идентифицирован только десять лет назад как гликопротеин, что продуцируется остеоцитами, и способен блокировать связывание Wnt и корецептора LRP5/6. Интересно, что у людей с гетерозиготной мутацией, приводящей к инактивации склеростина, сывороточные уровни склеростина приблизительно наполовину ниже нормы, но темпы формирования костной ткани значительно увеличены. Такие выводы сразу позволили предположить, что снижение уровня склеростина может быть новым направлением в регуляции костной массы, что послужило активизации исследований по созданию и апробированию новых анаболических агентов.
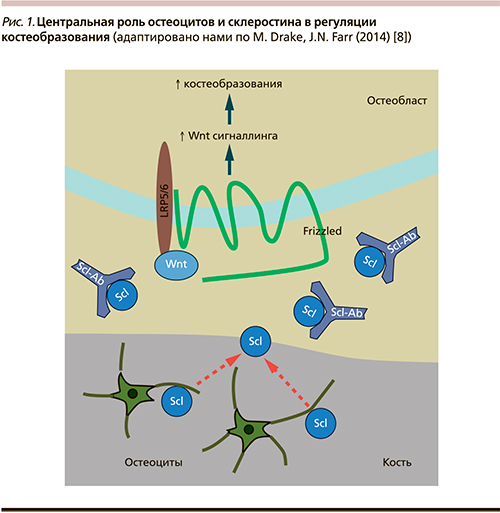
Открытие склеростина и установление его биологической роли как негативного регулятора остеобластогенеза не могли не вызвать интереса с позиции разработки нового терапевтического подхода к лечению ОП [34]. На сегодняшний день уже созданы гуманизированные моноклональные антитела к склеростину (Scl-Ab), действие которых было апробировано на грызунах и нечеловекообразных обезьянах. При этом был получен убедительный положительный эффект, и в настоящее время изучение их активно продолжается [8].
Многочисленные экспериментальные исследования, проведенные буквально за последние 5 лет с использованием различных моделей заболеваний скелета, убедительно демонстрируют, что ингибирование склеростина с помощью моноклональных антител улучшает структуру костной массы и костную прочность, а также улучшает сращение переломов на моделях мышей и крыс [2, 11, 17, 28]. Кроме того, в исследовании с использованием гуманизированных склеростин-нейтрализирующих моноклональных антител (Scl-Ab) подкожно у овариэктомированных макак продемонстрировано четкое дозозависимое анаболическое действие на костную ткань с повышением образования в трабекулярной, эндо-, интракортикальной и периостальной тканях без негативного влияния на качество костного матрикса, что установлено с помощью компьютерной томографии и гистоморфометрии [30, 33]. При этом прочность костей оценивали с помощью тестов на компрессию тел III и IV поясничных позвонков. Интересно также, что гистоморфометрические исследования у грызунов и обезьян демонстрируют, что лечение ингибиторами склеростина повышает моделирование костеобразования (происходящее непосредственно на покоящихся поверхностях), а не собственно ремоделирование (в ответ на костную резорбцию) [29]. Следует отметить, что данный механизм отличается от эффектов терипаратида, при котором оба процесса – формирование и резорбция – возрастают.
Scl-Ab применяли у мышей с индуцированным колитом, сопровождающимся потерей костной плотности [9, 17]. Точные механизмы, посредством которых системное воспаление приводит к потере костной массы, непонятны. Предполагают, что фактор некроза опухоли α подавляет образование остеобластов за счет активации Е3-убиквитин лигазы (Smurf1 – Smad ubiquitin regulatory factor-1) и запускает в зрелых остеобластах процессы апоптоза через сигнальный путь ядерного фактора κВ (NF-κB) [6]. Применение ингибитора склеростина существенно не повлияло на воспаление кишечника, но обеспечило восстановление костной массы и предупредило дальнейшее разрушение трабекулярной кости, что позволило восстановить ее объем и плотность до уровня здоровых мышей контрольной группы [17].
Антисклеростин-терапия также продемонстрировала благотворное влияние на процесс сращения костей у грызунов с ускорением репарации, повышением прочности кости и увеличения плотности костной мозоли [2, 18]. При исследовании особенностей сращения переломов у мужских особей макак было установлено, что лечение моноклональными антителами к склеростину в течение 10 недель улучшает заживление переломов, что сопровождается увеличением площади мозоли, ее плотности и торционной жесткости [27]. Важно, что терапия Scl-Ab повышает костеобразование, костную массу и силу.
В общем, эти преклинические данные показали последовательный анаболический эффект ингибиторов склеростина, чего достаточно, чтобы оправдать начало клинической фазы исследований с целью определения того, будут ли происходить подобные скелетные реакции в организме человека в ответ на применение ингибиторов склеростина.
С декабря 2006 по июль 2007 г. в США проведено двойное слепое рандомизированное плацебо-контролируемое исследование AMG785 (AMG785 – позднее бренд «ромосозумаб»), моноклональных антител к склеростину, которые вводились однократно, при этом участники были разделены на когорты, получающие различные дозы исследуемого препарата [31].
Участники получали AMG785 или плацебо (Пл) – 3:1 – подкожно (в дозе 0,1; 0,3; 1; 3; 5 или 10 мг/кг) или внутривенно (1 или 10 мг/кг). Когорты с подкожным введением препарата получали дозы последовательно. Решение о введении следующей более высокой дозы участникам соответствующей когорты принималось исследователями после того, как всем участникам предыдущей когорты, которая должна была получить менее высокую дозу, вводили исследуемый препарат и проводили мониторинг его безопасности в течение >6 сут. Все 72 добровольца закончили исследование (18 из них получали Пл и 54 – AMG785). Из них 56 (14 группы Пл и 42 – AMG785) получали исследуемый препарат подкожно и 16 (4 – Пл и 12 – AMG785) – внутривенно. По сравнению с Пл однократное подкожное введение AMG785 повысило минеральную плотность костной ткани (МПКТ) в поясничных позвонках и бедренной кости во всех когортах. Она измерялась на 29-й, 57 и 85-й дни. Повышение МПКТ было дозозависимым. Самое значительное повышение МПКТ в поясничных позвонках (на 5,3%) и бедренной кости (на 2,8%) наблюдалось на 85-й день в когорте, получавшей препарат в дозе 10,0 мг/кг подкожно. При этом в когорте, получавшей его внутривенно в дозе 5,0 мг/кг, на 85-й день наибольшее повышение МПКТ в поясничных позвонках составило 5,2%, в бедре – 1,1%. Побочные эффекты были отмечены у 60% добровольцев, получавших Пл, и у 64% добровольцев, получавших AMG785, подкожно. При внутривенном введении они зафиксированы у 50 и 25% участников соответственно. Большинство побочных эффектов, по мнению исследователей, были умеренными [31].
Кроме того, эффект одной дозы AMG785 на костный метаболизм и МПКТ был впечатляющим [8]. Анализ сывороточных маркеров костного обмена выявил дозозависимое повышение маркеров костеобразования и снижение маркеров костной резорбции. Одновременно этот дивергентный эффект костного метаболизма обусловил надежный ответ костной ткани – достоверное повышение МПКТ. Важно, что лечение Scl-Ab служит первым фармакологическим подходом с возможностью одновременно стимулировать формирование кости и ингибировать костную резорбцию у человека [8, 16]. Однако последние данные о снижении сывороточного уровня маркеров костной резорбции стали сюрпризом, поскольку точные механизмы этого процесса неизвестны. Тем не менее выводы данного исследования создали предпосылки к дальнейшему более длительному изучению ингибиторов склеростина у пациентов с ОП.
Во II фазе рандомизированного плацебо-контролированного многонационального исследования (ClinicalTrials.gov indentifier: NCT01059435) эффективность, безопасность и толерантность ромосозумаба были оценены 419 постменопаузальными женщинами с Т-критерием ниже -2,0 SD до -3,5 SD в области шейки бедренной кости и поясничных позвонках [20]. Пациентки были рандомизированы в 9 групп, которые получали 1 раз в месяц подкожно ромосозумаб в дозе 70 мг, 140 и 210 мг или 1 раз в месяц подкожно плацебо (Пл), каждые 3 месяца подкожно ромосозумаб в дозе 140 и 210 мг или каждые 3 месяца подкожно Пл; или препарат для открытого сравнения терипаратид 20 мкг подкожно ежедневно, или алендронат 70 мг перорально 1 раз в неделю. Такие группы позволили не только оценить дозозовисимое действие нового препарата, но и сравнить основные конечные точки с эталонными препаратами анаболического и антирезорбтивного действий.

Первичная точка изменений МПКТ в поясничном отделе позвоночника была оценена через 12 месяцев (группы ромосозумаба и Пл). Все дозы ромосозумаба достоверно (р<0,005) повышали МПКТ в поясничных позвонках, шейке бедренной кости и в общем в бедренной кости, а также все дозы ромосозумаба достоверно повышали сывороточную концентрацию маркера костеобразования (Р1NT) и снижали сывороточный уровень маркера резорбции (СТХ) еще в первую неделю. Наиболее значительное повышение МПКТ отмечено при месячной дозе ромосозумаба 210 мг подкожно: на 11,3% – в области поясничных позвонков и на 4,1% – в области бедренной кости. Необходимо отметить, что эти показатели также достоверно превышали приросты на терипаратиде и алендронате. Несмотря на то что ромосозумаб и терипаратид являются анаболическими агентами, их воздействие на маркеры костного метаболизма оказались разнонаправленными: терипаратид увеличивал уровни Р1NT и СТХ, тогда как ромосозумаб снижал концентрацию СТХ и повышал уровень Р1NT [21].
III фаза рандомизированного двойного слепого плацебо-контролируемого исследования в параллельных группах ромосозумаба у постменопаузальных женщин продолжается в данный момент (ClinicalTrials.gov indentifier: NCT01575834). В исследование включены 6000 женщин в возрасте 55–90 лет. Первичные конечные точки включают оценку частоты новых вертебральных переломов через 12 и 24 месяцев терапии. Исследование стартовало в марте 2012 г., и оглашение первых результатов ожидается в октябре 2015 г. [16].
Успех антисклеростин-терапии в экспериментальных и клинических исследованиях дал серьезный толчок к созданию новых моноклональных антител к склеростину. Так, прошел две фазы клинических исследований новый препарат, блосозумаб (Blosozumab), он также испытывается во II фазе BPS804 (ClinicalTrials.gov indentifier: NCT01406548).
В I фазе рандомизированного двойного слепого плацебо-контро-лируемого исследования оценивалось влияние повышающих доз блосозумаба, а также его применение в виде подкожного и внутривенного введений на МПКТ и маркеры костного метаболизма у постменопаузальных женщин. Были установлены статистически значимые изменения склеростина, остеокальцина, костно-специфической щелочной фосфатазы и СТХ [23]. МПКТ в поясничном отделе позвоночника повышалась от 3,41% при единичном введении до 7,71% при повторном на 85-й день наблюдения [22].
Это исследование ответило также на важный вопрос о возможности применения ингибиторов склеростина при предыдущем лечении бисфосфонатами. Действительно, бисфосфонаты являются основным препаратом для лечения ОП и множество пациентов во всем мире используют их; они же имеют свойства накапливаться и длительное время сохраняться в костной ткани. Одновременно некоторые исследования продемонстрировали, что скелетные эффекты терипаратида снижаются после предварительной антирезорбтивной терапии [5]. Интересно, что использование бисфосфонатов до начала терапии блосозумабом не оказали значимого влияния на маркеры костеобразования и ответ МПКТ [22].
Эффективность, безопасность и переносимость были изучены во II фазе исследования (ClinicalTrials.gov indentifier: NCT01144377) [4]. В испытание были включены 154 женщины (средний возраст – 65 лет) со средним показателем Т-критерия -2,76SD в поясничном отделе позвоночника. Пациентки были рандомизированы в группы в зависимости от схемы введения блосозумаба: 180 мг подкожно каждые 2 недели, 270 мг подкожно каждые 2 недели, 180 г подкожно каждые 4 недели или плацебо подкожно каждые 2 недели. Первичные конечные точки оценивались через 52 недели терапии. В поясничном отделе позвоночника МПКТ через 52 недели повышалась на 6,7% при дозе блосозумаба 270 мг каждые 2 недели, на 8,4% – при дозе 180 мг каждые 4 недели, 13,9% – при 180 мг каждые 2 недели и 17,8% – при 270 мг каждые 2 недели. Побочные эффекты были сравнимы во всех группах.
В настоящее время планируется проведение III фазы по изучению влияния блосозумаба на частоту переломов костей.
Несмотря на многообещающие результаты этих исследований, многие важные вопросы относительно Scl-Ab как фармакологического агента остаются нерешенными [3]. Например, безопасным ли будет использование Scl-Ab более 12 месяцев, принимая во внимание, что наибольшая длительность клинических исследований составила всего год? Возникнут ли новые дополнительные побочные эффекты, такие как компрессия черепно-мозговых нервов, при более длительном периоде использования Scl-Ab? Почему центральные скелетные участки (позвоночник и бедро) демонстрируют более выраженные, чем периферические (запястье) изменения [22]? Влияет ли лечение Scl-Ab на структурные параметры кости и возможность восстановления костной микроструктуры? Насколько долго будут удерживаться позитивные изменения в кости? Ответ на эти исследования планируется получить в ближайшем будущем; именно эти вопросы должны сформировать новые исследования и определять их цели.
Многие исследования посвящены также изучению роли склеростина как биомаркера костного метаболизма. Так, изучалась сывороточная концентрация склеростина в различных возрастных группах [14, 25]. Она была несколько выше у девочек в препубертатном периоде, затем наблюдалась тенденция к ее снижению у лиц обоих полов в течение пубертата. У мальчиков и юношей 12–21 года сывороточная концентрация склеростина была значительно выше, чем у девочек и девушек соответствующего возраста. Отмечена небольшая отрицательная корреляция между концентрацией склеростина и трабекулярной плотностью костей запястья, которая оценивалась с помощью количественной компьютерной томографии. Эти данные позволили предположить, что у детей склеростин играет важную роль в детерминации костной плотности и структуры.
F.S. Mirza и соавт. (2010) [24] обследовали 20 женщин в пременопаузе и 20 женщин в постменопаузе, не получавших эстрогены. Сывороточная концентрация склеростина была значительно выше у женщин в постменопаузе по сравнению с женщинами в пременопаузе (1,16±0,38 против 0,48±0,15 нг/мл; p<0,0001). Другая группа исследователей измеряла уровень склеростина в крови в популяционной выборке из 123 женщин в пременопаузе, 152 женщин в постменопаузе, не получавших эстрогены, и 318 мужчин в возрасте 21 года до 97 лет. У женщин и мужчин пожилого возраста сывороточная концентрация склеростина была повышена в среднем в 2,4 и 4,6 раз соответственно (p<0,0001). Эти данные позволили предположить, что повышение продукции склеростина остеоцитами может бать связано с возрастными изменениями костной ткани [1]. Была обнаружена положительная корреляция между сывороточной концентрацией склеростина и общей МПКТ у пожилых женщин и мужчин в отличие от женщин в пременопаузе и молодых мужчин.
Определение уровня склеростина пока еще не вошло в стандартный перечень биохимических показателей оценки состояния костной ткани, однако это может служить дополнительным маркером костного метаболизма, особенно при заболеваниях, сопровождающихся избыточным костеобразованием. Это может иметь большое значение в прогнозировании раннего и быстрого анкилозирования у больных анкилозирующим спондилоартритом. В нескольких исследованиях продемонстрирована связь между высокой активностью болезни, избыточной пролиферацией кости, оссификацией и низким уровнем сывороточного склеростина [15].
Таким образом, убедительные преклинические и клинические трайлы презентовали склеростин как многообещающую цель для создания новых анаболических агентов. Одновременно успех препаратов анаболического действия позволил по-новому взглянуть на существующую парадигму в отношении последовательности применения антиостеопоротических препаратов (рис. 2). Согласно существующей практике, а также международным рекомендациям и руководящим принципам, антирезорбтивные препараты, такие как бисфосфонаты, служат основой терапии первой линии для снижения риска переломов у пациентов с ОП. У пациентов с тяжелым ОП, для которых остается высоким риск переломов во время проведения антирезорбтивной терапии, рекомендуется применение анаболических препаратов [7]. Согласно новой предлагаемой парадигме лечения ОП, применение анаболических препаратов на ранней стадии заболевания будет способствовать повышению костной массы и поддержанию правильной микроархитектуры; после этого сохранение приобретенной костной массы возлагается на антирезорбтивные препараты. Клинические испытания, направленные на документирование эффективности и безопасности таких обратных последовательностей лечения, находятся в настоящее время на стадии реализации (NCT01575834) [19].



