Остеопороз (ОП) – хроническое системное метаболическое заболевание скелета, которое характеризуется прогрессирующим уменьшением костной массы и ухудшением качества кости, что приводит к снижению ее прочности и возрастанию риска переломов. По определению Всемирной организации здравоохранения (ВОЗ), ОП диагностируется при снижении минеральной плотности кости на 2,5 и более стандартных отклонений от пиковой костной массы (Т-критерий), по данным двухэнергетической рентгеновской абсобрциометрии (DEXA)[1].
Об актуальности проблемы ОП свидетельствует его широкое распространение: более 75 млн человек в Европе, США и Японии страдают ОП. По данным ВОЗ [2], ежегодно в мире по причине ОП происходит 8,9 млн переломов костей, а к 2025 г. ожидается их двукратное увеличение.
ОП классифицируется как первичный 1-го типа (постменопаузальный), первичный 2-го типа (сенильный), ювенильный, идиопатический и вторичный. Вторичный ОП может возникать в любом возрасте вследствие самых разных по этиологии заболеваний и одинаково часто поражает женщин и мужчин. По некоторым данным, вторичный ОП составляет 60 % случаев ОП у мужчин, 50 % – у женщин в пременопаузе и 20 % – у женщин в постменопаузе. За последние годы выполнен ряд мета-анализов, систематических обзоров и крупных проспективных когортных исследований по оценке влияния различных заболеваний на риск развития остеопоротических переломов. Среди них оценивались некоторые ревматические заболевания (РЗ): уровень доказательности А имеет, в частности, ревматоидный артрит (РА), а уровень доказательности С – такие заболевания, как системная красная волчанка (СКВ) и анкилозирующий спондилоартрит (АС) [3]. Среди причин вторичного ОП значительное место занимают лекарственные средства, в т.ч. и применяемые в ревматологии, например циклоспорин А, циклофосфамид и метотрексат. Самой частой причиной вторичного ОП (30–50 %) остается лечение глюкортикостероидами (ГКС), которое временно или постоянно получают 0,5–0,9 % населения [4].
Костная ткань представляет собой сложную, динамически изменяющуюся структуру, в которой существует определенный баланс между процессами формирования и резорбции, составляющими цикл ремоделирования кости. Этот цикл длится 90–130 дней. Резорбция остеокластами на протяжении 3 недель предшествует образованию новой кости остеобластами в течение последующих 3–4 месяцев. К важным стимуляторам остеокластогенеза относятся макрофагальный колониестимулирующий фактор (М-КСФ) и лиганд рецепторного активатора ядерного фактора κB (RANKL). Остеопротегерин (ОПГ), секретируемый остеобластами и стромальными клетками, блокирует взаимодействие RANKL с его рецептором RANK, действуя как физиологический регулятор костной резорбции. При воспалительных РЗ наиболее ярко видна роль иммунных факторов в развитии ОП.
Многие цитокины, 1,25-дигидроксивитамин D3, эстрогены, андрогены и другие молекулы влияют на продукцию RANKL и ОПГ:
- продукция RANKL снижается под действием интерлейкина (ИЛ)-1β, ИЛ-6 и фактора некроза опухоли α (ФНО-α);
- витамин D3 повышает продукцию RANKL;
- паратгормон и глюкокортикоиды повышают продукцию RANKL и угнетают продукцию ОПГ;
- эстрогены и фактор роста опухоли повышают продукцию ОПГ;
- интерферон-γ ингибирует индуцированный RANKL остеокластогенез;
- липополисахарид повышает продукцию ОПГ в фибробластах десны;
- ИЛ-7 стимулирует потерю костной массы через продукцию RANKL T-клетками;
- АТФ снижает экспрессию RANKL человеческими остеобластами;
- активированные Т-клетки продуцируют RANKL;
- лептин стимулирует RANKL [5, 6].
При РЗ, таких как РА, СКВ и АС, на возрастание риска развития ОП и переломов влияют активность болезни, ограничение подвижности и лекарственные средства. Резорбция костной ткани повышается при воспалении под влиянием таких цитокинов, как ФНО-α и ИЛ, RANKL/ОПГ и ДКК (белок Диккопфа) [7].
Механизмы развития вторичного ОП наиболее хорошо изучены при РА. Предполагают, что патогенез как периартикулярного, так и генерализованого ОП при этом заболевании и костных эрозий имеет общий механизм. Эта гипотеза подтверждается обнаружением центральной роли остеокластов, стимулированных дисбалансом в системе RANKL/RANK/ОПГ, во всех этих процессах [8]. Данные клинических исследований показали, что исходное соотношение RANKL : ОПГ у больных ранним нелеченым РА служит независимым предиктором прогрессирования повреждения суставов через 5 лет болезни [6]. Средняя частота генерализованного ОП у больных длительно текущим РА колеблется в пределах 7–26 % для шейки бедра и 19–32 % для позвоночника.
Среди общих факторов риска развития ОП при РА важную роль играют пожилой возраст, менопауза, низкая масса тела, низкая физическая активность, коррелирующая со степенью нарушения функции суставов. Непосредственно с заболеванием связаны в первую очередь активность воспалительного процесса, длительность болезни, тяжесть функциональных нарушений и прием ГКС [9]. Считается, что при длительном течении РА частота развития переломов как позвонков, так и других локализаций возрастает вдвое [7].
При СКВ наблюдается аккумуляция факторов риска развития ОП и переломов: прием ГКС, женский пол, дефицит витамина D у пациентов, избегающих солнечных лучей, почечная недостаточность, аменорея, воспалительный процесс, ограничение подвижности. Наиболее важной причиной ОП для больных СКВ является применение ГКС.
Е.Л. Насонов и соавт. (1997) [10] указывают следующие механизмы развития ОП у этих больных:
- Активность воспалительного процесса.
- Снижение функции яичников у женщин и гипогонадизм у мужчин.
- Поражение почек, вызывающее нарушение 1α-гидроксилирования витамина D.
- Развитие вторичного гиперпаратиреоза.
- Ограничение физической активности и недостаточная инсоляция.
- Лечение ГКС, гепарином, непрямыми антикоагулянтами и др.
В исследовании Bultnik и соавт. (2005) [11] деформации позвонков были обнаружены у 20 % больных СКВ, средний возраст которых составлял 41 год. За последние десятилетия продолжительность жизни пациентов с СКВ возросла на фоне лечения ГКС в сочетании с иммунодепрессантами, поэтому можно ожидать нарастания риска развития остеопоротических переломов у больных этой группы.
 При серонегативных спондилоартритах, в первую очередь АС, риск развития переломов позвонков повышен, очевидно, вследствие потери костной массы и/или увеличения ригидности позвоночника. В некоторых исследованиях показано, что при умеренной воспалительной активности АС костная плотность как позвоночника, так и шейки бедра снижена. Напротив, при высокой активности снижается лишь костная плотность шейки бедра, тогда как в позвоночнике она может быть повышена за счет синдесмофитов [10].
При серонегативных спондилоартритах, в первую очередь АС, риск развития переломов позвонков повышен, очевидно, вследствие потери костной массы и/или увеличения ригидности позвоночника. В некоторых исследованиях показано, что при умеренной воспалительной активности АС костная плотность как позвоночника, так и шейки бедра снижена. Напротив, при высокой активности снижается лишь костная плотность шейки бедра, тогда как в позвоночнике она может быть повышена за счет синдесмофитов [10].
При других РЗ, в частности васкулитах (гранулематозе Вегенера, узелковом полиартериите и гигантоклеточном артериите), в настоящее время нет статистических данных о частоте остепоротических переломов. Предполагают, что плотность кости снижается в первую очередь за счет применения ГКС. Наибольшая потеря костной массы происходит на ранней стадии болезни, вероятно, за счет как высокой воспалительной активности, так и приема высоких доз ГКС, поэтому этой категории больных особенно важно проводить обследование для выявления ОП и своевременного назначения антиостеопоротической терапии [7].
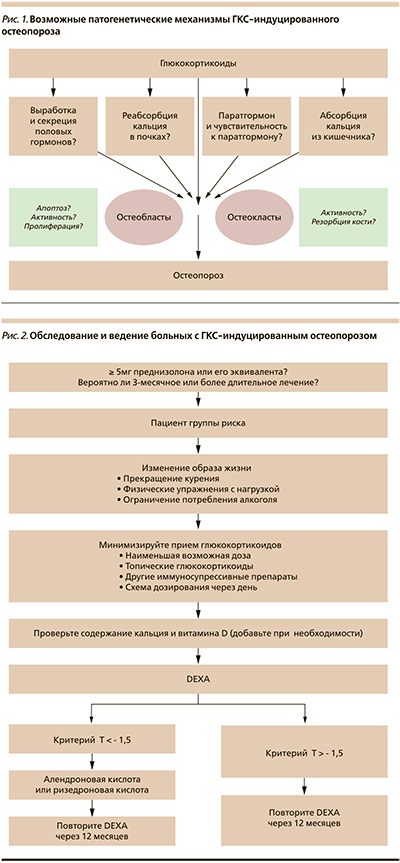
Наиболее частой причиной вторичного ОП считается прием ГКС [12]. Эпидемиологические исследования показывают, что возрастание риска остеопоротических переломов пропорционально регулярности и длительности приема ГКС, выше в первые 3 месяца терапии ГКС, ассоциировано с ускоренной потерей костной массы в течение первого года приема ГКС и, вероятно, связано даже с приемом низких доз ГКС. Патогенез ГКС-индуцированного ОП (ГКС-ОП) сложен [4, 12] и имеет две фазы. Фаза быстрой потери костной массы (до 3 % в год) характеризуется чрезмерной резорбцией, превышающей образование новой кости. Под действием ГКС снижается образование остеобластов и до 3 раз повышается их апоптоз. В то же время повышается активность остеокластов, отчасти за счет снижения концентрации ОПГ. ОПГ действует как растворимый рецептор для RANKL, а сниженная активность этого белка увеличивает взаимодействие между RANKL и его рецептором RANK, что приводит к активации пути с участием NF-κB. Другие механизмы включают сниженную экспрессию морфогенетических белков костной ткани и дифференцировку клеток – предшественников костного мозга в сторону адипоцитов [13].
Действие ГКС на костную ткань осуществляется путем прямого влияния на ее формирование и резорбцию, через воздействие на метаболизм кости и через половые гормоны (рис. 1). Кроме того, риск переломов возрастает и вследствие ГКС-индуцированного снижения мышечной силы, приводящего к падениям. ГКС снижают пролиферацию и функцию остеобластов путем воздействия на инсулиноподобный фактор роста (ИФР-1, ИФР-2) и фактор роста фибробластов (TGF-β1 – basic fibroblast growth factor), вызывают апоптоз остеоцитов (что может играть роль в развитии остеонекроза). ГКС могут вызывать отрицательный кальциевый баланс, уменьшая как всасывание кальция в кишечнике, так и реабсорбцию почками. Единого мнения об их молекулярном влиянии на витамин D нет, поскольку данные исследований на животных и человеке различны. ГКС могут также снижать продукцию половых гормонов, что приводит к усилению костной резорбции.
У пациентов, получающих ГКС, отмечена атрофия мышечных волокон 2-го типа и уменьшение количества волокон 1-го типа [14].
ОП отмечают у 30–50 % пациентов, системно получающих ГКС [4]. Потеря минеральной плотности кости (МПК) может достигать 10–12 % в год, а в течение первых 3 месяцев лечения риск переломов у таких больных возрастает в 2 раза по сравнению с популяцией. Установлено, что ГКС-индуцированные переломы возникают при более высоких, чем при первичном ОП, значениях МПК. У женщин в постменопаузе, принимающих ГКС, риск переломов выше. Он увеличивается при повышении дозы ГКС. Наиболее высокий риск имеют больные, принимающие ГКС в суточной дозе 7,5 мг и выше (уровень доказательности А), но и при приеме более низких доз ГКС снижается МПК и увеличивается риск переломов [14].
В то же время после прекращения приема ГКС скорость снижения МПК нормализуется. Все это диктует необходимость проведения профилактики ОП больным, получающим ГКС в любой дозе более 3 месяцев.
Профилактика вторичного и ГКС-ОП направлена в первую очередь на рациональное лечение основного заболевания, предотвращение потери костной массы и переломов. При этом следует также стараться исключить все другие факторы риска развития ОП (рис. 2).
Рациональное лечение любого из РЗ направлено на снижение воспалительной активности, предотвращение структурных повреждений, сохранение функции суставов и внутренних органов. Применяемые в лечении этих заболеваний ГКС обладают мощным противовоспалительным действием. Некоторые исследователи считают, что раннее назначение ГКС в малых дозах, в частности, в качестве «бридж»-терапии при РА может преду-преждать развитие костных эрозий. Однако применение даже малых доз ГКС в течение нескольких месяцев приводит к быстрой потере костной массы. Поэтому целесообразно стремиться назначать минимально эффективные терапевтические дозы ГКС, при возможности снижать их до полной отмены, использовать препараты для местного лечения, комбинации ГКС с цитостатиками или другими базисными препаратами (больными РА).
Согласно рекомендациям, принятым в Великобритании, начинать лечение ОП следует всем мужчинам и женщинам старше 65 лет одновременно с назначением ГКС, пациентам, имевшим переломы в анамнезе, и молодым пациентам с Т-критерием ≤ -1,5, которым предполагается назначение ГКС перорально, по крайней мере на 3 месяца [15].
Российские рекомендации по профилактике и лечению ГКС-индуцированного ОП (с указанием уровня доказательности) 2010 г. состоят в следующем [16]:
Для предупреждения потери МПК необходимо использование минимальных эффективных терапевтических доз ГКС, снижение дозы системных ГКС на фоне применения препаратов для местного лечения (А). Пациентам, принимающим ГК, рекомендуются сбалансированная диета с достаточным потреблением кальция, адекватная физическая нагрузка, исключение курения и алкоголя. Необходимы оценка риска падений и соблюдение рекомендаций по профилактике падений лицами, которые им подвержены (С).
Отклонение от пика костной массы (Т-критерий) на -1,5 и менее у пациентов, принимающих системные ГКС, что является основанием к назначению лечения (В).
Больным в возрасте 65 лет и старше, принимающим системные ГКС, а также пациентам, имеющим переломы в анамнезе, лечение ОП должно быть назначено одновременно с назначением терапии ГКС на длительный срок (А).
При назначении ГКС в любой дозе на срок более 3 месяцев одновременно необходимо рекомендовать проведение профилактических мероприятий (А).
Комбинация кальция и витамина D должна назначаться всем больным, начавшим прием системных ГКС. Доза витамина D для взрослых составляет 800 МЕ/сут, а элементарного кальция – 1000–1500 мг/сут, включая питание. Для больных, длительно принимающих ГКС, препараты витамина D и кальция должны быть обязательным компонентом любой схемы лечения ОП, однако не могут быть использованы в качестве монотерапии при вторичной профилактике и лечении.
Алендронат (5–10 мг/сут) – препарат первой линии для профилактики и лечения ГКС-ОП (А).
Инъекционная или назальная форма кальцитонина может быть использована в профилактике и лечении ГКС-ОП в постоянном (В) или интермиттирующем режиме (Д), однако он не может быть препаратом выбора из-за отсутствия данных о влиянии на риск переломов.
В качестве лечения ГКС-ОП может использоваться альфакальцидол (А).
Следует иметь в виду, что эффективность различных препаратов для лечения ОП ниже при ГКС-ОП, чем при постменопаузальном ОП, перечень зарегистрированных для этого показания препаратов меньше. Снижение риска переломов при ГКС-ОП доказано только для бисфосфонатов, доказательства о влиянии какого-либо препарата на снижение риска невертебральных переломов и предотвращение риска переломов бедра отсутствуют.
В 2006 г. с целью лечения ГКС-ОП был зарегистрирован препарат паратиреоидного гормона (терипаратид), эффективность которого для преду-преждения переломов выше, чем у алендроната [17, 18], однако его высокая стоимость служит ограничением для широкого применения. В настоящее время он используется в качестве лечения тяжелого ГКС-ОП. Согласно рекомендациям Американской Ассоциации эндокринологов, терипаратид показан при очень высоком риске переломов или при неэффективности лечения бисфосфонатами [19].
Еще одним новым препаратом для лечения ОП, зарегистрированным в России в 2011 г., является деносумаб – гуманизированное моноклональное антитело, избирательно связывающееся с RANKL и имитирующее действие ОПГ [20]. В клинических исследованиях доказана его способность снижать риск переломов тел позвонков на 68 %, внепозвоночных переломов – на 20 %, а переломов шейки бедра – на 40 %.
К преимуществам этого препарата относятся способ и кратность введения – подкожно 2 раза в год. Деносумаб обладает низкой иммуногенностью. Поскольку избыточная активность RANKL является основным фактором потери костной массы больными аутоиммунными и воспалительными заболеваниями, он может служить препаратом первого ряда для лечения ОП при РЗ [21]. И хотя ГКС-ОП пока не зарегистрирован в качестве показания к его назначению, применение деносумаба такими больными представляется весьма перспективным.
Среди новых потенциальных препаратов для лечения ОП разрабатываются ингибиторы катепсина К, глюкагоноподобный пептид 2, антитела к склеростину и ДКК, обладающие анаболическим действием; модуляторы малых молекул, воздействующие на чувствительные к кальцию рецепторы [18].
Успешное лечение вторичного ОП при РЗ зависит от рационального лечения основного заболевания, выявления всех факторов риска развития и диагностики потери костной массы уже в начале болезни, а также своевременного назначения антиостеопоротических препаратов с последующим мониторированием динамики костной массы.



