История развития гормональной контрацепции (ГК) начинается с 1950-х гг. – с создания препаратов, содержащих синтетические аналоги гестагенов [1]. Их контрацептивные возможности были открыты при использовании на животных норэтинодрела. Норэтинодрел (синтетическое производное тестостерона) вызывал стойкое подавление овуляции за счет угнетения секреции гормонов гипоталамо-гипофизарно-яичниковой системы, что предупреждало наступление нежелательной беременности [2]. В дальнейшем было показано, что добавление к прогестагену эстрогенного компонента улучшает регуляцию менструального цикла и потенцирует его антигонадотропное действие [3].
Первые гормональные контрацептивы содержали значительно бо'льшие дозы синтетических стероидов по сравнению с современными препаратами, что у многих женщин сопровождалось побочными эффектами. Наиболее часто они проявлялись тошнотой, головной болью, депрессией, болезненностью молочных желез, прибавкой массы тела и появлением акне. Кроме того, среди женщин, использовавших гормональные контрацептивы, увеличилось число случаев артериальных и венозных тромбозов [4, 5].
За 50 лет произошла значительная эволюция ГК: появились низко- и микродозированные препараты, созданы контрацептивы с компонентами, максимально приближенными к эндогенным гормонам, разработаны новые режимы и пути их введения. Все это привело к значительному уменьшению частоты нежелательных побочных эффектов и существенно повысило приверженность женщин к использованию ГК [1, 4, 6]. Результаты масштабных эпидемиологических исследований доказали, что современные низкодозированные гормональные контрацептивы не оказывают клинически значимого влияния на различные параметры гомеостаза и служат безопасным методом предохранения от нежелательной беременности среди здоровых некурящих женщин моложе 40 лет [6–9].
Механизм действия гормональных контрацептивов заключается в подавлении функции гипоталамо-гипофизарно-яичниковой системы. Под влиянием синтетических стероидов предотвращаются пиковые колебания концентрации эндогенных гормонов в течение менструального цикла – гонадотропин-рилизинг гормона, фолликулостимулирующего, лютеинизирующего гормонов, прогестерона и эстрадиола. В результате блокируется созревание яйцеклетки в яичнике, подавляются рост доминантного фолликула и его последующая овуляция. Кроме того, под действием гормональных контрацептивов не происходит циклических изменений эндометрия – пролиферации, секреторной трансформации и отторжения, его толщина остается относительно постоянной на протяжении всего периода их использования.
Эстрогенный и гестагенный компоненты в составе гормональных контрацептивов выполняют разные функции. Так, прогестагенный компонент обеспечивает непосредственную защиту от нежелательной беременности. Связываясь в матке с прогестероновыми рецепторами, он по механизму отрицательной обратной связи подавляет секрецию лютеинизирующего гормона в передней доле гипофиза и предотвращает овуляцию. К дополнительным контрацептивным эффектам прогестагенов относятся повышение вязкости цервикальной слизи, препятствующее транспорту спермы, и атрофические изменения эндометрия, обеспечивающие защиту от имплантации.
Эстрогенный компонент потенцирует контрацептивный эффект прогестагена. Взаимодействуя с эстрогеновыми рецепторами в матке по механизму обратной связи, он блокирует выброс фолликулостимулирующего гормона из передней доли гипофиза и предотвращает развитие доминантного фолликула. Но основная функция эстрогеновой составляющей заключается в стабилизации эндометрия и обеспечении контроля менструального цикла [10].
Гормональные контрацептивы не приводят к полному блокированию функции гипоталамо-гипофизарно-яичниковой системы и поэтому не вызывают симптомов эстрогендефицита. Напротив, их применение оказывает стабилизирующее влияние на синтез эндогенных гормонов в течение менструального цикла, пиковые колебания уровня которых могут являться триггерами развития гиперпластических процессов эндометрия, эндометриоидных и фиброматозных гетеропий. Кроме того, предотвращая овуляцию, синтетические стероиды обеспечивают сохранность фолликулярного аппарата яичников [10, 11].
В настоящее время к методам ГК относятся комбинированные средства, содержащие в своем составе эстрогены и гестагены, и чистопрогестагенные средства, содержащие только гестаген. Эстрогенный компонент в большинстве комбинированных препаратов представлен этинилэстрадиолом. Это синтетический эстроген, по структуре сходный с эндогенным эстрадиолом, но отличный от него по метаболизму и биологической активности [10].
Метаболизм эндогенного эстрадиола происходит в печени, где он превращается в низкоактивный эстрон (E1) и неактивный эстрона сульфат (E1S). Оставшийся в небольшом количестве эстрадиол поступает в циркулирующую кровь и связывается там с сывороточными белками: альбумином и глобулином, связывающими половые стероиды (ГСПС). Эстрадиол, связанный с ГСПС, транспортируется к тканям-мишеням, а связанный с альбумином (около 5% от исходного) остается биологически активным.
В отличие от эндогенного эстрадиола синтетический этинилэстрадиол за счет наличия у него дополнительной 17α-этинильной группы подвергается длительной рециркуляции в печени: деконъюгируется в желудочно-кишечном тракте, экскретируется в желчь, реабсорбируется в кровь и вновь возвращается в печень в активной форме. В результате происходит длительное взаимодействие этинилэстрадиола с печеночными ферментами, проявляющееся в сотни раз более выраженным влиянием на системные параметры по сравнению с эндогенным эстрадиолом. Поступая в кровь, этинилэстрадиол не образует комплексы с ГСПС, а практически полностью связывается с альбумином плазмы. В результате биодоступность этинилэстрадиола составляет около 45% от исходной, что в несколько раз превышает биодоступность эндогенного эстрадиола [10, 12].
С особенностями метаболизма этинилэстрадиола (длительное взаимодействие с печеночными ферментами, наличие активного синтетического эстрогена в сыворотке крови) связано развитие таких нежелательных побочных эффектов, как тошнота, головная боль, болезненность молочных желез, прибавка массы тела, появление акне, негативное влияние на свертывающую систему крови, уровень холестерина и инсулинорезистентность [10, 12].
Особенно выраженные эстрогензависимые побочные эффекты имели первые контрацептивные средства, содержащие 150 мкг этинилэстрадиола. С переходом на использование препаратов, содержащих в своем составе менее 40 мкг этинилэстрадиола, их переносимость значительно улучшилась [1, 4] и более чем в два раза снизилась частота развития тромбофилических осложнений [13]. Минимальное количество этинилэстрадиола, содержащегося в контрацептиве, составляет 15–20 мкг в сутки, т.к. дальнейшее снижение дозы нецелесообразно в связи с ухудшением контроля цикла [1, 4, 6].
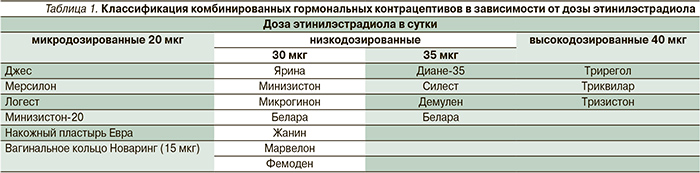
В зависимости от поступающей в организм суточной дозы этинилэстрадиола гормональные контрацептивы подразделяют на:
- высокодозированные (40 мкг этинилэстрадиола в сутки);
- низкодозированные (30–35 мкг эитинилэстрадиола в сутки);
- микродозированные (15–20 мкг этинилэстрадиола в сутки) (табл. 1).
За последние годы были созданы контрацептивы с иными синтетическими эстрогенами: эстрадиола валератом и 17β-эстрадиолом. Эстрадиола валерат по своей структуре приближен к натуральному эстрогену, однако наличие остатка валериановой кислоты несколько изменяет его метаболизм. После приема внутрь он расщепляется на эстрадиол и валериановую кислоту. Валериановая кислота быстро метаболизируется, а эстрадиол в ходе всасывания в слизистой оболочке желудочно-кишечного тракта и первого пассажа через печень расщепляется на малоактивные метаболиты — эстрон, эстрона сульфат и эстрона глюкуронид [14].
17β-эстрадиол имеет такую же структуру, что и эндогенный эстрадиол, поэтому метаболизируются они в организме одинаково. Это означает, что после приема внутрь 17β-эстрадиол подвергается метаболизму уже при первом прохождении через печень и затем почти наполовину связывается в крови с ГСПС.
Биодоступность 17β-эстрадиола и эстрадиола валерата составляет 3–5%, что эквивалентно эндогенному эстрадиолу и обеспечивает клинически незначимое влияние на метаболические параметры в организме и низкую частоту развития побочных эффектов [10, 12, 15].
17β-эстрадиол и эстрадиола валерат уже длительное время используются в составе заместительной гормональной терапии женщин в климактерии, но попытки создать контрацептивные средства на их основе не приводили к успеху. Основная проблема – в неадекватном контроле за циклом при их монофазном приеме [4]. В результате для эстрадиола валерата был найден оптимальный 4-фазный режим применения в сочетании с производным тестостерона диеногестом, а для 17β-эстрадиола оказалось эффективным сочетание с производным прогестерона – номегестрола ацетатом. Это позволило создать два новых гормональных контрацептива с высокой степенью надежности предохранения от нежелательной беременности и содержащих эстрогеновый компонент, близкий по своим свойствам к эндогенному эстрадиолу, имеющий минимальное число системных побочных эффектов наряду с надежным контролем цикла [14–19].
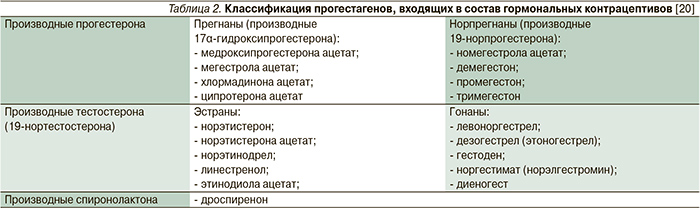
В отличие от почти постоянной эстрогенной составляющей прогестагенный компонент представлен в гормональных контрацептивах рядом синтетических производных прогестерона, тестостерона и спиронолактона (табл. 2) [20, 21].
К производным прогестерона относятся прегнаны (производные 17α-гидроксипрогестерона) – медроксипрогестерона ацетат, мегестрола ацетат, хлормадинона ацетат, ципротерона ацетат и норпрегнаны (производные 19-норпрогестерона) – номегестрола ацетат, демегестон, промегестон и тримегестон. Производные тестостерона или 19-нортестостерона также подразделяются на 2 группы: эстраны – норэтистерон, норэтинодрел, линестренол и гонаны – норгестрел, левоноргестрел, дезогестерл, этоногестрел, гестоден и норгестимат. За последние годы было создано два гибридных прогестагена: производное тестостерона – диеногест и производное спиронолактона – дроспиренон.
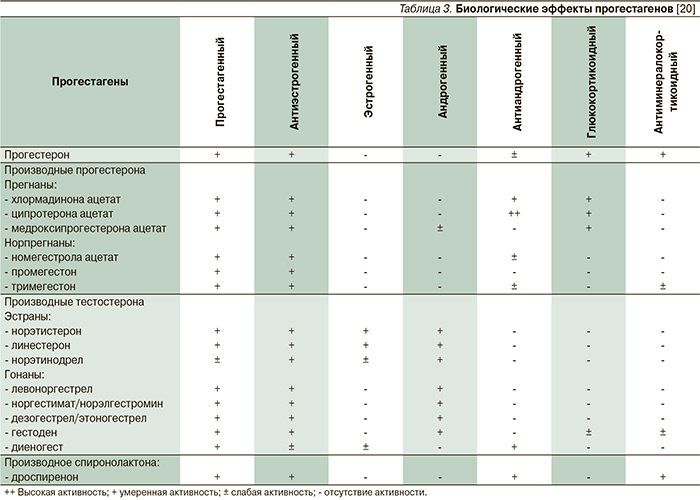
Все синтетические прогестагены, входящие в состав современных гормональных контрацептивов, обладают выраженным антигонадотропным действием, надежно подавляют овуляцию, обеспечивая высокий контрацептивный эффект, и блокируют эстрогенное влияние на эндометрий, предотвращая его пролиферацию. Однако они имеют различия по другим биологическим эффектам, в зависимости от которых гормональные контрацептивы приобретают дополнительные свойства (табл. 3). Синтетические прогестагены в большей или меньшей степени взаимодействуют в организме не только с прогестероновыми рецепторами, но и с рецепторами других стероидов: эстрогенов, андрогенов, глюкокортикоидов и минералокортикоидов.
Идеальный прогестаген в составе гормональных контрацептивов не должен обладать иной активностью, кроме прогестагенной. На сегодняшний день самым высокоселективным является производное 19-норпрогестерона – номегестрола ацетат. Он обладает только необходимыми для предохранения от беременности антигонадотропными свойствами и не имеет других клинически значимых эффектов [15, 22, 23].
Производные прогестерона – прегнаны (производные 17α-гидроксипрогестерона) – не являются высокоселективными стероидами: кроме антигонадотропного они оказывают антиандрогенное и глюкокортикоидное воздействия. Глюкокортикоидный эффект нежелателен для синтетических прогестагенов в составе гормональных контрацептивов, т.к. обусловливает негативное влияние на массу тела женщины и минеральную плотность костной ткани. В то время как дополнительное антиандрогенное действие широко используется в лечебных целях женщинами с проявлениями гиперандрогении. Антиандрогенные эффекты максимально выражены у ципротерона ацетата, умеренно – у хлормадинона ацетата и отсутствуют у медроксипрогестерона ацетата [20, 21].

Наиболее многочисленную группу синтетических прогестагенов в составе гормональных контрацептивов представляют производные тестостерона. Ранние их представители – эстраны, к которым относятся норэтистерон, линестренон и норэтинодрел, обладают добавочными эстрогенными и андрогенными свойствами. С андрогенной активностью связывают появление акне, гирсутизм, задержку жидкости в организме, изменение липидного спектра крови в сторону увеличения липопротеидов низкой плотности. Дополнительное эстрогенное действие усиливает проявление эстрогензависимых побочных эффектов у контрацептивов, содержащих этинилэстрадиол в своем составе.
Следующие производные тестостерона – гонаны (левоноргестрел, дезогестрел, гестоден и норгестимат), в отличие от эстранов не потенцируют эстрогенный эффект и оказывают гораздо меньшее андрогенное влияние, которое у большинства женщин клинически не проявляется. Левоноргестрел – наиболее изученный из всех синтетических прогестинов. Его свойства и особенности влияния в организме доказаны многочисленными исследования, поэтому он используется как эталонный препарат для сравнительной оценки эффективности и безопасности всех гормональных средств.
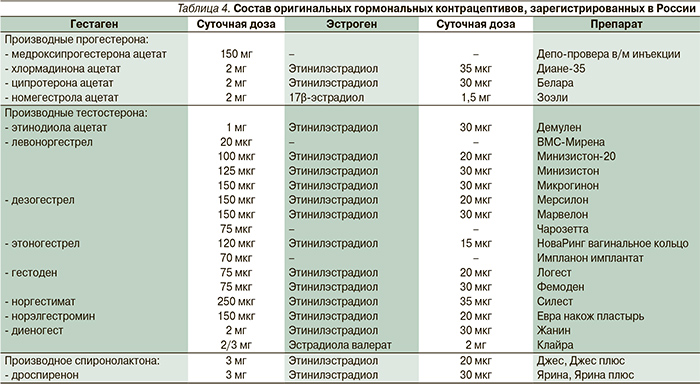
Диеногест, также относящий к производным тестостерона, обладает свойствами не только гонанов, но и прогестерона, что обусловливает у него наличие антиандрогенного действия в отличие от левоноргестрела, дезогестрела, гестодена и норгестимата, имеющих незначительный андрогенный потенциал [20, 21]. Еще один гибридный гестаген – дроспиренон, является производным спиронолактона. Он объединяет эффекты прогестерона (антигонадотропный и антиандрогенный) со свойствами антиминералокортикоидов, которые клинически выражаются в уменьшении задержки жидкости и натрия в организме. Сочетание антиандрогенного и антидиуретического действий положительным образом влияет на здоровье женщин с синдромом поликистозных яичников, предменструальным синдромом, а также доброкачественными заболеваниями молочных желез. В последние годы появились дроспиренон-содержащие комбинированные препараты с добавлением 400 мкг фолатов, позволяющие избегать возможного возникновения дефицита фолиевой кислоты при длительном приеме комбинированных гормональных контрацептивов. Состав оригинальных гормональных контрацептивов, зарегистрированных в России, представлен в табл. 4.
Традиционно гормональные контрацептивы принимаются по 1 таблетке в течение 21 дня с последующим 7-дневным перерывом, во время которого происходит менструально подобная реакция. Одним из путей эволюции ГК стало создание новых режимов с укороченным перерывом между приемами препарата. Было доказано, что при применении 24 активных таблеток, содержащих этинилэстрадиол/дроспиренон или 17β-эстрадиол/номегестрола ацетат, в монофазном режиме и таблеток плацебо в последующие 4 дня значительно уменьшаются объем кровопотери и частота межменструальных кровотечений. Аналогичные данные получены для режима 26+2, который имеет пероральный контрацептив, содержащий эстрадиола валерат и диеногест [18, 24, 25].
За последние годы контрацептивы стали назначать в лечебных целях с более длительными периодами без менструальноподобного маточного кровотечения. Это обеспечивается непрерывным приемом 2–3–4 упаковок препарата подряд с последующим 7-дневным перерывом: режимы 42+7, 63+7, 84+7 [26]. В 2012 г. были опубликованы результаты рандомизированного многоцентрового исследования, которые продемонстрировали безопасность еще более длительного непрерывного (в течение 5 месяцев) приема комбинированных гормональных контрацептивов с одним перерывом на менструальноподобное кровотечение [27]. Одним из распространенных ошибочных убеждений считается следующее: менструации необходимы для профилактики злокачественных заболеваний эндометрия. Однако известно, что при менструальном кровотечении удаляется только верхний функциональный слой эндометрия, а более глубокий – базальный, из которого развивается большинство опухолей, не затрагивается.
По данным социологических исследований, наиболее популярными среди пользователей ГК остаются пролонгированные методы [28–30].
К ним относятся обратимые контрацептивы пролонгированного действия – Long-Acting Reversible Contraceptives (LARC), которые необходимо принимать реже одного раз в месяц или за один цикл, и обратимые контрацептивы короткого действия – Short-Acting Reversible Contraceptives (SARC), назначаемые еженедельно или ежемесячно. Все они не имеют пероральных форм, а вводятся трансдермально, подкожно, внутримышечно, внутриматочно или интравагинально. К LARC относятся внутримышечные инъекции Депо-провера, внутриматочная гормональная система Мирена и подкожные имплантаты Импланон и Импланон НКСТ. SARC составляют вагинальное кольцо НоваРинг и накожный пластырь Евра.
Среди пролонгированных методов выделяют комбинированные эстроген-гестагенные средства и чистопрогестагенные (табл. 5). К комбинированным контрацептивам пролонгированного действия относят вагинальное кольцо и накожный пластырь. Чистопрогестагенные методы – это внутримышечные и подкожные инъекции, внутриматочная гормональная система и подкожные имплантаты.
Все пролонгированные контрацептивы являются гормональными рилизинг-системами и имеют ряд преимуществ перед ежедневными пероральными средствами. При применении гормональных рилизинг-систем обеспечиваются стабильное выделение малых доз гормонов по биологическому градиенту, длительная контрацепция, точность дозирования, отсутствие суточных колебаний экскреции гормонов, отсутствие необходимости ежедневного самоконтроля, отсутствие эффекта первого прохождения препарата через печень, отсутствие желудочно-кишечного взаимодействия с другими лекарственными средствами [31].
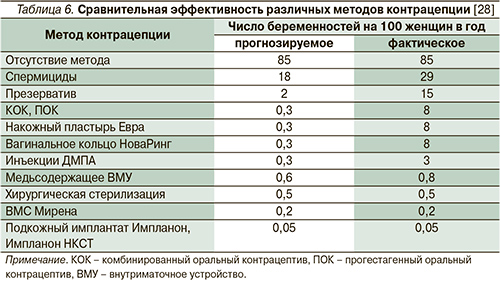
Для оценки эффективности методов предохранения от беременности используется индекс Перля, показывающий количество беременностей, наступивших у 100 женщин в течение года использования определенного вида контрацепции. Существует понятие эффективности метода при правильном использовании, отражающим, насколько он эффективен при точном соблюдении инструкции по применению, и фактическом, учитывающим непостоянное или неправильное использование (табл. 6). При правильном использовании методов ГК индекс Перля всегда составляет меньше 1, но при фактическом – он значительно отличается и доходит до 8 [9]. Причиной такого расхождения, по данным социологических исследований, служит нарушение режима использования метода (пропуск приема таблеток или очередной инъекции, нерегулярная замена вагинального кольца или пластыря) со стороны 70% женщин [32]. Наиболее эффективные методы, не зависящие от организованности пользователя: внутриматочная рилизинг-система с левоноргестрелом, устанавливаемая на 5 лет; и подкожные имплантаты с этоногестрелом, действующие в течение 3 лет. Индексы Перля при их прогнозируемом и фактическом использовании одинаковы и составляют 0,2 и 0,05 соответственно [28, 31, 33].
Таким образом, ГК продолжает совершенствоваться и становится все более популярной среди женщин репродуктивного возраста. На сегодняшний день гормональные контрацептивы, содержащие синтетические аналоги половых стероидов, во всем мире считаются самыми эффективными и популярными методами предохранения от нежелательной беременности [6, 34].



