Введение
Мальдигестия (абсолютный дефицит секреции панкреатических ферментов) является типичным исходом хронического панкреатита (ХП) любой этиологии с длительным анамнезом, постнекротического острого панкреатита, состояний после резекции поджелудочной железы (ПЖ) или панкреатэктомии [9]. Традиционно считается, что экзокринная недостаточность ПЖ (ЭНПЖ) больных ХП может сопровождаться стеатореей, мальнутрицией [13], а также снижением качества жизни [2]. С учетом ключевой роли ПЖ в пищеварительно-транспортном конвейере разумно предполагать, что наличие ЭНПЖ не может не сказываться на обмене веществ пациента ввиду нарушения нормального переваривания и всасывания нутриентов, прогрессирующего дефицита макро- и микронутриентов и часто сопутствующего сахарного диабета [10, 39, 58]. К настоящему времени можно смело утверждать, что развитие дефицита питательных веществ и нутритивной недостаточности является недооцененно частым явлением при ХП, что в некоторой степени объясняется довольно сложной патофизиологией мальнутриции при этом заболевании, включая помимо мальдигестии и сахарного диабета разнообразные ограничения в питании, особенно при постпрандиальном усилении боли, специфику рациона питания, обусловленную хроническим алкоголизмом, и многое другое [39, 58, 64], о чем в контексте микронутриентного статуса будет подробно сказано в этой с татье.
Дефиниция трофологической недостаточности
Трофологическая (нутритивная, белково-энергетическая) недостаточность, или мальнутриция, – это синдром, характеризующийся дисбалансом между потребностями организма и поступлением питательных веществ, что наблюдается при недостаточном потреблении их с пищей, нарушении утилизации в организме, избыточной потере или расходе, а также при комбинации указанных выше причин [8, 10]. Значение этого синдрома в клинической практике в первую очередь обусловлено низкой толерантностью макроорганизма к повреждению и стрессу в условиях мальнутриции, примером которых может служить хирурическое вмешательство или хроническая патология.
Современное состояние проблемы оценки нутритивного статуса заключается в невозможности полноценного определения состояния питания ни одним из существующих тестов в отдельности; надлежащие выводы делаются только на основании комплексного учета антропометрических, инструментальных и лабораторных данных, а также особенностей анамнеза и результатов физикального обследования [10]. Базисную оценку нутритивного статуса необходимо проводить не позднее 48 часов с момента поступления больного в стационар и повторять в дальнейшем каждые 10 дней [1]. Однако применительно к больным ХП данное требование клиницистами амбулаторного звена и стационарной помощи в России, к сожалению, пока не выполняется. Об этом говорят результаты наших предшествующих исследований о незначительном внимании к оценке нутритивного статуса больных ХП [7]. При этом уже около десятилетия на русском языке видят свет публикации преимущественно нашей научной группы [6–8, 10] при единичных работах, проведенных в других учреждениях [3, 11, 12], каждая из которых прямо или косвенно говорит о важнейшем значении статуса питания для больных ХП.
Необходимо выделить две важнейшие для клинициста формы мальнутриции – манифестную (клиническую) или субклиническую. Во втором случае никаких очевидных симптомов дефицита микронутриентов, похудания, дефицита массы тела регистрироваться не будет. Можно полагать, что большинство пациентов с ХП характеризуются именно субклинической мальнутрицией. Клиницисту важно помнить, что за счет мобилизации эндогенных резервов с последующим постепенным истощением депо период компенсации дефицита питательных веществ при различной патологии человека может занимать многие месяцы и даже годы [8], в течение которых очевидных клинических признаков мальнутриции можно и не обнаружить. В связи с этим становится понятно, почему поиску серологических маркеров мальнутриции, особенно при ХП, в последнее время уделяется большое внимание [23, 26, 41, 59, 62].
Дефицит микронутриентов
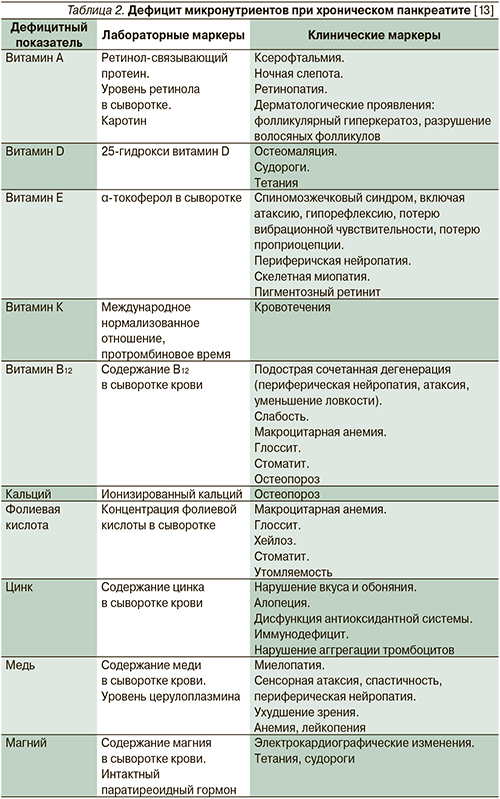
Имеются множественные сообщения о развитии дефицита всех жирорастворимых витаминов, а также кальция, магния, тиамина, фолиевой кислоты и др. у больных ХП (табл. 1). Однако функциональное значение дефицита ряда нутриентов до сих пор не определено [28]. В табл. 2 представлены лабораторные и клинические маркеры дефицита различных микронутриентов, встречающегося при ХП.
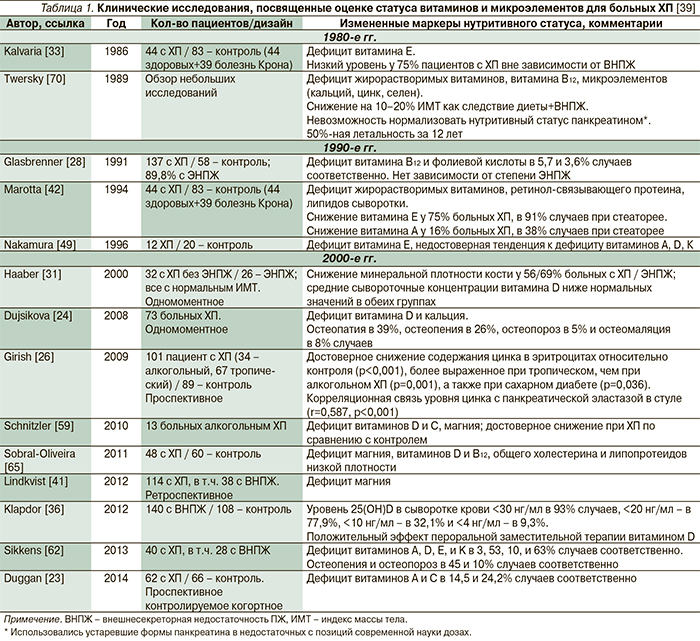
Дефицит жирорастворимых витаминов (А, D, E, K) коррелирует с тяжестью стеатореи у больных ХП, но может быть обусловлен и другими помимо мальабсорции жира и витаминов механизмами, включая сокращение жира в рационе питания, повышенную потребность в антиоксидантах при хроническом воспалении. Ранее считалось, что чаще отмечается дефицит витамина E относительно витаминов А, D, и K [24, 33]. Однако в недавнем проспективном исследовании, включившем 40 пациентов с ХП, было показано, что наиболее часто встречался дефицит витамина K – в 63% случаев, дефицит витаминов D, Е и А, напротив, был зарегистрирован реже: в 53, 10 и 3% случаев соответственно [62].
Метаболическая патология костной ткани – общее последствие различных заболеваний желудочно-кишечного тракта, включая ХП [13]. Мальабсорбция кальция и витамина D3, а также сопутствующие курение и употребление алкоголя могут определять снижение плотности костной ткани и увеличивать риск переломов [24, 68]. Что интересно: особенности патофизиологии ХП, по всей видимости, определяют более выраженный, чем при болезни Крона и целиакии [68], дефицит витамина D, что подтверждается результатами двух недавних европейских исследований [15, 22]. Это крайне важно в связи с тем, что за последние годы значение витамина D все больше рассматривается в контексте не только патологии опорно-двигательной системы, а значительно шире – при сердечно-сосудистых, опухолевых и аутоиммунных заболеваниях, сахарном диебете и в связи с общей летальностью [36, 50], однако систематизация данных в мета-анализы пока характеризуется неоднозначностью фактов [17].
В недавно опубликованном датском исследовании отношение рисков (HR) для переломов костей любой локализации у больных ХП составило 1,7 (95% ДИ: 1,6–1,8) [15]. Остеопатия (остеопороз, остеомаляция, остеопения) может наблюдаться по крайней мере у 25% пациентов с ХП [24]. По результатам недавно опубликованного исследования E.C. Sikkens и соавт. (2013), остеопения и остеопороз наблюдались у 45 и 10% пациентов с ХП соответственно [62]. Неудивительно, почему множественные факты, свидетельствующие о возможности дефицита витамина D у больных ХП и при его последствиях, легли в основу рекомендаций проведения динамической денситометрии костной ткани при ХП [4].
Витамины группы В и фолиевая кислота. Дефицит панкреатических протеаз может определять дефицит витамина B12 у некоторых больных ХП, хотя в клинических исследованиях дефицит витамина В12 и фолиевой кислоты встречается редко – в 5,7 и 3,6% случаев соответственно [28]. Витамин B12 в желудке образует комплекс с внутренним фактором Кастла (гаптокоррин, или R-белок) и всасывается в терминальном отделе подвздошной кишки. Гаптокоррин в норме расщепляется в тонкой кишке под действием панкреатических протеаз, высвобождая таким образом водорастворимый витамин B12, который всасывается в подвздошной, слепой и восходящей ободочной кишке [5]. Для пациентов с недостаточностью функции ПЖ (дефицитом протеаз) витамин B12 может оставаться связанным к гаптокоррином, не всасываясь в терминальном отделе подвздошной кишки [28]. Пациенты, продолжающие злоупотреблять алкоголем и имеющие сочетанный с ХП алкогольный цирроз, характеризующиеся отсутствием депо витамина B12 в печени, также подвержены риску развития тиаминовой (витамин B1), рибофлавиновой (витамин В2) и пиридоксиновой (витамин B6) недостаточности [5].
Цинк. Об интенсивном обмене цинка в ПЖ было сообщено еще в середине прошлого века [61]. Эндогенный цинк, как будет доказано позже, экскретируется ацинусами ПЖ [47]. Кроме этого ацинарные клетки ПЖ, по всей видимости, характеризуются более интенсивным обменом цинка (65Zn) по сравнению с островковыми клетками [46]. К началу 1990-х гг. были объяснены причины высоких концентраций цинка в панкреатическом секрете. Оказалось, что этот микроэлемент является ко-ферментом металлопротеиназ, таких как карбоксипептидазы и карбоксиангидразы, в связи с чем даже предполагалось, что ПЖ играет главную роль в гомеостазе цинка [44].
В то же время дефицит цинка определенно влияет на функцию ПЖ [26]. Ультраструктурные исследования ацинарных клеток ПЖ у крыс, получавших дефицитную по цинку диету, показали деструкцию зимогенных гранул и лизосом. Полученные данные позволили авторам утверждать, что цинк играет роль в поддержании структурной целостности ацинарных клеток ПЖ [38]. Интересно, что в другом экспериментальном исследовании у крыс, получавших крайне дефицитный по цинку рацион питания, были выявлены морфологические и функциональные повреждения ПЖ, подобные индуцированным этанолом [54]. С учетом того что у лиц, страдающих алкоголизмом, отмечается низкое потребление цинка [43], его дефицит может играть дополнительную роль в опосредованном этанолом повреждении ПЖ. Кроме того, в эксперименте с достижением тканевого дефицита цинка в паренхиме ПЖ отмечена увеличенная активность пропилгидроксилазы – фермента, принимающего участие в синтезе коллагена. Эти данные позволяют предполагать, что дефицит цинка в ПЖ может быть связан с депонированием коллагена и развитием фиброза ПЖ [51].
Дефицит цинка у человека, страдающего ХП, доказан многими исследованиями [14, 21, 26]. Особенно важны результаты недавней работы, оценивавшей содержание цинка не только в крови, но и в резецированной ткани ПЖ у пациентов с кальцифицирующим и некальцифицирующим ХП. Авторами было доказано, что дефицит цинка может определять развитие кальцинатов в ПЖ [14].
J.E. Dominguez-Munoz и соавт. при оценке уровня секреции цинка ПЖ в качестве функционального теста для больных ХП обнаружили высокую чувствительность и специфичность диагностики ЭНПЖ – 97 и 91% соответственно по сравнению с секретин-церулеиновым анализом [21]. Однако тот же метод обладает теми же недостатками, что и все другие стандартные прямые тесты оценки экзокринной функции ПЖ. Напротив, S. Pungapong и соавт. не обнаружили значимых отклонений содержания цинка в панкреатическом секрете больных ХП, что, возможно, объясняется различиями в методологии исследований и тяжести ХП [57].
В недавнем проспективном исследовании B.N. Girish и соавт. [26] 101 пациента с ХП (34 – алкогольный, 67 – тропический) было отмечено достоверное снижение содержания цинка в эритроцитах относительно контроля (здоровые люди; p<0,001), более выраженное при тропическом, чем при алкогольном, ХП (p=0,001), а также при сахарном диабете (p=0,036). Кроме того, авторами была обнаружена корреляционная связь уровня цинка с концентрацией панкреатической эластатзы в стуле (r=0,587, p<0,001), что подтверждает ранее опубликованные данные J.E. Dominguez-Munoz и соавт. [21]. Что наиболее интересно и важно для практических врачей – у пациентов с ХП, характеризовавшихся дефицитом цинка, не было отмечено ни симптомов недостаточности этого микроэлемента, ни взаимосвязи тяжести дефицита с ИМТ [26]. Таким образом, только лабораторное тестирование позволяет оценивать истинный дефицит этого микроэлемента у больных ХП. Продолжение цитируемой выше работы B.N. Girish и соавт., опубликованное спустя 3 года [27], позволило доказать ассоциацию дефицита цинка не только с тяжестью ЭНПЖ, но и со сниженной активностью компонентов антиоксидантной системы (супероксиддисмутазой).
Нутритивная коррекция при ХП
Главной целью нутритивной коррекции служит гарантирование достаточного поступления макро- и микронутриентов для уменьшения мальдигестии, мальабсорбции и других факторов риска, что в конечном итоге обеспечит профилактику или лечение нутритивной недостаточности. Лечение ЭНПЖ начинается с диетических рекомендаций и заместительной ферментной терапии препаратами панкреатина. Приблизительно 80% пациентов с ХП отвечают стабилизацией нутритивного статуса на стандартную комплексную терапию, включающую применение анальгетиков, панкреатических ферментов, модификацию питания и образа жизни [39]. В среднем 10–15% больных ХП нуждаются в нутритивной коррекции, в 5% случаев обоснованно энтеральное зондовое питание и лишь у 1% больных по показаниям выполняется парентеральное питание [13, 58].
Энтеральное питание
Масса исследований, проведенных преимущественно при остром панкреатите, свидетельствует, что энтеральное питание приводит к уменьшению выраженности острофазового воспалительного ответа [20], снижает риск сепсис-ассоциированных осложнений (особенно внепанкреатических), улучшает контроль уровня глюкозы [73], дает фармакоэкономический эффект [28], уменьшает продолжительность госпитализации и, возможно, снижает летальность [55]. На основании этих идей и предположения об общности патофизиологии острого и хронического панкреатитов проведены исследования по применению энтерального зондового питания и у больных ХП [64].
В клиническом исследовании больных некротизирующим панкреатитом зондовое питание определяло лучшую динамику выздоровления и меньшую необходимость в дополнительных вмешательствах по сравнению с пациентами, получавшими парентеральное питание [32]. В другом небольшом исследовании, включившем 58 пациентов с ХП, все из которых страдали выраженной панкреатической болью, при использовании энтерального зондового питания удалось не только улучшить показатели нутритивного статуса (табл. 3), но и достичь уменьшения выраженности боли у 79,3% больных вне зависимости от этиологии ХП [64]. Уменьшение числа пациентов с выраженной болью в животе (с 96 до 23%; p<0,05) на фоне энтерального зондового питания было отмечено и в другом небольшом ретроспективном исследовании, включившем 57 пациентов с ХП [66]. Важно отметить, что эффект уменьшения панкреатической боли после курса нутритивной поддержки с применением энтерального зондового питания может сохраняться некоторое время, поскольку рецидивы боли продолжаются при проспективном наблюдении у 20,7% больных (в среднем через 4 месяца, диапазон – 1–25 месяцев) [64]. Известен опыт и более длительного использования энтерального зондового питания 30 пациентов с ХП, составившего в среднем 4,6 месяца при среднем периоде наблюдения 7,5 месяцев. В 66,7% случаев отмечено уменьшение или купирование панкреатической боли на фоне только энтерального питания (p=0,0008) [53].
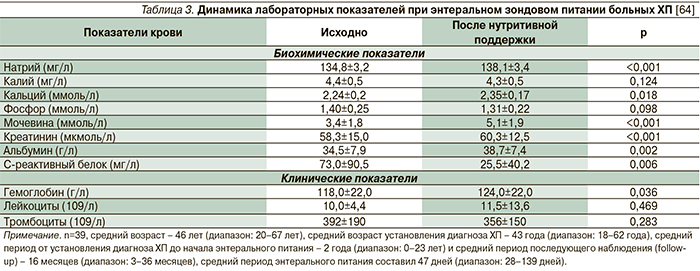
Что немаловажно для клиницистов – 72,4% больных отмечают хорошую переносимость зондового питания. Следует отметить и возможные осложнения – 24,1 и 15,5% больных страдали диареей и тошнотой соответственно; в 19,0 и 17,2% случаев отмечена обтурация или миграция назоинтестинального катетера для энтерального питания, требующие повторной установки [64]. Средняя прибавка в весе больных ХП на фоне энтерального зондового питания варьируется в пределах от 1 кг за период 47 дней (p=0,454) [64] до 4,3 – за период 113 дней (p<0,05) [66].
Предполагаемым объяснением эффекта купирования боли при использовании больными ХП энтерального питания служит возможное снижение сывороточного уровня холецистокинина, высокое содержание которого в сыворотке крови, вероятно, определяет персистирование боли у больных ХП [69]. Другими словами, у пациента с ХП, получающего скудное питание, постпрандиальная стимуляция секреторной активности ПЖ будет минимальной [20], вызывая уменьшение секреции холецистокинина.
В небольшом эксперименте у двух пациентов с ХП не было отмечено изменений секреции амилазы в ответ на интракишечное введение элементной молочной смеси [34]. С другой стороны, с учетом непрерывности секреции ПЖ очень сложно оценить эффект купирования боли при энтеральном питании за счет ослабления холецистокининового механизма [35]. Одним из возможных объяснений анальгетического эффекта длительного зондового питания остается положительное воздействие на моторику желудка и кишечника, нарушения которой могут объяснять персистирование боли или является одной из сопричин боли при ХП [66]. Элементные и полуэлементные смеси более эффективны в плане минимального воздействия на экзокринную секрецию ПЖ по сравнению со стандартным питанием [30]. Элементные молочные смеси при введении в желудок характеризуются низкой способностью к стимуляции секреции желудочного сока, что опосредованно уменьшает нагрузку на ПЖ [3].
Парентеральное питание
Парентеральное питание больными ХП используется нечасто, что обусловлено физиологичностью энтерального питания (естественное поступление нутриентов, низкий риск гипергликемии, сохранность тонкокишечного эпителия и его барьерной функции и т.д.) и известными рисками парентерального (повышенный риск катетер-ассоциированных инфекций и осложнений сепсиса). Таким образом, парентеральное питание должно использоваться больными ХП только в эксклюзивных случаях невозможности энтерального питания [60], к которым можно отнести ситуации с необходимостью желудочной декомпрессии, невозможностью низведения назоинтестинального зонда в тощую кишку, при наличии осложненных свищей в верхнем отделе желудочно-кишечного тракта. Длительность использования этой методики обычно ограничена несколькими днями, например, с целью подготовки больного к оперативному вмешательству по поводу осложнений ХП [58]. До сих пор не проведены клинические исследования, в которых оценивался бы опыт длительного парентерального питания больных ХП с ЭНПЖ.
Антиоксиданты
Эффективность применения антиоксидантных витаминно-минеральных комплексов с целью улучшения качества жизни и уменьшения панкреатической боли активно обсуждается в последние годы [88]. Первыми исследованиями больных ХП было показано снижение цистеина, цистеинглицина, глутатиона [72], токоферола, витамина А и каротиноидов, селена [48], что позволяет предполагать взаимосвязь дефицита антиоксидантов с воспалением в ткани ПЖ. Действительно, в условиях оксидативного стресса свободные радикалы и продукты перекисного окисления могут разрушать клетки, за счет прямой деструкции клеточной мембраны нанести ущерб клеткам или за счет повреждения сигнальных проводящих путей [71]. Свободные радикалы и продукты перекисного окисления могут вызывать дегрануляцию тучных клеток с индукцией хемотаксиса, воспаления и боли [45]. В ряде исследований было отмечено наличие оксидативного стресса у больных алкогольным и идиопатическим ХП [37, 72]. Совокупность фактов позволила создать теорию (2012), объясняющую, что накопление свободных радикалов у больных ХП может усиливать повреждение железы и вызывать более интенсивные боли [29].
Недавнее рандомизированное контролируемое исследование, проведенное в Манчестере и сравнивавшее эффект терапии антиоксидантами с плацебо для 70 пациентов с ХП (A.K. Siriwardena и соавт., ANTICIPATE study, 2012), не показало значительного ослабления боли или улучшения качества жизни [63] и вошло в противоречие с результатами ранее опубликованных исследований, вызвав дискуссию с критикой (нельзя сказать, что необъективной) этой работы [18, 67]. Безусловно, цитируемое выше исследование A.K. Siriwardena и соавт. [63] оказало влияние на результаты единственного мета-анализа, оценивавшего эффективность антиоксидантов в купировании боли у пациентов с ХП [19]. Этот мета-анализ включил 9 рандомизированных исследований (n=390). Результаты этой работы демонстрируют достоверное увеличение содержания антиоксидантных субстанций в крови (p<0,00001) в отсутствие влияния на боль (р=0,67) и достоверного увеличения нежелательных явлений (p<0,01), ни одно из которых серьезным не оказалось [19]. В связи с этим нельзя не вспомнить результаты ранее выполненного мета-анализа G. Bjelakovic и соавт. [16], показавшего увеличение летальности среди больных, принимавших антиоксидантные комплексы в течение в среднем 2,7 года с целью первичной или вторичной профилактики заболеваний сердца, онкологических и инфекционных заболеваний.
Таким образом, опираясь на результаты приведенных выше исследований, существует мнение, будто эффективность и безопасность длительного применения антиоксидантов с целью купирования боли еще предстоит доказать [13, 56], однако что же делать практикующему врачу для оптимального лечения больных ХП? [25]. На наш взгляд, теоретическая база применения антиоксидантов больными ХП с целью купирования боли и уменьшения воспаления, а также потенциального антифибротического действия, определенно существует. Расхождение результатов клинических исследований может быть объяснено отличиями в дизайне исследований, вариабельной длительностью применения антиоксидантных препаратов и различаями в их составах (монокомпонентные, различные многокомпонентные комплексы). Действительно, в цитируемом выше мета-анализе авторами было отмечено, что комбинированные антиоксидантные комплексы оказывают эффект купирования боли (р=0,02), в то время как монотерапия единственным антиоксидантым агентом – нет (р=0,83) [19].
Заключение
Проблема изучения статуса микронутиентов для больных ХП до сих пор не решена. Следует ожидать появления исследований, оценивающих системный подход к диагностике и лечению пациентов с ХП и различными нутритивными рисками, на базе результатов которых можно будет разработать алгоритмы ведения пациентов. Фокус внимания должен концентрироваться на составе тела, абсорбции нутриентов и метаболизме, а также на определении дефицита микронутриентов. Нутритивная коррекция для широкого внедрения в рутинную практику должна быть оценена в контролируемых исследованиях с релевантными клиническими исходами ХП, т.е. заболеваемость, качество жизни, физическое функционирование и летальность.
Конфликт интересов: автор заявляет об отсутствии конфликта интересов и финансовой заинтересованности в написании данной статьи.



