Введение
На сегодняшний день резистентность инфекции Helicobacter pylori (H. pylori) к антибактериальным препаратам, используемым в схемах эрадикационной терапии (ЭТ), является основной причиной неудач лечения H. pylori-ассоциированной патологии [1, 2]. К сожалению, появление антибиотико-резистентных штаммов, этот общемировой негативный тренд, касающийся большинства инфекций и современной антибиотикотерапии, становится настоящим вызовом современной медицине XXI в.
Структура резистентности H. pylori к антибактериальным препаратам варьируется в разных географических регионах и странах, что объясняет невозможность применения единой унифицированной схемы лечения данной инфекции [3, 4]. Более того, в современной Европе за последние десятилетия потоки миграции населения внесли свои изменения в общую карту антибиотикорезистентности как внутри страны, так и в отдельных городах [5]. Чувствительность H. pylori непрерывно диверсифицируется вследствие широкого применения (подчас необоснованного) антибактериальных препаратов для лечения других заболеваний [6, 7].
В частности, частое назначение кларитромицина для лечения респираторных инфекций и метронидазола при лечении протозойных инвазий увеличило первичную резистентность H. pylori к этим препаратам в популяции многих стран [7, 8].
В современных рекомендациях по лечению инфекции H. pylori популяционный уровень резистентности к кларитромицину и метронидазолу как к основным компонентам схем ЭТ первой линии является определяющим для выбора терапевтической стратегии. При этом большинство исследователей отметили, что резистентность к кларитромицину имеет более высокую клиническую значимость по сравнению с таковой к метронидазолу [1, 9]. Данный факт находит свое отражение в консенсусе Маастрихт-IV (2010), рекомендующем дифференцированный подход к назначению схем ЭТ в зависимости от показателя кларитромициновой резистентности в популяции (табл. 1) [10].
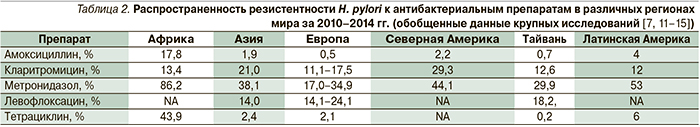
В результате анализа публикации по вопросу распространенности резистентности H. pylori в мире за последние 5 лет (2010–2014) выясняется, что частота выявления кларитромицин-резистентных штаммов уже во всех регионах мира превышает 10%, а в США и Азии преодолевает 20%-ный порог, установленный Маастрихтским консенсусом (табл. 2).

В свою очередь резистентность к метронидазолу достигает высоких значений (>50%) в странах Африки и Латинской Америки и остается относительно низкой в ряде европейских стран (около 20%). На сегодняшний день в мире не отмечено существенного роста резистентности H. pylori к амоксициллину, не считая ряда стран африканского континента, что оставляет его наиболее важным элементом в схемах ЭТ [7, 11–15].
Резистентность H. pylori к кларитромицину
Кларитромицин уже на протяжении многих лет служит основным компонентом большинства схем ЭТ. Препарат ингибирует синтез белка бактериальной рибосомы, что приводит к образованию неполноценных белковых молекул и гибели микроорганизма [16].
Резистентность H. pylori к кларитромицину детерминируется точечными хромосомными мутациями в регионе, кодирующем пептидил-трансферазу (основную мишень макролидов) в V домене 23S рРНК [17, 18]. Наиболее часто встречающимися вариациями таких мутаций являются замены нуклеотидных последовательностей в позициях 2142 (A2142G и A2142С), 2143 (A2143G) (рис. 1) [17, 19]. Замещение нуклеотидов в данных последовательностях приводит к снижению аффинности макролидов к рибосомам бактериальной клетки, тем самым формируя резистентность.
Тенденция к росту резистентности H. pylori к кларитромицину четко прослеживается в странах Европы, где общая резистентность к кларитромицину увеличилась с 9,0 (1998) до 17,6% (2008–2009) [7, 20]. По данным V. De Francesco и соавт. (2010), наиболее высокие цифры резистентности к кларитромицину зарегистрированы в Испании (49,2%; 95% доверительный интервал [ДИ] – 38,7–58,2) и Японии (40,7%; 95% ДИ – 28,5–53,3), а низкие в Нидерландах – 0,8% (95% ДИ – 0,3–1,4), Швеции – 1,5% (95% ДИ – 0,1–2,8), Малайзии – 2,1% (95% ДИ – 0,06–4,20) [12]. В России показатель резистентности H. pylori к кларитромицину, по обобщенным данным, приближается к рубежу в 20%, при этом в Санкт-Петербурге частота выделения кларитромицин-резистентных штаммов уже сейчас превышает этот показатель [21–25].
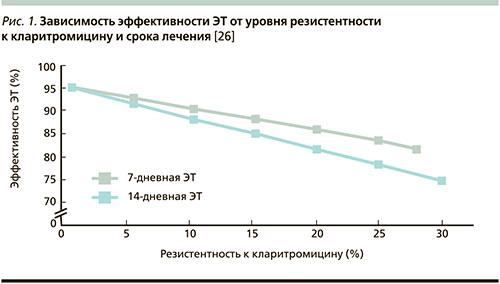
Сегодня во многих странах высокий уровень резистентности H. pylori к кларитромицину не делает обоснованным его эмпирическое использование в схемах ЭТ, что определено строгой зависимостью уровня устойчивости к этому антибиотику и эффективностью лечения (рис. 1) [7, 26].
Резистентность H. pylori к метронидазолу
Механизм действия метронидазола реализуется посредством повреждения ДНК бактериальной клетки. Проникая внутрь клетки, NO2-группа препарата восстанавливается в форму гидроксиламинового производного, вызывая повреждение ДНК и гибель микроорганизма [16].
Механизмы устойчивости H. pylori к метронидазолу опосредуются мутациями гена rdxA, кодирующего кислород-нечувствительную нитроредуктазу, а также гена frxA, кодирующего флавиноксиредуктазу [2, 17, 27]. Инактивация последних ведет к снижению трансформации (восстановления) метронидазола в активные дериваты (NO2-), оказывающие повреждающее действие на ДНК бактерии [17, 18].
Наиболее высокие показатели резистентности к метронидазолу выявлены в странах Африки (92,4%) и Латинской Америки (53,0%) [12, 15]. В Российской Федерации показатель резистентности к метронидазолу, по данным российской группы по изучению H. рylori, стабилизировался в 2001 г. на уровне 55% [28]. По данным В.В. Цуканова и соавт. (2004), в Красноярске и Абакане выявлены критические уровни резистентности к метронидазолу: 78 и 81% соответственно, что препятствует широкому применению данного препарата в схемах тройной ЭТ в нашей стране [29].
Резистентность H. pylori к амоксициллину
Одним из традиционных компонентов схем ЭТ считается амоксициллин, который в соответствии с консенсусом Маастрихт-IV включен во все схемы лечения [10]. Препарат относится к группе β-лактамных антибиотиков, подгруппе аминопенициллинов и характеризуется широким спектром антибактериального действия. Механизм воздействия амоксициллина на Н. pylori заключается в ингибировании процессов синтеза в мембране бактериальной клетки пенициллинсвязывающих белков – ферментов, осуществляющих завершающие стадии биосинтеза основного компонента клеточной стенки микроорганизма – пептидогликана, что приводит к нарушению роста и гибели бактерии [16].
Основной причиной резистентности H. pylori к амоксициллину служат мутации в гене pbp1A, кодирующем пенициллинсвязывающий белок 1A (PBP1), ответственный за катализацию терминальной стадии образования пептидогликана [2, 17, 30, 31].
В целом амоксициллин характеризуется чрезвычайно низким уровнем резиcтентности к нему H. pylori. В странах Европы, Азии и США, по данным различных исследований, резистентность микроорганизма к этому антибиотику не превышает 3% [12, 13].
Резистентность H. pylori к тетрациклину
Тетрациклин представляет собой традиционный антибиотик, используемый в схеме классической квадротерапии. Данный препарат ингибирует синтез белка в бактериальной клетке путем связывания с 30S-субъединицей рибосом микроорганизма [16].
К основным причинам резистентности H. pylori к тетрациклинам относятся мутации в генах, кодирующих 16S рРНК (rrnA и rrnB) [18, 31, 32]. При этом наиболее частой мутацией считается замена нуклеотидного триплета AGA926-928→TTC, приводящая к снижению аффинности антибиотика к рибосоме на 24–52% [32].
В целом резистентность H. pylori к тетрациклину в мире находится на низком уровне. В Европе этот показатель составляет 2,1% (95% ДИ – 1,1–3,5), в Азии – 2,4% (95% ДИ – 1,0–3,8), а в Америке – 2,7% (95% ДИ – 1,1–4,4). В странах Африки резистентность встречается значительно выше (43,9%; 95% ДИ – 35,4–52,4) [12]. В России тетрациклинрезистентные штаммы H. pylori не выявлены [28].
Резистентность H. pylori к левофлоксацину и другим фторхинолонам
Несмотря на то что в настоящий момент препараты фторхинолонового ряда используются в схемах ЭТ второй линии, резистентность к ним может иметь существенное клиническое значение, снижая эффективность схем с использованием препаратов данной группы на 30–60% [33, 34].
Резистентность к антимикробным препаратам фторхинолонового ряда связана с изменениями нуклеотидных последовательностей в гене gyrA (в позициях 87, 88, 91), кодирующем субъединицу А бактериальной ДНК-гиразы [2, 19, 35].
Резистентность H. pylori к антимикробным препаратам фторхинолонового ряда в Европе составляет 24,1% (95% ДИ – 20,7–27,4), что выше по сравнению со странами Азии, где тот же показатель составляет 11,6% (95% ДИ – 9,5–13,7). Однако в странах Азии показатели резистентности сильно варьируются – от 2,6% (95% ДИ – 0,3–4,8) в Гонконге до 14,9% (95% ДИ – 11,8–18,0) в Японии [12].
Пути преодоления резистентности
В клинической практике в целях преодоления кларитромициновой и метронидазоловой резистентности целесообразно использование двойных доз ингибиторов протонной помпы (ИПП) и более передовых генераций этих препаратов, а также включение висмута трикалия дицитрата (ВТД) четвертым компонентом в стандартную тройную схему ЭТ [2, 31, 36].
В настоящее время целесообразность удвоения доз ИПП подтверждена серьезной доказательной базой. По результатам мета-анализа, проведенного A. Villoria и соавт. (2008), двойные дозы ИПП дают в среднем 8% преимуществ над стандартными дозами ИПП в рамках ЭТ [37]. Более выраженное антисекреторное действие двойных доз ИПП определяет значимое повышение эффективности схем ЭТ первой линии за счет различных факторов, среди которых наиболее важным можно признать повышение устойчивости кларитромицина и амоксициллина при слабокислых значениях рН [38]. Достаточно показательно, что в исследовании G. Manes и соавт. (2005) увеличение дозы омепразола до 80 мг/сут давало 20%-ное преимущество для лиц с кларитромицинрезистентными штаммами H. pylori [39].
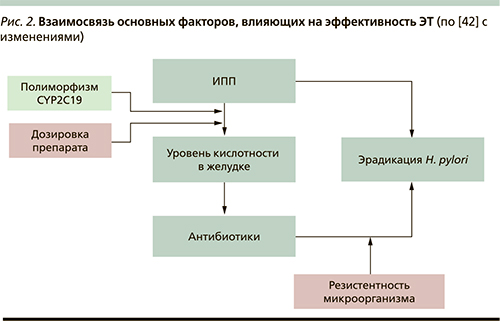
Обоснованность концепции о необходимости более мощной антисекреторной терапии для повышения уровня эрадикации нашла свое отражение в последнем мета-анализе A.G. McNicholl и соавт. (2012), включившем 35 исследований (5998 пациентов). Данная работа показала достоверные преимущества более мощных в плане антисекреторного эффекта эзомепразола и рабепразола над ИПП первых генераций в схемах ЭТ – на 4,7 и 4,1% соответственно (отношение шансов=1,32, 95% ДИ – 1,01–1,73 и 1,21, 95% ДИ – 1,02–1,42 соответственно) [40]. Эти факты демонстрируют нам, что в контексте преодоления резистентности H. pylori к антибиотикам в схемах ЭТ важное место отдается не только дозировке ИПП, но и выбору наиболее передовых генераций препаратов этого класса. Это объясняется тем, что эффективность ЭТ помимо уровня резистентности H. pylori находится в зависимости от полиморфизма гена CYP2C19, детерминирующего вариативную эффективность ИПП у конкретного больного (рис. 2) [41, 42]. Среди всех представителей ИПП рабепразол и эзомепразол различаются минимальной зависимостью от полиморфизма гена СУР2С19, что объясняет их преимущества в контексте ЭТ [43, 44].
Включение ВТД в состав схем ЭТ – один из наиболее эффективных и доступных способов оптимизации лечения инфекции H. pylori в эпоху растущей резистентности [36]. Важно отметить, что ВТД остается единственным антихеликобактерным средством, к которому не было отмечено формирования резистентности микроорганизма [2, 31]. Стоит отметить, что ВТД рассматривается как перспективное средство для преодоления резистентности H. pylori к антибиотикам [45]. Так, в контексте антибиотикорезистентности интересны результаты исследования Q. Sun и соавт. (2010), продемонстрировавшие повышение эффективности эрадикации на 15,4% и потенциальное преодоление резистентности H. pylori к кларитромицину в случае увеличения длительности использования стандартной тройной ЭТ с дополнительным включением препарата висмута с 7 до 14 дней [46].
Помимо вышеназванного и с учетом преобладания в популяции микст-штаммов H. рylori перспективно рассматривать последовательную схему ЭТ (первые 5 дней: ИПП+амоксициллин, последующие 5 дней: ИПП+кларитромицин+тинидазол/метронидазол) как протокол первой линии лечения инфекции. Теоретическим обоснованием такого выбора служит двухфазное действие последовательной ЭТ.
В течение первых 5 дней уничтожаются кларитромицинрезистентные штаммы H. pylori и бóльшая часть бактерий на поверхности слизистой оболочки, а в течение последующих 5 дней – прочие, в т.ч. в глубине желудочных ямок, и адгезированные на эпителии (с учетом действия кларитромицина на биопленки и высокой способности проникновения в ткани) [31]. В настоящее время преимущества последовательной схемы ЭТ над 10-дневной классической тройной проиллюстрированы мета-анализом L. Gatta и соавт. (2013). Так, эффективность последовательной терапии составила 84,3% (79,8–88,4%), в свою очередь эффективность 10-дневной тройной лишь – 75,3% (69,6–77,9%) [47]. Таким образом, с учетом субоптимальной эффективности существующих схем ЭТ последовательная терапия является наиболее многообещающим протоколом лечения инфекции в эру растущей антибиотикорезистентности H. pylori.
Заключение
Таким образом, сегодня резистентность H. pylori к антибактериальным препаратам, используемым в схемах ЭТ, служит основной причиной неудач лечения H. pylori-ассоциированной патологии. При этом среди антибиотиков, применяемых в схемах ЭТ H. pylori первой линии, наиболее остро проблема резистентности стоит к метронидазолу и кларитромицину, в то время как резистентность к амоксициллину и тетрациклину остается на довольно низком уровне в большинстве регионов мира. В клинической практике в целях преодоления кларитромициновой и метронидазоловой резистентности целесообразно использование двойных доз ИПП и более передовых генераций этих препаратов, а также включение препаратов висмута четвертым компонентом в стандартную тройную схему ЭТ. Помимо этого с учетом преобладания в популяции микст-штаммов H. pylori перспективно рассматривать последовательную схему ЭТ как протокол первой линии лечения рассматриваемой инфекции.



