Железодефицитная анемия (ЖДА) остается чрезвычайно актуальной проблемой для здравоохранения во всем мире. Это обусловлено высокой распространенностью (у 30% населения планеты регистрируется ЖДА) и долговременными последствиями на развитие и здоровье ребенка. Несмотря на широкое применение препаратов железа с лечебной и профилактической целями в педиатрической практике, ЖДА сохраняют свою высокую распространенность среди детей [1]. В детской популяции распространенность дефицита железа вариабильна и зависит от возраста ребенка, места проживания, характера питания и т.д. В европейских странах дефицит железа регистрируется у 7% детей в возрасте от 5 до 12 лет и у 12% – до 14 лет, а в развивающихся странах – у 51% детей в возрасте до 4 лет и у 46 % – в возрасте от 5 до 12 лет [1, 2]. Чаще он наблюдается в раннем возрасте, когда отмечаются наиболее интенсивные процессы окончательной дифференцировки и созревания различных органов, формирования центральной нервной системы (ЦНС). В России частота выявления ЖДА у детей раннего возраста варьируется в различных регионах от 27–34 [2] до 26–60% [3, 4]. В подростковом возрасте (15–19 лет) распространенность железодефицитных состояний (ЖДС) зависит от пола и выявляется в виде ЖДА у 7% юношей и 23% девушек, а латентный дефицит железа (ЛДЖ) – у 35% юношей и 65% девушек [5].
По данным статистики МЗ РФ, регистрируется рост заболеваемости анемией детей и подростков, особенно за последние годы. По результатам эпидемиологических исследований, во многих регионах регистрируется ЖДА, которая встречается среди детей раннего возраста в 16–44% случаев, также наблюдается тенденция к росту числа детей со среднетяжелой и тяжелой ЖДА [6].
Наиболее распространенной ее формой является ЛДЖ, при котором отмечается снижение запасов депонированного железа в организме и, как правило, отсутствуют какие-либо клинические и/или гематологические симптомы.
Дефицит железа влияет на энергетические процессы в клетках различных органов. Последствиями дефицита железа для младенцев и детей служат замедленное моторное развитие и нарушение координации; замедление развития речи и схоластических достижений; психологические и поведенческие отклонения (невнимание, неуверенность и т.п.); снижение физической активности; снижение способности к обучению [7].
Железо – незаменимый элемент метаболизма человека, т.к. играет центральную роль в окислительно-восстановительных процессах, эритропоэзе, тканевом дыхании и других биохимических реакциях, происходящих на молекулярно-клеточном уровне, определяющих жизнедеятельность организма в целом. С участием железа осуществляются многие метаболические процессы, такие как синтез стероидов, метаболизм лекарственных препаратов, синтез ДНК, пролиферация и дифференциация клеток, регуляция генов [7, 8]. В организме железо содержится в нескольких формах. Значительную часть (70%) составляет клеточное железо, входящее в состав гемосодержащих соединений – гемоглобина (Hb), миоглобина, ферментов (цитохромы, каталазы, пероксидазы), негемовых ферментов (НАДН-дегидрогеназы), металлопротеидов (аконитазы). К внеклеточному железу относят свободное железо плазмы и железосвязывающие сывороточные белки (трансферрин, лактоферрин), участвующие в транспорте железа.
Железо запасов находится в организме в виде двух белковых соединений – ферритина и гемосидерина – с преимущественным отложением в печени, селезенке и мышцах и включается в обмен при недостаточности клеточного железа [9].
Недостаток железа в организме ведет к задержке умственного и моторного развития, которое может реализовываться в старшем возрасте, когда ребенок учится в школе; снижению активности иммунной системы, что сопровождается частыми острыми репираторными вирусными инфекциями (ОРВИ), другими заболеваниями и т.д. [3, 7]. При дефиците железа страдают прежде всего сердечно-сосудистая система и ЦНС, что было подтверждено исследованиями D.M. Tucker и соавт. [10].
Диагностика ЖДС
К основным критериям оценки метаболизма железа в организме относятся лабораторные показатели: низкий цветовой показатель, гипохромия эритроцитов, микроцитоз, снижение уровня сывороточного железа, повышение общей железосвязывающей способности сыворотки, снижение содержания ферритина в сыворотке крови.
Клиническая симптоматика ЖДС
Клиника ЖДС в детском возрасте неспецифична и включает несколько синдромов [11].
Астеновегетативный синдром отражает нарушения функций головного мозга. Маленькие дети с ЖДА отстают в психомоторном развитии. Они плаксивы, раздражительны, капризны, плохо контактируют со сверстниками. У детей старшего возраста страдает интеллектуальное развитие: снижены память, внимание, интерес к учебе. Появляются симптомы вегетативной дисфункции. Возможны мышечные боли и гипотония (в частности, мочевого пузыря), энурез.
Эпителиальный синдром включает дистрофию и атрофию барьерных тканей (слизистых оболочек, кожи и ее производных – ногтей, волос).
К трофическим нарушениям легко присоединяются воспалительные изменения. В результате снижается аппетит, возникают извращение вкуса и обоняния (pica chlorotica), дисфагия, диспепсические расстройства, нарушения процессов всасывания в кишечнике, скрытые кишечные кровотечения. Бледность кожи и конъюнктивы наблюдаются только при значительном снижении концентрации Hb.
Иммунодефицитный синдром проявляется частыми ОРВИ и острыми кишечными инфекциями. Около 70% часто болеющих детей страдают сидеропенией. У них снижен как неспецифический (лизоцим, пропердин и т.д.), так и специфический иммунитет. Показано, что в отсутствие железа иммуноглобулин А (IgA) теряет свою бактерицидную активность.
Сердечно-сосудистый синдром наблюдается преимущественно при тяжелой форме ЖДА. У детей развиваются повышенная утомляемость, низкое артериальное давление, тахикардия, снижение тонуса сердечной мышцы, приглушение тонов, функциональный, довольно грубый систолический шум, хорошо выслушиваемый на сосудах («шум волчка») и связанный с гидремией. Возможны головокружения.
В старшем возрасте появляются характерные и наиболее часто описываемые в литературе признаки анемии. Проявления анемического синдрома – быстрая утомляемость, головокружения, обмороки, шум в ушах, мелькание мушек перед глазами, одышка, сердцебиение и др.

Симптоматика сидоропенического синдрома (тканевого дефицита железа) проявляется в виде сухости кожи, выпадения волос, ломкости, слоистости и поперечной исчерченности ногтей, которые иногда принимают ложкообразную форму (койлонихия), трещин и изъязвлений в углах рта (ангулярный стоматит, жжение языка), извращения вкуса (неукротимое желание есть мел, зубную пасту, уголь, землю, известковые краски, лед), обоняния (больные с удовольствием вдыхают запах свежей типографской краски, бензина, выхлопных газов автомашин, свежей побелки), затруднения глотания твердой и сухой пищи [3, 9].
Лабораторная диагностика ЖДС
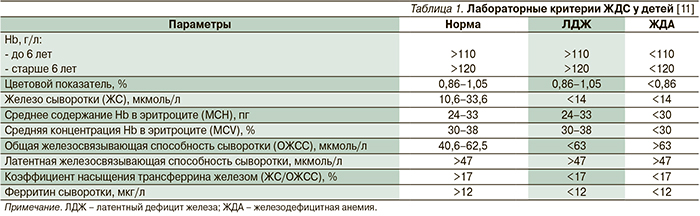
Диагноз ЖДА и ЛДЖ основывается на лабораторных критериях (табл. 1). Основным показателем служит содержание ферритина в сыворотке крови, отражающего запасы железа в организме*. При невозможности проведения данного исследования можно ориентироваться на показатели, доступные в любом медицинском учреждении: концентрацию Hb, цветовой показатель и морфологию эритроцитов в мазке периферической крови [9, 10].
В периферической крови еще до снижения показателей Hb и числа эритроцитов появляются признаки анизоцитоза (выявляемые морфологически или регистрируемые по увеличению RDV-показателя ширины распределения эритроцитов свыше 14,5%), микроцитоза (снижение показателя MCV – среднего объема эритроцитов менее 80 фл). Затем выявляется гипохромия (снижение цветового показателя до уровня менее 0,8 или показателя MCH – среднего содержания Hb менее 27 пг). Биохимические показатели, такие как сывороточное железо, железосвязывающая способность сыворотки, коэффициент насыщения трансферрина и др., менее чувствительны, лабильны и поэтому недостаточно информативны.
После установления диагноза ЖДА возникает необходимость уточнения причин ее появления, т.к. это необходимо для выработки тактики лечения. Причины ЖДА в детском возрасте разнообразны: недостаточное поступление (неадекватное питание, вегетарианская диета, недоедание); снижение всасывания железа в кишечнике; нарушение регуляции обмена витамина С; избыточное поступление в организм фосфатов, оксалатов, кальция, цинка, витамина Е и железосвязывающих веществ (комплексонов); отравление свинцом, антацидами; усиленное расходование железа (в периоды интенсивного роста и беременности); потери железа, связанные с травмами, кровопотерями при операциях, обильными менструациями, язвенными болезнями, донорством, занятиями спортом; гормональные нарушения (дисфункция щитовидной железы); гастриты с пониженной кислотообразующей функцией, дисбактериоз; различные системные и опухолевые заболевания; глистная инвазия [9].
Лечение ЖДА
Лечение анемии у детей должно быть комплексным и базироваться на устранении причины дефицита железа, нормализации режима и питания ребенка, назначении препаратов железа.
Источником железа в организме служат пищевое железо, всосавшееся в кишечнике, и железо из разрушаемых в процессе обновления клеток эритроцитов. Для адекватного выбора препарата железа необходимо учитывать особенности метаболизма железа в организме.
Метаболизм железа
Различают гемовое (содержащее протопорфирин) и негемовое железо, имеющее различия по биодоступности. Обе формы усваиваются на уровне эпителиоцитов двенадцатиперстной кишки и проксимального отдела тощей.
Гемовое железо легко усваивается (30%). Его абсорбция мало зависит от состава пищи, в то время как негемовое железо хорошо всасывается лишь при определенных условиях. Негемовое железо, получаемое из пищи, первоначально образует легко растворимые соединения с компонентами пищи и желудочного сока, что благоприятствует его усвоению, однако в желудке абсорбируется не более 20% негемового железа.
В эпителиоцитах гемовое железо распадается на ионизированное, окись углерода и билирубин, причем усвоение его не связано с кислотно-пептической активностью желудочного сока. Ускоренное усвоение железа происходит под влиянием янтарной, аскорбиновой, пировиноградной, лимонной кислот, а также фруктозы, сорбита, метионина и цистеина. Напротив, фосфаты, а также сок поджелудочной железы, содержащий ингибиторы всасывания железа, ухудшают его абсорбцию. При недостатке в пище компонентов, улучшающих всасывание железа, например аскорбиновой кислоты, усваивается <7% железа, содержащегося в таких овощах, как рис, кукуруза, фасоль, соя, пшеница. В то же время некоторые вещества, присутствующие в рыбе и мясе, увеличивают биодоступность негемового железа. Таким образом, мясо одновременно и является источником гемового железа, и усиливает всасывание негемового железа [12].
Дальнейший транспорт железа осуществляется белком трансферрином, который переносит железо в костный мозг – в места клеточных запасов железа (паренхиматозные органы, мышцы) и во все клетки организма для синтеза ферментов. Железо погибших эритроцитов фагоцитируют макрофаги. Физиологическая потеря железа происходит с калом. Незначительная часть железа теряется с потом и клетками эпидермиса. Общая потеря железа – 1 мг/сут.
Дефицит железа в организме развивается, когда потери его превышают 2 мг/сут. Организм регулирует запасы железа в зависимости от его потребностей путем увеличения его усвоения при прежнем количестве. Механизмы регуляции всасывания железа окончательно не выяснены, но твердо установлено, что всасывание ускоряется при его дефиците и замедляется при увеличении его запасов в организме [7, 13].
В терапии ЖДА важен выбор препарата, поскольку длительность лечения составляет несколько месяцев. При этом существенна не только высокая эффективность лечения, но и отсутствие побочных эффектов, а также приверженность проводимой терапии.
Основные принципы терапии ЖДС:
- подбор дозы, которая определяется возрастом пациента. Так, для взрослых средняя суточная доза железа составляет 120–180 мг элементарного железа (ЭЖ), для детей доза в соответствии с рекомендациями Всемирной организации здравоохранения и указаниями Минздрава РФ составляет в возрасте до 3 лет 3–5 мг/кг/сут ЭЖ в зависимости от препарата;
- выбор препарата железа, т.к. терапия ЖДС длительная (от 3 до 6 месяцев) и оценивается не только эффективностью применяемого препарата, но и его переносимостью;
- ранним признаком эффективной терапии препаратами железа считается рост числа ретикулоцитов в периферической крови, который определяется к 7–10-му дню терапии;
- восстановление уровня Hb осуществляется медленно и происходит в течение 4–6 недель систематического приема;
- восстановление запасов железа (ферритина и гемосидерина) происходит через 3–4 месяца терапии;
- после восстановления уровня Hb вне зависимости от степени тяжести анемии терапия препаратами железа продолжается в сниженных дозах (взрослым 60–80 мг ЭЖ, детям 1–2 мг/кг/сут ЭЖ) в течение 2–3 месяцев.
Существовавшее ранее мнение о возможности восполнения дефицита железа в организме за счет диетотерапии в настоящее время пересмотрено. Продукты питания, богатые железом, чаще всего не поступают в организм, т.к. многие компоненты пищи: молочные продукты, сыр, яйца, чай, кофе, зерновые (рис, гречка и другие крупы), овощи (шпинат, яблоки и др.), оказывают тормозящее действие на процесс абсорбции железа за счет содержащихся в них в большом количестве фосфатов, фитина, оксалатов, кальция, карбонатов [3].
Медикаментозная терапия ЛДЖ и ЖДА базируется на длительном пероральном приеме препаратов железа. Поэтому с практической точки зрения заслуживает внимания распределение препаратов железа в зависимости от особенностей их всасывания и переносимости. Выделяют ионные железосодержащие препараты (солевые, полисахаридные соединения железа) и неионные соединения, к которым относятся препараты гидроксидполимальтозного комплекса трехвалентного железа (табл. 2).
Ионные железосодержащие препараты подразделяются на простые (солевые или ионные) препараты, содержащие двух- (Fe2+) и трехвалентное (Fe3+) железо: железа сульфат, железа глюконат, железа фуморат, железа хлорид; препараты улучшенной переносимости или хелатные соединения железа Fe2+ и Fe3+, в состав которых введены кислоты (аскорбиновая, никотиновая, фолиевая и т.д.) и другие компоненты (ферменты, витамины, аминокислоты): Тардиферрон, Актиферрин, Сорбифер, Фенюльс, и сложные (неионные) полинуклеарные гидроксидные комплексы трехвалентного железа (Fe3+): (табл. 2).
Всасывание железа из ионных соединений происходит преимущественно в двухвалентной форме, тогда как активность утилизации его из препаратов, содержащих соли трехвалентного железа, зависит от уровня pH желудочного сока. При высокой кислотности желудочного сока образуются труднорастворимые гидроксиды железа, что снижает биодоступность этих препаратов. Вследствие этого наиболее часто используются препараты Fe2+, обладающие хорошей растворимостью и высокой способностью к диссоциации.
При поступлении в желудочно-кишечный тракт соединения Fe2+ проникают в мукозные клетки слизистой оболочки кишечника, а затем посредством механизма пассивной диффузии – в кровеносное русло, где происходит восстановление Fe2+ методом окисления с участием ферроксидазы-I в Fe3+. Трехвалентные формы железа соединяются с трансферрином и ферритином, образуя пул депонированного железа, которое используется при необходимости в синтезе Hb, миоглобина и других железосодержащих соединений. При этом образуются свободные ионы Fe, имеющие низкую молекулярную массу, попадающие в кровь даже после того, как исчерпаны возможности физиологического транспортного механизма, создавая риск перенасыщения железом. Передозировка и случайная интоксикация при применении препаратов железа – весьма распространенные явления. В США от случайного приема таблеток железа ежегодно умирают примерно 10–12 детей, как правило в самом раннем возрасте [14].
Образующиеся свободные ионы Fe2+ вызывают локальное раздражение и повреждение слизистой оболочки желудка в месте их высвобождения. В связи с этим возникают неприятные побочные эффекты в виде тошноты, болей в животе, чувства переполнения и давления в области эпигастрия. Неприятный металлический привкус и окрашивание эмали зубов также связывают со свободными ионами железа [15].
Окисление ионов Fe2+ в Fe3+ сопровождается высвобождением электронов, приводящих к образованию высокореактивных свободных радикалов, активизирующих процессы перекисного окисления липидов (ПОЛ), вызывающих повреждение и гибель клеток желудочно-кишечного тракта вплоть до развития некроза. Особенно опасны процессы ПОЛ для вещества мозга, т.к. клеточные мембраны нейронов богаты полиненасыщенными жирными кислотами, а спинномозговая жидкость отличается низкой железосвязывающей активностью. Эти особенности преобразования простых препаратов железа обусловливают их высокую токсичность при длительном применении [16].
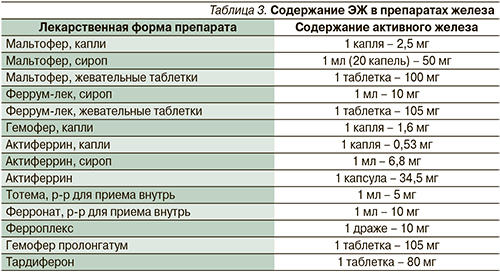
Кроме того, немаловажное значение имеет и расход препарата. Большинство известных и широко используемых врачами ионных препаратов железа имеют низкое содержание ЭЖ. Например, Ферроплекс (10 мг ЭЖ), Конферон (50 мг ЭЖ), Феррамид (10 мг ЭЖ), сироп алоэ с железом (в 5 мл сиропа 2,5 мг ЭЖ). При их использовании суточная потребность в лечебной дозе препарата нередко составляет 10–18 таблеток или капсул, что еще больше ухудшает переносимость данных препаратов и может приводить к отравлению препаратами железа. В аптеках имеется ряд ионных препаратов железа с улучшенной переносимостью и достаточным содержанием ЭЖ (табл. 3). Среди них: Ферро-градумент (105 мг ЭЖ), Тардиферон (80 мг ЭЖ), Актиферин (34,8 мг ЭЖ; 5 мл сиропа – 34 мг ЭЖ; в 1 мл капель [18 кап.] – 9,8 мг ЭЖ), Фенюльс (45 мг ЭЖ), Хеферол (100 мг ЭЖ), Ферретаб комп. (50 мг ЭЖ) и др. При использовании таких препаратов суточная потребность снижается до 1–2 таблеток или капсул, однако и при их применении возможно развитие побочных эффектов.
Таким образом, к недостаткам ионных препаратов железа относятся металлический привкус во рту, потемнение зубов и десен, диспепсические явления (тошнота, чувство переполнения желудка, рвота, запор, диарея), в редких случаях – некроз слизистой оболочки кишечника.
Характерной особенностью простых препаратов железа является то, что ионы железа образуют нерастворимые соединения с такими пищевыми компонентами, как танин (кофе, чай), фитин (рис, соя), фосфаты (рыба, морепродукты) [2, 9, 12].
Таким образом, лечение простыми солевыми препаратами железа эффективно, просто, дешево, но ограничено побочными эффектами, низкой приверженностью лечению, плохой всасываемостью.
Препараты улучшенной переносимости. Препараты железа улучшенной переносимости представляют собой те же солевые препараты Fe2+ и Fe3+ в сочетании с кислотами (аскорбиновой, никотиновой, фолиевой и др.) и мукопротеазой или аминокислотами (D,L-серин). Данные комплексы улучшают переносимость препаратов железа и повышают приверженность терапии.
Сложные (неионные) препараты железа. Неионные препараты железа, созданные на основе гидроксидполимальтозного комплекса Fe3+ (ГПК), по химической структуре максимально приближены к таковой естественных соединений железа с ферритином и имеют большую молекулярную массу, относятся к высокоэффективным и безопасным препаратам железа [15, 16].
Всасывание железа из ГПК происходит путем переноса через щеточную каемку мембраны кишечника с помощью транспортного белка, а затем высвобождения для связывания с трансферрином и ферритином. При этом характерны физиологические процессы саморегулирования: при насыщении организма железом всасывание прекращается по принципу обратной связи, что исключает возможность передозировки и отравления. По данным литературных источников, за все время использования препаратов ГПК Fe3+ не было зарегистрировано ни одного эпизода случайного отравления с летальным исходом.
Неионные соединения железа не диссоциируют в желудочно-кишечном тракте с высвобождением свободных ионов железа, что проявляется их хорошей переносимостью.
В ГПК гидроокись железа (Fe3+) окружена нековалентно связанными молекулами полимальтозы. В физиологических условиях ГПК железа стабилен, поэтому препараты на его основе имеют приятный вкус и практически не приводят к окрашиванию эмали зубов. Как показали клинические исследования, проведенные в России и за рубежом, побочные эффекты практически не встречаются при использовании препаратов нового поколения (ГПК), они эффективны, безопасны, лучше переносятся детьми [9, 12, 13, 15–17].
Клиническая эффективность терапии ЖДС
При выборе препарата железа необходимо руководствоваться в первую очередь доказательной базой данных опубликованных клинических исследований.
В рандомизированном двойном слепом исследовании у 30 детей в возрасте от 2 до 7 лет, имевших ЖДА (исходный уровень Hb<11 г/дл), сравнивались эффективность и безопасность сульфата железа и ГПК железа [15]. Все дети получали препараты в дозе 4 мг/кг массы тела в сутки в перерывах между приемом пищи в течение 2 месяцев. В конце исследования удалось достичь удовлетворительного прироста уровня Hb.
В группе детей, принимавших сульфат железа, уровень Hb оказался достоверно (p<0,01) ниже (+1,1±1,4 г/дл), чем при лечении ГПК железом (+1,8±1,4 г/дл). Уровень ферритина в сыворотке также достоверно увеличился: с 12±12 до 32±22 нг/мл – в группе ГПК железа и с 12±16 до 65±45 нг/мл – в группе сульфата железа. Переносимость препаратов оказалась хорошей в обеих группах лечения. Однако у 30% детей, принимавших сульфат железа, отмечено окрашивание зубов, которое отсутствовало у детей, принимавших ГПК железа. Жидкий стул чаще (33%) отмечался в группе ГПК железа, чем в группе сульфата железа (10%). Частота появления темного стула была одинаковой в обеих группах.
В другом исследовании [16] у детей грудного и младшего возраста (n=49), принимавших те же препараты железа в течение 2 месяцев и в тех же дозах (4 мг/кг/сут), были получены аналогичные результаты. Однако переносимость сульфата железа оказалась хуже. Диарея, явившаяся причиной преждевременного прекращения лечения, была отмечена в 21% случаев в группе сульфата железа и в 8% случаев в группе ГПК железа.
J.V.D. Andrade и соавт. сравнили эффекты назначения ГПК железа детям грудного и младшего возраста с ЖДА с пищей и в перерывах между едой. При сравнении групп значимых различий не отмечено, что подтверждает тот факт, что прием ГПК железа с пищей не приводит к снижению его эффективности [13].
P.B. Devaki и соавт. исследовали влияние дополнительного приема препарата на иммунную систему 120 подростков с разными уровнями содержания железа в организме (некоторые с ЖДА, некоторые без). У подростков, получавших ГПК железа (100 мг/сут, 6 дней в неделю в течение 8 месяцев), отмечено увеличение бактерицидной активности нейтрофилов, улучшение теста на восстановление нитросинего тетразолия и реакции на фитогеммаглюттинин, чего не наблюдалось в группе плацебо. Побочных эффектов, связанных с приемом ГПК железа, не отмечено [17].
Позднее (2010) изучалась эффективность и безопасность ГПК железа для профилактики ЖДС у здоровых детей раннего возраста [18]. Исследование было сравнительным, изучали эффективность и безопасность ионного солевого препарата железа (глюконат железа) и ГПК железа. Были включены 105 детей, распределенных в 2 группы, 53 ребенка принимали глюконат железа и 52 – препарат железа на основе ГПК Fe3+ в течение 12 месяцев. Эффективность ферротерапии оценивалась по динамике лабораторных показателей (Hb, гематокрит, MCV, ферритин, транферрин и сывороточное железо).
Результаты исследования показали, что уровень Hb у детей, принимавших глюконат железа, оказался достоверно выше, чем в группе детей, принимавших препарат железа на основе ГПК Fe3+ (12,04±0,09 и 11,68±0,11 г/дл; p<0,014). При этом уровень Hb менее 11,0 г/дл отмечен у 3 (5,7%) детей, принимавших глюконат Fe2+, и у 10 (19,2%) детей, принимавших препарат железа на основе ГПК Fe3+ (p<0,04). Различий в показателях гематокрита, MCV, ферритина, транферрина и сывороточного железа выявлено не было. Однако безопасность профилактики ЖДС оказалась лучшей в группе детей, принимавших препарат железа на основе ГПК Fe3+, чем в группе глюконата железа, гастроинтестинальный синдром чаще выявлялся у детей, принимавших глюконат железа (47 против 25%; p=0,025).
В заключение авторы указали, что оба препарата могут использоваться для профилактики ЖДС, но при этом необходимо обращать внимание на переносимость ферротерапии [18].
Заключение
ЖДС в педиатрии характеризуются высокой распространенностью и долговременными последствиями для здоровья детей. Основными диагностическими критериями оценки метаболизма железа в организме являются лабораторные показатели, т.к. клинические проявления в детском возрасте неспецифичны. Основой медикаментозной терапии ЛДЖ и ЖДА служит длительный пероральный прием препаратов железа, в связи с чем выбор препарата должен базироваться на фармакологических характеристиках лекарственного средства. Препараты железа, созданные на основе ГПК Fe3+, по химической структуре максимально приближены к структуре естественных соединений железа с ферритином и относятся к высокоэффективным и безопасным препаратам железа.



