Впрактике врача-педиатра железодефицитная анемия (ЖДА) встречается достаточно часто, поскольку дети и подростки наряду с беременными женщинами относятся к группе риска [1]. Диагноз ЖДА, как правило, не вызывает затруднений у практических врачей, т.к. ЖДА составляет 90% от всех анемий в детском возрасте [2] и 80% от всех анемий у взрослых [3]. Выполняемый в поликлинических условиях общий анализ крови позволяет выявлять анемию у ребенка как в процессе диспансеризации, так и при выявлении врачом жалоб, подозрительных на наличие анемии. Критерием анемии при этом считается снижение концентрации гемоглобина (Hb) ниже возрастной нормы (табл. 1).
Железодефицитный характер анемии подтверждается определением в сыворотке крови концентрации железа (СЖ), общей железосвязывающей способности сыворотки крови (ОЖСС) и ферритина (СФ). При ЖДА СЖ и СФ снижены, а ОЖСС повышена. При ЖДА также снижен коэффициент насыщения трансферрина железом (НТЖ), являющийся производным показателем СЖ и ОЖСС.
Как отмечает акад. РАН А.И. Воробьев, «лечение железодефицитной анемии – обычно простая и благодарная задача. К сожалению, далеко не всегда железодефицитную анемию лечат так, как положено» [3]. Целью терапии ЖДА является устранение дефицита железа (ДЖ) и восстановление его запасов в организме.
Исходя из данной цели, практическому врачу необходимо решить две задачи:
- устранить причину, приведшую к развитию ЖДА;
- одновременно возместить ДЖ в организме.
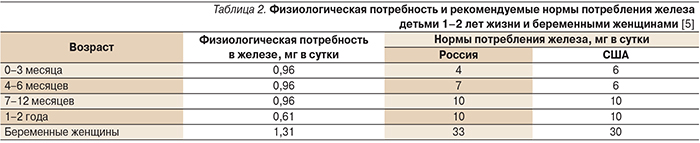
Необходимо вовремя устранить железодефицитное состояние (ЖДС) у матери. Это является наилучшим способом профилактики ДЖ у новорожденного. Содержание железа в питании беременной женщины должно составлять не менее 40 мг в сутки начиная с 18 недель гестации [4]. Как правило, полноценная и сбалансированная по основным ингредиентам диета позволяет лишь восполнить физиологическую потребность (табл. 2) организма в железе, но не устранить ДЖ.

Одним из главных принципов лечения ЖДА, сформулированных Л.И. Идельсоном еще в 1981 г., является положение о том, что возместить уже имеющийся ДЖ без лекарственных препаратов, содержащих железо, невозможно [6]. Прежде чем приступить к медикаментозному лечению ЖДА у ребенка, необходимо выяснить причину ее возникновения (неправильное питание, кровотечения, гельминтозы, нарушения всасывания и др.). Начиная лечить анемию, врач одновременно должен устранить ее причину, в противном случае лечение будет неэффективным.
Для восполнения ДЖ необходимо правильно выбирать железосодержащий препарат. При этом препараты железа для перорального приема считаются более предпочтительными по нескольким причинам:
- прием препаратов железа внутрь удобен и эффективен для лечения ЖДА, даже тяжелой;
- крайне редко наблюдаются серьезные нежелательные явления;
- пероральный прием препаратов железа, даже в случае неправильно поставленного диагноза и ошибочной трактовки характера анемии как железодефицитного, не приводит к развитию гемосидероза [7].
В настоящее время к основным пре-паратам железа для перорального приема, используемым в педиатрической практике, относятся солевые препараты железа и неионные соединения, в т.ч. препараты железа (III) на основе гидроксид полимальтозного комплекса – ГПК. Лечение ЖДА препаратами железа для парентерального введения проводится только в небольшом числе случаев и только по строгим показаниям. Современные препараты железа, применяемые для лечения ЖДС, можно подразделить на несколько групп (см. рисунок).
Особенно важно правильно выбирать препарат железа для лечения ЖДА в педиатрической практике. Следует обращать внимание не только на достаточную эффективность и безопасность препарата железа, но и на его хорошую переносимость, удобство приема, а также на курсовую стоимость. Лечение ЖДА – длительный процесс, поэтому от всех этих факторов будет зависеть выполняемость назначений врача пациентом, что в конечном итоге влияет на эффективность терапии [8, 9]. Пероральные препараты железа, применяемые в детской практике, должны отвечать определенным требованиям: быть высокоэффективными и безопасными, обладать хорошими органолептическими свойствами, быть представлены лекарственными формами, удобными для пациентов всех возрастов.
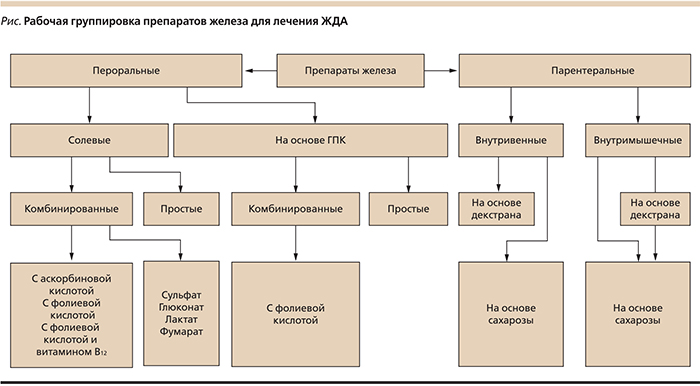
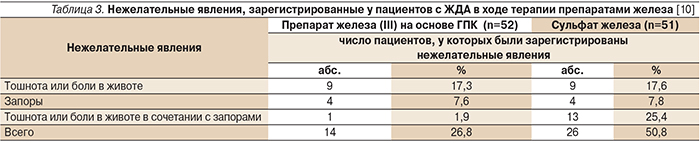
В лечении ЖДА солевые препараты железа и препараты железа (III) на основе ГПК одинаково эффективны. Скорость восстановления запасов железа в организме сопоставима, но количество нежелательных явлений различается значительно (табл. 3).
После выбора препарата железа необходимо определить суточную дозу лекарственного средства и кратность его приема. Суточные терапевтические дозы пероральных солевых препаратов железа для лечения ЖДА у детей предложены экспертами ВОЗ [11] и представлены в табл. 4.
Рекомендуемые дозы препаратов железа (II) рассчитаны на основе данных, свидетельствующих о том, что лишь 10–15% поступающего в организм железа всасывается. Назначение более высоких доз солей железа приводит к повышению частоты и выраженности нежелательных явлений.
Суточная терапевтическая доза препаратов железа (III) на основе ГПК независимо от возраста составляет 5 мг/кг.
Продолжительность лечения ЖДА зависит от степени тяжести анемии и составляет:
- при анемии легкой степени – 3 месяца;
- при анемии средней степени − 4,5;
- при анемии тяжелой степени – 6 месяцев.
При лечении латентного ДЖ все препараты железа используют в 50%-ной терапевтической дозе за 2 месяца [12].
Необходимо учитывать, что под влиянием некоторых содержащихся в пище веществ (танин чая, фосфорная кислота, фитин, соли кальция, молоко), а также при одновременном применении ряда лекарственных средств (альмагель, фосфалюгель, препараты кальция, пеницилламин и др.) всасывание железа из препаратов солей железа может уменьшаться. Однако эти вещества не влияют на всасывание микроэлемента из железа (III) на основе ГПК [12].
На протяжении всего курса лечения ЖДА врач обязан наблюдать пациента и оценивать эффективность проводимой терапии. Критерии эффективности лечения препаратами железа:
- ретикулоцитарная реакция: на 7−10-й день от начала лечения препаратами железа количество ретикулоцитов повышается (обычно на 2–3%) по сравнению с таковым до начала лечения;
- повышение к концу 4-й недели лечения препаратами железа концентрации Hb на 10 г/л и гематокрита (Ht) на 3% [7];
- исчезновение клинических проявлений заболевания через 1−1,5 месяца от начала лечения препаратами железа;
- преодоление тканевой сидеропении и восполнение железа в депо через 3−6 месяцев от начала лечения (в зависимости от степени тяжести анемии), что контролируется по нормализации концентрации СФ.
К наиболее частым ошибкам при лечении ЖДА, приводящим к его неэффективности, относятся:
- неправильная трактовка анемии как железодефицитной. Если диагноз ЖДА поставлен правильно, ответ на солевые препараты железа или препараты железа (III) на основе ГПК будет обязательным. Если отсутствует ретикулоцитарная реакция, являющаяся ранним ответом на лечение, и не наблюдается повышения концентрации Hb на 10 г/л и Ht на 3% к концу 4-й недели лечения, следует прекратить лечение и пересмотреть диагноз, т.к. анемия скорее всего не железодефицитная [7];
- недостаточная доза препарата (неправильно рассчитанная с учетом массы тела и возраста) [12];
- недостаточная продолжительность лечения. Частой ошибкой является отмена препарата железа после достижения пациентом нормальной концентрации Hb, тогда как выздоровлением от ЖДА считается восполнение запасов железа в депо и устранение тканевой сидеропении, о чем свидетельствует нормализация концентрации СФ, а не нормализация концентрации Hb, которая наступает значительно раньше [12];
- отсутствие взаимопонимания между врачом и пациентом (родителями), которые приводят к нерегулярному приему препарата, прекращению приема препарата из-за неудобной лекарственной формы или нежелательных явлений. Лечение ЖДА родителями пациента в домашних условиях не позволяет быть уверенным в выполнении всех рекомендаций врача, вместе с тем выполнимость курса лечения (комплаенс) имеет принципиальное значение;
- игнорирование врачом возможных заболеваний у пациента, приводящих к нарушению всасывания препаратов железа (заболевания желудочно-кишечного тракта – ЖКТ, мальабсорбция и т.д.);
- игнорирование врачом наличия у пациента непереносимости назначенного препарата железа. Следует уточнить переносимость пациентом назначенного препарата железа и наличие таких нежелательных явлений, как боли в желудке, тошнота, рвота, запоры, поносы, в связи с которыми больной может самостоятельно прекратить прием препарата железа. В таких случаях иногда приходится проводить смену препарата железа.
Таким образом, чаще всего неэффективность лечения обусловлена неадекватностью назначенной терапии или анемией, не связанной с ДЖ. Рефрактерная к лечению препаратами железа ЖДА (iron-refractory iron deficiency anemia – IRIDA) встречается крайне редко и обусловлена различными мутациями в гене TMPRSS6 [13, 14].
Истинная потребность в назначении парентеральных (внутривенных, внутримышечных) препаратов железа, как уже отмечалось ранее, возникает в ограниченном числе случаев и по строго обозначенным показаниям:
- при тяжелых формах ЖДА (менее 3% больных);
- при неэффективности или непереносимости пероральных препаратов железа;
- при наличии язвенной болезни желудка и/или двенадцатиперстной кишки и операций на ЖКТ, даже в анамнезе;
- после резекции желудка, тонкой кишки;
- при неспецифическом язвенном колите, болезни Крона;
- при синдроме нарушенного всасывания;
- при необходимости быстрого насыщения организма железом.
При необходимости назначения парентеральных препаратов железа следует строго соблюдать принципы безопасности, т.к. возможны нежелательные явления при их использовании: местные (покраснение, жжение, зуд) и общие (аллергические, анафилактоидные реакции). Последние характерны для парентеральных препаратов железа, содержащих декстран.
Во избежание нежелательных явлений следует придерживаться основных принципов назначения парентеральных препаратов железа:
- следует применять парентеральные препараты железа только при наличии показаний;
- обязательно применять тест-дозу, если это указано в инструкции к препарату;
- использовать современные препараты железа, выбирая из них с меньшей токсичностью, без анафилактоидных реакций, опасных для жизни больного;
- не превышать общий ДЖ в организме, рассчитанный по формуле, и не превышать НТЖ;
- прекратить терапию после восполнения общего ДЖ во избежание опасного перенасыщения организма железом. По тем же соображениям желательно проводить терапию парентеральными препаратами железа под контролем НТЖ;
- соблюдать технику проведения внутримышечной инъекции и внутривенной инфузии препаратов железа;
- проводить лечение в диапазоне безопасных доз, т.к. нежелательные явления парентеральных препаратов железа дозозависимы.

ДЖ рассчитывают по формуле, указанной в инструкции к парентеральным препаратам железа:
Общий ДЖ, мг=Масса тела больного, кг×(целевой Hb, г/л–Hb пациента, г/л)×0,24+Депо железа, мг где:
коэффициент 0,24 = 0,0034×0,07×1000:
- содержание железа в Hb ‒ приблизительно 0,34%;
- объем крови ‒ 7% массы тела;
- 1000 – перевод граммов в миллиграммы.
Депо железа у пациентов с массой тела:
- менее 35 кг‒ 15 мг/кг, целевая концентрация Hb ‒ 130 г/л;
- более 35 кг‒ 500 мг, целевая концентрация Hb ‒ 150 г/л.
До начала терапии следует обязательно определить статус транспортного фонда железа (СЖ, ОЖСС, НТЖ) и СФ. Парентеральные препараты лучше вводить с интервалом 1–2 дня.
Лечение больных веществами, содержащими железо, имеет многовековую историю. Причем история применения железа в терапии началась еще задолго до объяснения механизмов его действия. Роль ДЖ в этиологии различных заболеваний стала предполагаться в течение последних трех столетий. Однако история терапевтического применения железа намного длиннее и мнение по поводу его значения значительно менялось в различные времена [15]. Так, первые упоминания о целительных свойствах железа найдены у персидского врача Melampus (4000 лет до н.э.), который давал соединения железа морякам, потерявшим много крови от ранений во время сражений; терапевтическое применение железа описывается также Гиппократом (460–377 лет до н.э.), в Аюрведах железо рекомендуется для лечения 55 хронических заболеваний, включая анемию [16, 17]. В настоящее время известны метаболизм железа в организме человека, многочисленные нежелательные последствия ДЖ, разработан ряд эффективных и безопасных препаратов для его коррекции. Однако и в настоящее время практическому врачу нередко случается сталкиваться с трудностями в лечении ЖДА.
Данная статья призвана помочь врачам-педиатрам определить правильную тактику лечения ЖДА у детей и подростков и оградить их от наиболее часто встречающихся при этом ошибок. Ведь по определению акад. РАН А.И. Воробьева: «Железодефицитная анемия – самое благодарное гематологическое заболевание и должно вылечиваться сразу и навсегда» [3].



