Введение
Согласно мнению экспертов Все-мирной организации здравоохранения, сахарный диабет (СД) остается проблемой всех возрастов и стран [1]. Численность больных в мире за последние 10 лет увеличилась более чем в 2 раза и к началу 2013 г. достигла 317 млн человек [2]. Остеопороз (ОП) является прогрессирующим заболеванием с высокой распространенностью. В настоящее время уже не вызывает сомнений взаимосвязь между СД и ОП [3].
Так, ОП является:
- недооцененным осложнением СД;
- незамеченной болезнью при СД;
- безмолвной эпидемией.
Удельный вес ОП при СД среди всех видов вторичного ОП составляет от 6 до 10 %. Достаточно часто у пациентов с СД поражается не только костная система, но и суставной аппарат с преимущественной локализацией в нижних конечностях. Это проявляется в виде диабетической остеоартропатии – артропатии Шарко. По данным различных авторов, частота патологического процесса составляет от 1 до 55 % [4–8].

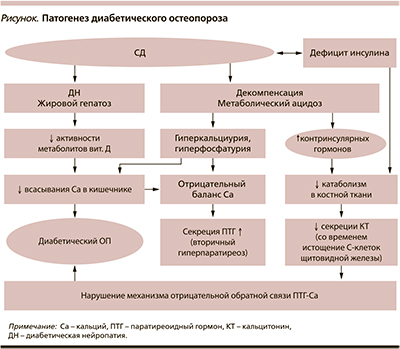
Проведенные исследования, с одной стороны, доказывают роль факторов, ассоциированных с СД, в развитии и прогрессировании ОП, с другой – позволяют рассматривать непосредственно кость как эндокринный орган. Так, отмечается как прямое, так и опосредованное влияние на углеводный обмен. Активно изучается роль инсулина в минеральном обмене. Первые результаты были получены еще в 1948 г., F. Albright описал взаимосвязь между СД и ОП. В табл. 1 систематизированы результаты современных исследований, посвященных данной проблеме.
Основные факторы, способствующие развитию и прогрессированию ОП при СД (см. рисунок):
- микроангиопатии сосудов костей → нарушение кровоснабжения;
- гипогонадизм, дефицит соматотропного гормона и низкая масса тела при СД 1 типа (СД1) → низкая костная масса;
- остеомиелит;
- остеоартропатия;
- локальные гиперостозы и т.д.
 Рядом исследований было доказано, что более чем у 50 % больных СД достоверно происходят следующие процессы:
Рядом исследований было доказано, что более чем у 50 % больных СД достоверно происходят следующие процессы:
- снижается уровень ионизированного кальция;
- превышается экскреция кальция с мочой;
- повышаются фосфор в крови и его суточная экскреция с мочой;
- повышается уровень паратгормона;
- повышается кальцитонин.
Это также способствует развитию и прогрессированию нарушений в минеральном обмене у пациентов, больных СД. С другой стороны, при декомпенсации СД наблюдается повышение содержания сорбитола. В свою очередь он в избыточном количестве накапливается в сосудах, костной ткани и т.д., что приводит к набуханию остеобластов, последующей их гибели. При кетозе наблюдается также усиленное выделение с мочой электролитов, в т.ч. кальция.
При наличии осложнений, в частности, у пациентов с хронической почечной недостаточностью, длительно находящихся на заместительной почечной терапии, развивается комплексное заболевание, обозначаемое как почечная остеодистрофия (ПО).
Основные факторы, способствующие развитию ПО:
- аномалии метаболизма витамина Д;
- выраженность вторичного гиперпаратиреоза;
- отложения алюминия в костях (ингибируют процессы минерализации);
- иммуносупрессивная терапия с формированием отрицательного костного баланса.
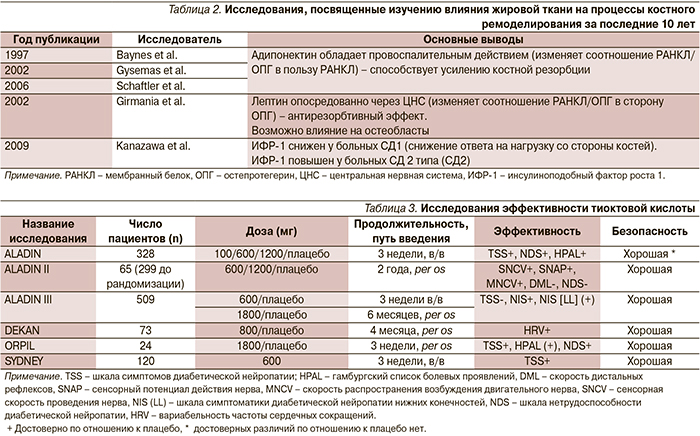
Исследования, проведенные за последние 10 лет, были посвящены изучению роли жировой ткани в формировании ОП (табл. 2).
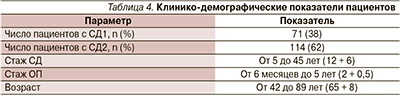
Приняв во внимание известные патогенетические механизмы развития ОП при СД, было проведено исследование, целью которого стало изучение влияния комбинированной терапии сахароснижающими, анти-остеопоротическими препаратами и меглюминовой солью тиоктовой кислоты на основные показатели костного метаболизма. Известно, что конечные продукты гликирования способствуют снижению синтеза коллагена 1-го типа и остеокальцина. Также длительно существующая гипергликемия, конечные продукты гликирования и т.д. активизируют развитие диабетической полинейропатии. Данные, доказывающие эффективность тиоктовой кислоты при лечении диабетической полинейропатии, известны по таким исследованиям, как ALLADIN, DEKAN, и др. (табл. 3), однако исследований, посвященных изучению влияния тиоктовой кислоты на ОП, ассоциированный с СД, крайне недостаточно.
Материал и методы
Было проанализировано 195 историй болезней пациентов с диагностированными ОП и СД, находившихся как на амбулаторном лечении (на кафедре эндокринологии и диабетологии ГБОУ ДПО РМАПО), так и на стационарном (ЦКБ МПС № 3, ФБУ ЦКБ ГА). При анализе историй болезней учитывались следующие показатели: наличие проведенного комплекса обследований – DEXA; маркеры костного ремоделирования и общесоматический статус, а также данные о проводимой терапии.
Критерии включения:
- пациенты с верифицированным СД и ОП любой длительности и пола;
- возраст пациентов старше 40 лет;
- применение антиостеопоротических препаратов 1-й или 2-й линии выбора в течение года;
- применение меглюминовой соли тиоктовой кислоты минимум 1 раз.
Статистическая обработка результатов проведена с помощью критерия Уилкоксона с применением программы STATISTICA 6.0 (StatSoft, 2003); статистически значимыми различия считались при р ≤ 0,05.
Результаты
 С учетом критериев включения в исследование проведен анализ 185 историй болезни. Десяти пациентам при верифицированном диагнозе ОП соответствующего лечения не проведено, они получали препараты кальция и/или витамин Д. Основные клинико-демографические данные пациентов систематизированы в табл. 4.
С учетом критериев включения в исследование проведен анализ 185 историй болезни. Десяти пациентам при верифицированном диагнозе ОП соответствующего лечения не проведено, они получали препараты кальция и/или витамин Д. Основные клинико-демографические данные пациентов систематизированы в табл. 4.
При анализе результатов лечения выявлено, что целевых значений гликемии (с учетом индивидуализированного подхода) достигли 23,2 % пациентов, получавших как пероральные сахароснижающие препараты, так инсулинотерапию.
В качестве лечения ОП пациенты получали следующие препараты:
- алендроновая кислота 11,9 %;
- золендроновая кислота 45,9 %;
- ранелат стронция 42,2 %
Все пациенты также принимали препараты кальция и витамин Д в адекватной дозе. Анализ частоты приема тиоктовой кислоты продемонстрировал, что 2 раза в год ее получали 54,6 % пациентов, а не получали – всего 2,7 %.
Важно отметить, что в группе пациентов, получавших тиоктовую кислоту, показатели гликемии были статистически лучше, чем у пациентов, не получавших данный вид терапии или лечившихся периодически. При анализе результатов исследования минеральной плотности костной ткани (МПКТ) у всех пациентов выявлена положительная динамика от 1 до 4 %.
Однако в группах, получавших терапию тиоктовой кислотой 2 раза в год по схеме: Тиогамма 600 мг 1 раз в сутки, в/в инфузии, 14–20 дней; Тиогамма 600 мг 1 раз в сутки, перорально 2 месяца, пациенты, с одной стороны, были лучше компенсированы по основным показателям углеводного обмена, с другой – прирост МПКТ был более выражен (табл. 5).
На фоне применения золендроновой кислоты, как оригинального препарата, так и отечественного генерика, отмечен больший прирост МПКТ при сочетании с Тиогаммой по сравнению с алендроновой кислотой и ранелатом стронция.
Многочисленные исследования доказывают, что при СД1 увеличивается риск перелома бедра. Так, в 2009 г. E. Vestergard et al. доказали, что пациенты без отдаленных осложнений СД имеют повышенный риск всех переломов. В частности, ОР – 1,21 (1,07–1,36) для пациентов с СД1 и ОР – 1,13 (1,06–1,22) для СД2. Через год T. Yamaguchi доказал, что наличие СД2 служит независимым предиктором переломов позвонков как у женщин, так и у мужчин. При анализе данных пациентов выявлено лишь 5 случаев переломов: 2 – в результате автотравм (сочетанные, множественные переломы), 3 – в результате падений (1 перелом шейки бедра, 2 перелома «луча в типичном месте»). Однако следует отметить, что падения наблюдались среди пациентов старшей возрастной группы от 70 до 89 лет.
Основные факторы риска падений:
- ретинопатия;
- катаракта;
- ангиопатия;
- нейропатия, особенно осложненная;
- снижение нескольких видов чувствительности – высокий риск падений;
- саркопения;
- гипогликемия;
- когнитивные нарушения.
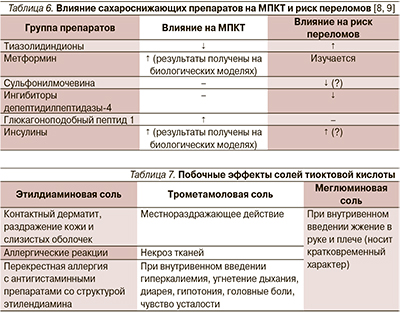
При анализе причин падений установлено (согласно записям в историях болезней) у одного пациента падение было связано с гипогликемией, двое получили травмы в гололед. Известно, что сами сахароснижающие препараты в ряде случаев оказывают влияние на МПКТ и риск переломов [9, 10] (табл. 6), что также необходимо учитывать при ведении пациентов с сочетанной патологией – СД и ОП.
При анализе сахароснижающей терапии выявлено:
- 100 % пациентов с СД1 получают инсулинотерапию, 12,3 % с СД2 также находятся на инсулинотерапии;
- препараты группы сульфонилмочевины получают 41 %;
- ингибиторы депептидилпепти-дазы-4 – 17 %;
- комбинированную терапию принимают 29,3 %.
Однако для оценки влияния данной терапии на МПКТ и риск переломов необходимо дальнейшее наблюдение и углубленное обследование.
 Обсуждение
Обсуждение
Хорошо известны основные эффекты применения тиоктовой кислоты:
- влияние на энергетический метаболизм;
- влияние на обмен глюкозы и липидов;
- антиоксидантный эффект;
- нейротропное и нейропротективное действия;
- гепатопротективное действие;
- детоксикационное действие;
- гиполипидемическое действие;
- гипогликемическое действие.
Таким образом, применение препаратов группы тиоктовой кислоты, в частности меглюминовой соли (в силу меньшего числа побочных эффектов, табл. 7), больными СД и ОП будет не только способствовать потенцированию сахароснижающих эффектов, но и оказывать влияние на показатели минерального обмена.
В заключение следует отметить необходимость комплексной терапии пациентов с СД и ОП. Основные подходы к лечению должны учитывать следующие параметры:
Сахароснижающие препараты должны быть выбраны с учетом их наименьшего негативного влияния на костную ткань.
Раннее назначение (в отсутствие противопоказаний) препаратов кальция и витамина Д.
Применение антиостеопоротических препаратов в адекватных дозах и соответствующими курсами.
Лечение тиоктовой кислотой (Тиогамма) должно носить систематический и последовательный характер: Тиогамма 600 мг 1 раз в сутки, в/в инфузии 14–20 дней, затем Тиогамма 600 мг 1 раз в сутки перорально 2 месяца.


