Снижение уровня гемоглобина (Hb) регистрируется практически у каждого третьего жителя планеты. При этом анемия не только влияет на качество жизни, но и обусловливает неблагоприятный прогноз для пациентов, страдающих ишемической болезнью сердца и цереброваскулярными заболеваниями. Анемия наиболее часто ассоциирована с хроническими заболеваниями, за исключением острых постгеморрагических анемий, а потому служит прерогативой ведения для амбулаторного этапа. Однодневный скрининг пациентов, обратившихся в поликлинику к участковому терапевту в связи с различными причинами, позволил выявить 17,2 % пациентов, имеющих низкий уровень Hb. При этом более чем в 80 % случаев анемия была диагностирована впервые, а в 70 % была средней тяжести. Эти данные позволяют судить о том, что проблеме анемии на амбулаторном этапе уделяется недостаточное внимание. Это подтверждается и тем, что во многих амбулаторных картах участковый терапевт, несмотря на наличие низких цифр Hb в анализе крови, не выносит анемию в диагноз. Реальное число пациентов с анемией на амбулаторном этапе неизвестно, т.к. официальная статистика таких больных не ведется, что обусловлено кодированием только основного заболевания, в то время как анемия является преимущественно осложнением. Среди всех анемий наиболее часто встречается микроцитарная. А в группе микроцитарных анемий лидирует железодефицитная.
Анемия – это не просто снижение уровня Hb, которое сопровождается снижением качества жизни и проявляется слабостью, снижением работоспособности, повышенной сонливостью, учащенным сердцебиением. Согласно международным позициям, анемия – независимый фактор риска инфаркта миокарда и госпитальной летальности для мужчин и серьезных сердечно-сосудистых осложнений для мужчин и женщин. Анемия и обусловленная ею системная гемическая гипоксия утяжеляют течение любого сосудистого заболевания и ухудшают его прогноз. Так, по нашим данным, для пациентов с анемией средней и тяжелой степеней риск развития инфаркта миокарда и его осложнений достоверно был выше, чем у больных с легким снижением Hb или его нормальным уровнем (93,7 и 97,3 % против 84,2 и 78,4 % соответственно; p < 0,05). Кроме того, сниженный уровень Hb ограничивает лекарственную терапию сосудистого больного, и в частности прием ключевых препаратов – антиагрегантов и антикоагулянтов.

Фрамингемское исследование показало, что анемия является независимым фактором риска развития хронической сердечной недостаточности (ХСН), а также более тяжелого ее течения (высокий функциональный класс, сниженная переносимость физических нагрузок, когнитивные нарушения, низкое качество жизни). В исследовании SOLVD было показано, что снижение гематокрита на 1 % увеличивает общую смертность больных ХСН на 2,7 %.
При этом более тяжелый функциональный класс ХСН по NYHA (New York Heart Association) ассоциировался с более низким уровнем Hb и высоким уровнем креатинина (хроническая почечная недостаточность – ХПН). Сочетание ХСН, анемии и ХПН D.S. Silverberg и соавт. назвали кардиоренальным анемическим синдромом, каждое из трех составляющих которого ухудшает течение остальных двух.
Клинический пример 1. Пациентка Г. 83 лет наблюдалась в одной из поликлиник с диагнозом «ишемическая болезнь сердца: постинфарктный кардиосклероз». Постоянная форма фибрилляции предсердий на фоне атеросклероза коронарных артерий, гипертонической болезни 3-й стадии очень высокого риска. Последствия перенесенного острого нарушения мозгового кровообращения. В амбулаторной карте в анализе крови от сентября 2012 г. уровень Hb – 110 г/л, что соответствует легкой степени анемии. Однако в амбулаторной карте нет никакой трактовки этих изменений и не назначено лечения. Следующий анализ крови пациентке был выполнен в феврале 2013 г., уровень Hb составил 81 г/л. Иными словами, в течение 6 месяцев уровень Hb прогрессивно снижался без соответствующей реакции терапевта. Через месяц больная умерла дома. На секции «сосудистый» диагноз был подтвержден. Причина смерти – желудочно-кишечное кровотечение из острых эрозий и язв слизистой оболочки желудка. На наш взгляд, анемия стала одним из ключевых факторов неблагоприятного исхода, усугубив и без того имеющуюся ишемию слизистой оболочки желудка, что привело к образованию острой язвы и фатальному желудочно-кишечному кровотечению.
С появлением и повсеместным распространением автоматических анализаторов для определения показателей общего анализа крови наиболее важными в клинической и лабораторной практике стали две классификации:
1. По степени тяжести (по уровню Hb):
- легкая анемия: 90–120 г/л у женщин; 90–130 г/л у мужчин;
- анемия средней тяжести: 70–90 г/л;
- тяжелая анемия: Hb ниже 70 г/л.
2. По размеру эритроцитов (показатель MCV – mean corpuscular volume):
- микроцитарная: MCV менее 80 фл;
- нормоцитарная: MCV 80–100 фл;
- макроцитарная: MCV более 100 фл.
В соответствии с параметром MCV понятна классификация анемии по механизму развития и становится ясным необходимый диагностический поиск (рис. 1).
Диагностика анемии включает 2 этапа. 1-й – определение вида анемии; 2-й этап – диагностика причины, приведшей к снижению Hb.
На 1-м этапе после обнаружения низкого уровня Hb необходимо оценить показатель MCV, в зависимости от которого строится дальнейший алгоритм действий врача (рис. 2). Стоит обратить внимание на следующее: при выявлении микроцитарной анемии, сопровождающейся нормальным или повышенным уровнем сывороточного железа, участковый терапевт не должен как-либо обследовать больного, а должен сразу направить больного на консультацию к гематологу, т.к. в данном случае речь идет о редких наследственных анемиях. С другой стороны, если микроцитарная анемия сопровождается низким уровнем сывороточного железа, участковый терапевт должен определить другие показатели обмена железа (трансферрин, ферритин) для дифференциальной диагностики железодефицитной анемии (ЖДА) и анемии хронических заболеваний.
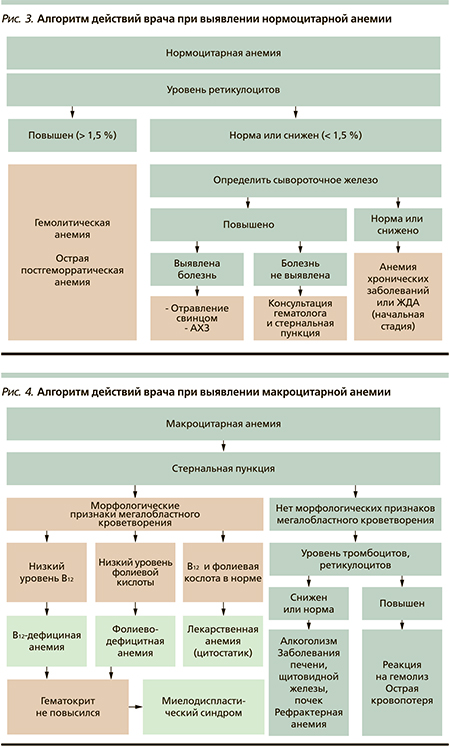
Алгоритм при нормоцитарной анемии представлен на рис. 3.
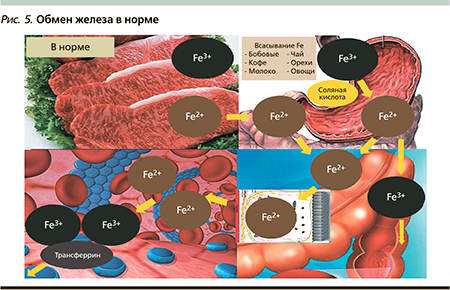
Алгоритм действий врача при выявлении макроцитарной анемии представлен на рис. 4:
Помимо диагностики вида анемии важен 2-й этап диагностического поиска, направленный на выявление причины, приведшей к снижению уровня Hb. Как показал ретроспективный анализ, на амбулаторном этапе диагностические методы для выявления причины анемии применяются примерно в отношении половины больных и только 7,7 % пациентов для уточнения причины снижения Hb госпитализируются в стационар.
Одной из самых распространенных анемий в практике участкового терапевта является ЖДА – клинико-гематологический синдром, характеризующийся нарушением синтеза Hb в результате дефицита железа, который развивается на фоне различных патологических или физиологических процессов, и проявляющийся признаками анемии и сидеропении.
Содержание железа в организме зависит от его всасывания. Наибольшая часть железа всасывается в двенадцатиперстной и тощей кишке, хотя при выраженном железодефиците даже толстая кишка способна к всасыванию железа. В пищевых продуктах растительного и животного происхождения железо содержится как в форме гема, так и в виде двух-, трехвалентных ионов. Всасывание железа, входящего в состав гема, происходит более интенсивно, нежели всасывание неорганического пищевого железа. Трехвалентное железо в желудке должно окислиться до 2-валентного, которое лучше всасывается в энтероците. Двувалентное железо проходит через энтероцит и в крови превращается в 3-валентное железо, которое соединяется с белком-переносчиком трансферрином (рис. 5). Часть железа, проникшего в энтероцит, соединяется с апоферритином, в результате чего образуется ферритин. При сидеропении в слизистой оболочке остается значительно меньше запасов железа. При избытке железа основная его часть задерживается в слизистой оболочке кишки, а затем удаляется. Если же концентрация железа превышает в десятки и сотни раз физиологическую, всасывание ионного 2-валентного железа значительно возрастает.
Железо содержится в различных продуктах растительного и животного происхождения. Из растительных продуктов железо всасывается ограниченно, тогда как из продуктов животного происхождения – гораздо в больших количествах. При этом железо, входящее в состав белков, содержащих гем, всасывается интенсивнее, чем из гемосидерина и ферритина. В связи с этим железо лучше всасывается из говядины, чем из печени или рыбы. Обмен железа представлен на рис. 5.

При снижении уровня железа и развитии ЖДА появляются клинические симптомы, которые можно объединить в два синдрома: анемический, т.е. характерный для любого вида анемии, и сидеропенический, связанный непосредственно с дефицитом железа в организме.
Анемический синдром характеризуется головокружением, головными болями, шумом в ушах, мельканием мушек перед глазами, слабостью, утомляемостью, снижением работоспособности, хронической усталостью, бледностью кожи и слизистых оболочек, сердцебиением, одышкой при физической нагрузке.
О сидеропеническом синдроме можно говорить при наличии сухости кожи, ломкости и слоистости ногтей; появлении койлонихий, извращений вкуса и обоняния, глоссита, дисфагии, ангулярного стоматита, а также при снижении интеллектуальных возможностей и способности детей и подростков к обучению; тахикардии и диастолической дисфункции миокарда.
Для подтверждения ЖДА необходимо лабораторно определить обмен железа: уровни сывороточного железа, ферритина, трансферрина. Изолированного определения уровня сывороточного железа недостаточно, т.к. оно составляет лишь 0,2–0,5 % от всего запаса железа в организме, уровень сывороточного железа снижается только при выраженном дефиците железа, что не позволяет диагностировать его латентный дефицит. Норма сывороточного железа составляет 13–30 мкмоль/л у мужчин и 12–25 мкмоль/л у женщин.
Трансферрин – транспортная форма железа. Это белок апопротеин, имеющий два активных центра, каждый из которых может присоединить один атом трехвалентного железа. Трансферрин связывает железо прочно, но обратимо; норма – 2–3,8 г/л.
Ферритин – депонированное железо в клетках. Это белок апоферритин, соединенный с множеством атомов железа. На сегодняшний день ферритин – единственный международно признанный маркер запасов железа. Норма его составляет 15–20 мкг/л.

Для ЖДА характерным остается повышение уровня растворимых рецепторов трансферрина в сыворотке крови (sTfR). Растворимые рецепторы трансферрина – это белки, расположенные на поверхности клеток и обеспечивающие перенос ионов железа внутрь клетки. Рецептор состоит из двух пептидных цепей, проходящих сквозь мембрану клетки. Молекула трансферрина присоединяется к внешнему концу рецептора, после чего поглощается клеткой путем эндоцитоза. При повышенной потребности в железе увеличивается экспрессия sTfR, на поверхности клетки их становится больше. При этом внеклеточная часть рецептора подвергается расщеплению протеазами. В результате отделяется и попадает в кровь sTfR, концентрацию которого определяют с помощью иммуноферментного метода. Определение уровня sTfR помогает в дифференциальной диагностике между дефицитом железа и анемией хронических заболеваний. При ЖДА уровень sTfR существенно повышен.
У больных анемией хронических заболеваний уровень sTfR остается в норме.
После верификации ЖДА необходимо провести поиск причины снижения уровня Hb (рис. 6). Наиболее частой причиной ЖДА служат кровотечения различной локализации.
Наибольшую настороженность для участкового терапевта при ЖДА должны представлять следующие клинические ситуации:
- ЖДА у мужчин;
- ЖДА у женщин после менопаузы.
Все вышеперечисленные состояния могут быть симптомом недиагностированного рака.
Клинический пример 2. Пациент 63 лет поступил в клинику в связи со случайно выявленной микроцитарной анемией. Из анамнеза известно, что месяц назад он перенес «кишечную инфекцию», когда появились понос, снижение аппетита, резкое похудание, субфебрильная лихорадка в вечерние часы. Амбулаторно принимал антибактериальные препараты, пробиотики, ингибиторы протонной помпы, ферменты с незначительным эффектом. В поликлинике при обследовании было выявлено снижение уровня Hb до 78 г/л, MCV – 76 fl, в связи с чем пациент был направлен на госпитализацию. В стационаре, согласно алгоритму диагностики микроцитарной анемии, определено снижение уровня сывороточного железа (6 мкмоль/л), повышение уровня трансферрина до 4,5 г/л и снижение уровня ферритина до 12 мкг/л. Таким образом, выявлена ЖДА. При дальнейшем обследовании: анализ кала на скрытую кровь положительный; СА (Cancer Antigen) 19–9 – 6128 ЕД/мл, ультразвуковое исследование органов брюшной полости: очаговые изменения печени; ректоскопия: опухоль прямой кишки, взята биопсия, по результатам которой диагностирована умеренно дифференцированная аденокарцинома. Пациент переведен в специализированное учреждение для дальнейшего лечения (рис. 7).
Лечение
После верификации основной причины ЖДА необходимо начать ее лечение. Этиологическое лечение заключается в устранении причины, а в качестве патогенетической терапии применяются препараты железа.
При этом следует понимать, что:
1. Диетой восстановить запасы железа в организме нельзя, т.к. всасывание железа из пищи ограничено (максимальное количество железа, которое может всосаться из продуктов питания, – 2,5 мг/сут, тогда как из препаратов железа его всасывается в десятки раз больше).
2. Для лечения ЖДА должны использоваться преимущественно препараты железа для приема внутрь.
3. Показания к парентеральному приему препаратов железа:
- тяжелая ЖДА;
- непереносимость пероральных препаратов железа;
- нарушение всасывания, необходимость быстрого насыщения организма железом (предполагаемое оперативное вмешательство).
Несмотря на то что парентеральное введение препаратов железа быстрее повышает уровень Hb, прибегать к ним следует в отсутствие угрозы жизни только при нарушении всасывания. Препараты железа для парентерального введения часто вызывают тяжелые аллергические реакции. При внутримышечном введении возможно формирование инфильтратов и абсцессов. При ошибочном назначении препаратов железа парентерально легче развивается гемосидероз паренхиматозных органов, нежели при приеме препаратов внутрь.
4. Трансфузия эритроцитов должна проводиться только по жизненным показаниям:
- тяжелая анемия с резко выраженными явлениями гипоксии;
- анемическая прекома и кома;
- кислородное голодание тканей при продолжающемся кровотечении;
- тяжелая анемия у пациента, нуждающегося в экстренной операции;
- острая анемия, вызванная острой кровопотерей (травма, операция, роды, шок) 30 % от объема циркулирующей крови.
5. Контроль эффективности лечения оценивается по наличию ретикулоцитарного криза, нормализации уровня Hb и показателей обмена железа.
Все препараты железа делятся на препараты, содержащие двух- или трехвалентное железо (рис. 8).
Между этими двумя группами препаратов существует несколько принципиальных отличий:
Препараты 2-валентного железа существуют в виде неорганических солей и, следовательно, имеют низкомолекулярную массу, тогда как препараты 3-валентного железа – соли, связанные с высокомолекулярным полисахаридным или белковым комплексом. Благодаря такой высокомолекулярной оболочке препараты 3-валентного железа не обладают локальным раздражающим эффектом на слизистую оболочку верхних отделов желудочно-кишечного тракта и, соответственно, не вызывают ее эрозивно-язвенного поражения.
Из-за высокой молекулярной массы и большого размера молекулы всасывание 3-валентного железа является энергозатратным, а потому контролируемым процессом. Тогда как всасывание низкомолекулярных соединений 2-валентного железа происходит быстро, но бесконтрольно – путем простой диффузии. В связи с разными механизмами всасывания при применении 3-валентного железа невозможны передозировка и отравление. Тогда как при приеме препаратов 2-валентного железа из-за быстрого и неконтролируемого поступления железа могут выделяться нерастворимые осадки невсосавшегося железа, что проявляется потемнением и пожелтением эмали зубов и появлением металлического привкуса во рту. Эти симптомы зачастую служат причиной отказа пациентов с ЖДА от терапии препаратами железа.
Препараты 3-валентного железа не обладают оксидантным эффектом, в то время как окисление 2-валентного железа в 3-валентное в процессе переноса белком трансферрином сопровождается перекисным окислением липидов (ПОЛ). Отсутствие ПОЛ предотвращает окисление атерогенных фракций липопротеидов и образование свободных радикалов, что немаловажно для «сосудистых» пациентов.
В обмене железа и его регуляции принимает участие трехвалентное железо. При нормальном содержании в организме железа значительная часть его проходит через слизистую оболочку тонкой кишки в ток крови, определенная часть задерживается в слизистой оболочке.
При недостатке железа в слизистой оболочке задерживается значительно меньшая его часть, основная – оказывается в плазме. При избытке железа в организме основная часть железа, проникшего в слизистую оболочку, в ней и задерживается.
В дальнейшем эпителиальная клетка, наполненная железом, продвигается от основания к концу ворсинки, затем слущивается и выделяется с калом вместе с невсосавшимся железом. При этом доказано, что прием больших доз препаратов Fe3+ при железодефиците не может приводить к избытку железа, т.к. его излишки элементарно не усваиваются организмом. Любому врачу следует
аксиоматично помнить постулат: «трехвалентное железо умеренно всасывается в физиологических концентрациях и абсолютно не всасывается в избыточных».
При патологии двухвалентное железо из-за нарушения всасывания не может попасть в энтероцит и, соответственно, в кровоток, тогда как трехвалентное железо путем активного транспорта независимо от нарушения процессов всасывания обязательно попадает в кровоток, что приводит к устранению анемии.
Препараты трехвалентного железа, имеющие высокомолекулярную оболочку, благодаря последней практически не взаимодействуют с другими лекарственными препаратами, что немаловажно в связи с высокой распространенностью коморбидных состояний.
Как известно, динамику лечения ЖДА препаратами железа необходимо лабораторно контролировать с учетом следующих критериев:
Изменение содержания ретикулоцитов. Ретикулоцитарный криз (увеличение ретикулоцитов до 10–20 ‰) выявляется на 3–7-е сутки от начала лечения препаратами железа.
Прирост уровня Hb. Начинается с 5-х суток при правильном лечении. Если в течение этого периода прироста Hb нет, это говорит о плохом усвоении препаратов железа. Нормальным считается прирост Hb 1 % в сутки, или на 0,15 г/сут.
Восстановление числа эритроцитов и цветового показателя за месяц.



