Численность больных сахарным диабетом во всех странах мира увеличивается и к 2030 г. превысит 550 млн человек [1, 2]. В России почти 22 тыс. больных ежегодно проводятся ампутации стоп или более высокие ампутации нижних конечностей в результате осложнений, связанных с сахарным диабетом [3].
Наряду с поражением сосудов диабетическая нейропатия остается ведущей причиной поражения нижних конечностей больных сахарным диабетом. Это осложнение приводит к снижению трудоспособности, инвалидизации [4, 5].
В зависимости от методов и критериев диагностики, применяемых для выявления диабетической нейропатии, частота ее варьируется от 10 до 90 %. В среднем частота диабетической нейропатии у больных сахарным диабетом составляет 30–50 %, а при применении электрофизиологических методов исследования для выявления субклинических форм может составлять 90–100 % [6]. Частота развития диабетической нейропатии у пациентов с сахарным диабетом 1 и 2 типов почти одинакова, однако, поскольку сахарный диабет 2 типа часто имеет латентное, скрытое течение, диабетическая нейропатия у этих пациентов выявляется уже в момент манифестации заболевания. Было отмечено, что часть (около 5 %) пациентов обращаются к врачу именно с симптомами диабетической нейропатии еще до выявления диагноза сахарного диабета [1, 7].
Безусловно частота выявления диабетической нейропатии зависит от длительности сахарного диабета и успешности его лечения. В то же время прямая зависимость между тяжелым течением сахарного диабета и развитием осложнений выявляется не всегда. Согласно теории «метаболической памяти», ранние нарушения метаболизма и хроническое воспаление в сосудистой стенке могут оказывать влияние, способствовать развитию и прогрессированию осложнений, в т.ч. диабетической нейропатии, даже при дальнейшем хорошем контроле сахарного диабета.
Существует несколько классификаций диабетической нейропатии [2, 8]. Ниже представлена «современная» ее классификация.
1. Генерализованные симметричные нейропатии:
- сенсомоторная (дистальная, хроническая);
- сенсорная (острая);
- гипергликемическая нейропатия.
2. Автономные (вегетативные) нейропатии:
- сердечно-сосудистая;
- желудочно-кишечная;
- мочеполовая;
- нарушение потоотделения;
- нарушение регуляции сужения зрачка;
- автономная афферентная.
3. Фокальные и мультифокальные нейропатии:
- краниальная;
- пояснично-грудная радикулонейропатия;
- проксимальная диабетическая нейропатия;
- фокальные тоннельные нейропатии;
- проксимальная моторная нейропатия (амиотрофия).
4. Хроническая воспалительная демиелинизирующая нейропатия.
Наиболее распространенной формой диабетической нейропатии остается дистальная симметричная сенсомоторная полинейропатия (ДПН). Данную патологию определяют как наличие признаков и/или симптомов, свидетельствующих о поражении периферического отдела нервной системы у лиц с сахарным диабетом при исключении других причин нейропатии. Другие причины поражения периферических нервов при сахарном диабете могут составлять до 10 % случаев, наиболее частые из них – алкоголизм, аутоиммунные заболевания, дефицит витаминов группы В, нарушение функции щитовидной железы, обмена кальция, паранеопластические синдромы, отравление тяжелыми металлами, сифилис и идиопатические невропатии.

Факторы риска развития и прогрессирования ДПН: гипергликемия, длительность сахарного диабета, дислипидемия, артериальная гипертензия, наличие у пациента ретино-, нефропатии и кардиальной автономной нейропатии, макроангиопатии, возраст пациента и имеющиеся вредные привычки (курение, алкоголь) [6].
В патогенезе ДПН играют роль и метаболические изменения – активация полиолового пути окисления глюкозы, оксидативный стресс, нарушение образования фактора роста нерва, неферментативное гликирование компонентов клеточных мембран, дефицит миоинозитола и нарушения кровоснабжения нервного волокна, что сопровождается снижением образования оксида азота, эндоневральной гипоксией в результате снижения гибкости эритроцитов и изменений реологии крови [1, 3, 9].
Клиническая картина ДПН зависит от стадийности процесса. При субклинической стадии нейропатии симптомов и признаков, характерных для ДПН, может не выявляться. Эта стадия может быть диагностирована только с помощью специфических нейрофизиологических методов (электромиография, электронная термометрия).
Для клинической стадии ДПН характерно возникновение сначала сенсорных нарушений в дистальных отделах – пальцы, стопы с последующим распространением на голени. Выделяют т.н. позитивные и негативные симптомы ДПН. «Позитивная» симптоматика больше характерна для ранних периодов клинической стадии, проявляется болью, парестезией, дизестезией, усиливающихся ночью. Появление таких симптомов может отмечать до четверти всех пациентов с ДПН, их связывают с появлением очаговой демиелинизации с образованием зон гипервозбудимости. Нарушение чувствительности при ДПН всегда преобладает над двигательными, что связано с преимущественным поражением тонких миелинзированных волокон. С прогрессированием ДПН уровень поражения постепенно симметрично перемещается на более высокие локализации – голени, иногда кисти рук. Появляется типичное для ДПН снижение чувствительности по типу «носки–перчатки». На данном этапе начинают преобладать «негативные» симптомы, характерные уже для поздней, тяжелой, клинической стадии: онемение, зябкость, слабость, утрата устойчивости при ходьбе. Нарушаются все виды чувствительности: болевая, тактильная, температурная, вибрационная, проприоцептивная. В дальнейшем прогрессирующее нарушение функции нервных волокон приводит к развитию слабости мышц нижних конечностей, их гипо- и атрофии. Следствием атрофии внутренних мышц стопы является опущение ее свода и формирование плоской стопы, различных нейропатических деформаций пальцев – т.н. стопы риска. В зонах риска такой стопы могут развиваться нейропатические язвы, диабетическая нейроостеоартропатия, асептическая деструкция костей стопы (стопа Шарко) – эти проявления характеризуют стадию осложнений ДПН. Все эти состояния имеют высокий риск ампутаций с последующей инвалидизацией пациентов [10].
С целью диагностики ДПН используют опросники для оценки симптомов, стандартное клиническое обследование, количественные сенсорные тесты, биомеханические методы и электромиографию.
При анализе опросников нужно помнить, что не всегда жалобы пациента объективно отражают тяжесть ДПН. Для объективной оценки симптомов ДПН применяются стандартные методики определения порога всех видов чувствительности и исследование рефлексов, для определения степени тяжести ДПН проводится количественная оценка в соответствии со шкалой NISLL, TSS. Количественная оценка чувствительности позволяет контролировать интенсивность подачи стимула и получать значение порога болевой, температурной и вибрационной чувствительности в параметрических единицах. Такие исследования позволяют оценивать состояние различных видов чувствительности на субклинических стадиях для ранней диагностики диабетической нейропатии. С целью ранней диагностики нейропатии с поражением немиелинизированных волокон может применяться конфокальная микроскопия роговицы [3].
Наиболее объективную информацию о состоянии крупных миелинизированных нервных волокон можно получить с помощью электромиографии.
В исследовании DCCT было показано, что в группе больных с интенсивным наблюдением значительное снижение скорости распространения возбуждения было выявлено лишь среди 16,5 % больных, а в группе с традиционным лечением – среди более чем 40 %, что подтверждает роль гипергликемии в развитии нейропатии [11].
Для диагностики атипичных форм нейропатии, а также для оценки эффективности патогенетической терапии может применяться биопсия икроножного нерва. Высокой чувствительностью обладает метод биопсии кожи – даже пациентов с нарушением толерантности к глюкозе и лиц без признаков поражений нервной системы, по данным нейромиографии или количественных методов оценки. С его помощью удается получить морфологическую картину, количественно отражающую состояние иннервации кожи мелкими нервными волокнами. Единственный метод, позволяющий оценивать состояние мелких немиелинизированных волокон, – конфокальная микроскопия роговицы, полностью отражающая степень нарушения периферической нервной системы [3].
Нормализация углеводного обмена, как показали исследования DCCT и UKPDS, играет значимую роль, но не предотвращает развития и прогрессирования ДПН у больных сахарным диабетом [11, 12].
В настоящее время не вызывает сомнений, что наряду с нормализацией углеводного обмена и коррекцией дислипидемии [13] существует необходимость проведения патогенетической терапии ДПН. Имеют место две возможности воздействовать на метаболические нарушения при ДПН: уменьшение выраженности оксидативного стресса с помощью антиоксидантов и уменьшение концентрации промежуточных продуктов гексозоаминового пути утилизации глюкозы через активацию фермента транскетолазы, которая направляет их в пентозно-эритрозный шунт. Активность фермента транскетолазы, который является конституциональным и у человека не имеет полиморфизма, зависит только от содержания в организме тиамина.
Альфа-липоевая (тиоктовая) кислота (АЛК) – мощный естественный жирорастворимый антиоксидант. Ее способность действовать в качестве ловушки свободных радикалов многократно подтверждена в экспериментальных и клинических исследованиях [14].
В исследованиях ALADIN, ALADIN III, SYDNEY I и NATHAN II у пациентов, которым вводили внутривенно 600 мг АЛК в течение 3 недель, было выявлено достоверное, более чем на 50 % улучшение симптоматики – и позитивной, и негативной, что было подтверждено и результатами электрофизиологических методов исследования. Улучшение по шкале TSS наблюдалось в течение месяца после 3-недельного курса инъекций АЛК с сохранением эффекта до 6 месяцев [15–17].
В отношении таблетированных форм АЛК также был проведен ряд исследований, в результате были получены противоречивые данные в отношении эффективной дозы. В исследовании DEKAN было установлено, что эффективной дозой АЛК остается 800 мг в сутки [15], в исследовании ORPIL было показано, что дозировка 1800 мг достоверно в большей степени позволяет уменьшать баллы по шкале TSS. В ряде других исследований показано, что применение АЛК в дозе 600 мг/день в/в или перорально в течение от трех недель до шести месяцев значимо уменьшает главные симптомы ДПН [18, 19]. Оптимальным считается назначение в начале лечения внутривенного введения АЛК в дозе 600 мг в течение 3 недель с последующим приемом 600 мг препарата в виде таблеток в течение 1–2 месяцев.
В литературе широко обсуждается применение антиоксиданта, содержащего экстракт листьев гинкго двулопастного (EGb 761). Препарат доказал свою эффективность в плане уменьшения оксидативного стресса, благоприятного воздействия на реологические свойства крови и состояние сосудистой стенки. В ряде исследований было показано не только уменьшение симптоматики по шкале TSS, улучшение функции периферических нервов по данным электромиографии, но и благоприятное воздействие на течение ретинопатии при его применении [20, 21].
Вторым моментом в патогенетической терапии ДПН является воздействие на активность фермента транскетолазы, которая зависит от концентрации тиамина. Все гипотезы о возможности влияния тиамина на метаболические нарушения вследствие гипергликемии были подтверждены H.P. Hammes et al. (2003), которые установили влияние тиамина на активность транскетолазы, предотвращающей поражение сосудов сетчатки [22]. Пациентами с сахарным диабетом применяется водорастворимый тиамин (гидрохлорид, нитрат, дисульфид) в виде внутримышечных инъекций, а также жирорастворимый тиамин (бенфотиамин) в виде таблеток. Введение в/м водорастворимого тиамина (100 мг) в комбинации с другими витаминами группы В (пиридоксин 100 мг, цианкобаламин 1000 мкг) в виде комбинированных препаратов используется на начальном этапе лечения ДПН, когда необходимо быстро достичь эффекта. Для длительного и профилактического лечения, как показали исследования BEDIP и BENDIP, целесообразно использовать комбинацию витаиминов В1 и бенфотиамина – жирорастворимой формы тиамина, имеющей наибольшую биодоступность, способность проникать в клетку и, соответственно, активность [23–25]. Одновременное использование для лечения ДПН антиоксидантов и тиамина представляется не только возможным, но и необходимым, т.к. препараты действуют на различные звенья патогенеза ДПН [26, 27].

Высокую клиническую эффективность, хорошую переносимость и безопасность, по данным двойного слепого многоцентрового плацебо-контролируемого исследования 569 больных ДПН в 2008 г., показал препарат на основе депротеинизированного гемодеривата из телячьей крови [28–33].
Часто причиной обращения пациентов с ДПН к врачу является болевой синдром. Согласно европейским рекомендациям, препаратами первой линии лечения невропатической боли являются антиконвульсанты, антидепрессанты и местные анестетики [34]. Нестероидные противовоспалительные препараты не используются для лечения невропатической боли в связи с их неэффективностью [35]. Благодаря исследованию EPIC значительно увеличилось число больных, которым было назначено лечение препаратами первой линии [36].
Трициклические антидепрессанты стали одними из первых препаратов, показавших эффективность в лечении пациентов с болевым синдромом [37]. Препараты этой группы имеют ряд побочных эффектов, в связи с которыми их применение имеет определенные ограничения [27]. Эффективность применения трициклических антидепрессантов при лечении болевой формы ДПН показана в ряде рандомизированных плацебо-контролируемых исследований [38, 39]. Наиболее широко используется амитриптилин. Начальная доза препарата составляет 10,0–12,5 мг на ночь, максимальная дозировка – 150 мг/сут. При плохой переносимости трициклических антидепрессантов применяют селективные ингибиторы обратного захвата серотонина и норадреналина (венлафаксин 150–225 мг/сут, или дулоксетин 60–120 мг/сут) [40–44]. Другие селективные ингибиторы обратного захвата серотонина – флуоксетин, пароксетин, сертралин, циталопрам, эсциталопрам – показаны, когда боль связана с депрессией, а больной плохо переносит другие антидепрессанты.
Для лечения болевого синдрома при ДПН применяются также антиконвульсанты, из них наиболее широко назначаемый в России – прегабалин [45]. Действующее вещество препарата ПрегабалинРихтер – прегабалин, представляет собой аналог гамма-аминомасляной кислоты ((5)-3-(аминометил)-5-метилгексановая кислота). Механизм действия Прегабалина-Рихтер основан на способности связываться с альфа-2-дельта-субъединицами потенциалзависимых кальциевых каналов в центральной нервной системе, необратимо замещая (3Н)-габапентин. В ответ происходит снижение входа кальция в пресинаптический нейрон и уменьшение высвобождения главных медиаторов боли (глутамата, норадреналина и субстанции Р) перевозбужденными нейронами, что в итоге приводит к ликвидации болевого синдрома (рис. 1).
Прегабалин обладает хорошей переносимостью и высокой эффективностью уже с 1-й недели лечения. Наиболее частыми побочными эффектами являются головокружение и сонливость. Препарат обладает линейной фармакокинетикой, что обеспечивает предсказуемость изменений концентрации препарата в плазме крови при изменении дозы.
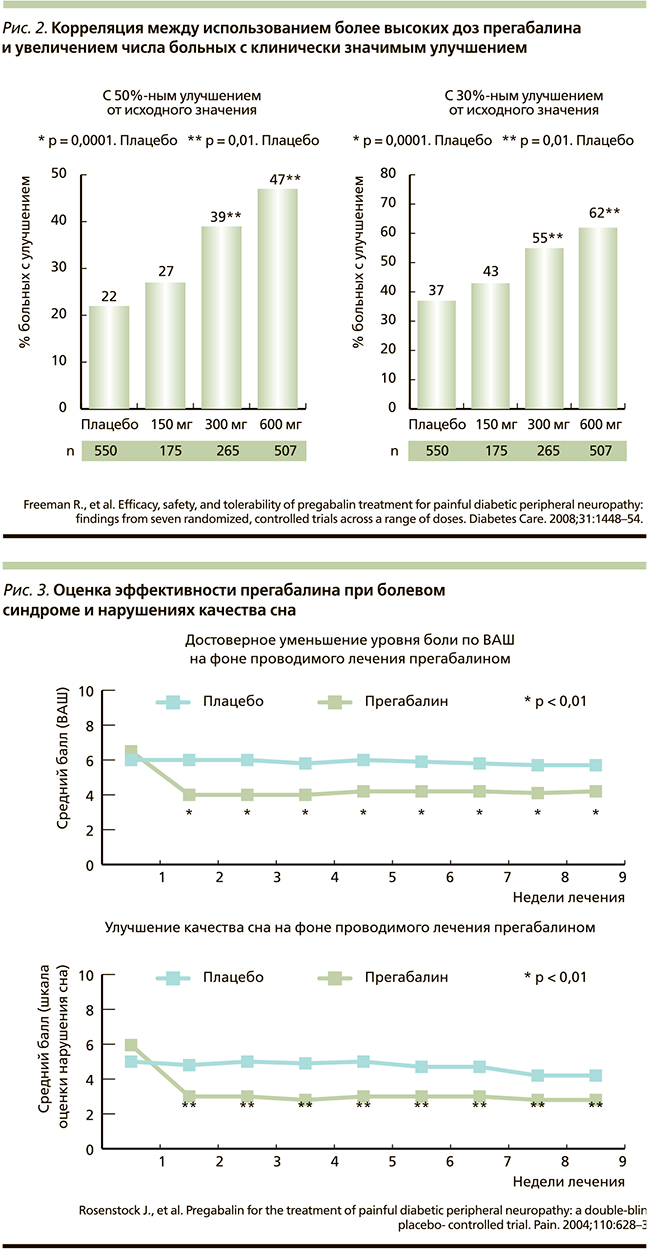
Прегабалин-Рихтер применяют внутрь независимо от приема пищи в дозе от 150 до 600 мг/сут в 2 приема. Начальная доза его составляет 150 мг/сут. В зависимости от достигнутого эффекта и переносимости через 3–7 дней дозу можно увеличить до 300 мг/сут, а при необходимости еще через 7 дней – до максимальной дозы 600 мг/сут. Была обнаружена корреляция между использованием более высоких доза прегабалина и увеличением числа больных с клинически значимым улучшением. Достоверное уменьшение боли наблюдалось с 4-го дня терапии, максимальный эффект обнаружен на суточной дозе 600 мг (рис. 2).
Прегабалин-Рихтер быстро всасывается в кровь и обладает более высокой биодоступностью (90 %) по сравнению с габапентином. Вследствие этого препарат эффективен в меньших дозах, обладает меньшей частотой и выраженностью побочных эффектов [45, 46].
Пациентам с нарушенной функцией почек дозу подбирают индивидуально с учетом клиренса креатинина. Клиренс прегабалина прямо пропорционален клиренсу креатинина. Учитывая, что прегабалин в основном выводится почками, пациентам с нарушением их функции рекомендуется снижать дозу прегабалина. Прегабалин удаляется из плазмы крови при гемодиализе, после 4-часового сеанса концентрация его в плазме крови снижается примерно на 50 %. В связи с этим после гемодиализа необходимо назначать дополнительную дозу препарата. Из-за снижения функции почек пациентам старше 65 лет может потребоваться уменьшение дозы прегабалина. Пациентам с нарушением функции печени коррекции дозы препарата не требуется. При необходимости отмены препарата рекомендуется постепенно снижать дозу в течение недели.
Результаты анализа более десяти рандомизированных двойных слепых плацебо-контролируемых исследований эффективности прегабалина при болевой ДПН и постгерпетической невралгии показали, что улучшение качества жизни больных при лечении прегабалином связано как с уменьшением болевого синдрома, так и с анксиолитическим действием препарата (рис. 3) [47].
Европейские и мировые рекомендации по лечению невропатической боли относят прегабалин к первой линии терапии (см. таблицу) [48, 49]. Прием прегабалина можно сочетать с назначением антидепрессантов, витамина В12.
Применение местных анестетиков (кремов, гелей и пластырей с 5 %-ным содержанием лидокаина или препаратов на основе экстрактов жгучего перца – капсаицина) в ряде исследований показало эффективность при лечении болевой формы ДПН [50].
В то же время необходимо отметить, что нельзя рассматривать монотерапию как предпочтительный метод лечения боли при ДПН, назначение препаратов с разным механизмом действия поможет достигать наилучшего результата.



