Сахарный диабет (СД) известен с древнейших времен. Какие только средства ни использовала медицина минувших столетий, чтобы хоть как-то смягчить страдания пациентов. В ход шли различные настойки [1], экстракты, минеральные воды [2], опиум [3, 4], кровопускание и даже креозот [5]. Нередко в медицинской периодике XIX в. можно встретить описание клинических случаев, которое сейчас сложно назвать иначе, кроме как «хроникой убийства» пациентов с СД 2 типа (СД2) со стороны врача. Все потому, что медицинские работники того времени имели тенденцию сосредотачиваться на краткосрочных эффектах медицинского вмешательства при оценке его полезности для пациента. Так, поскольку кровопускание (сливание 1–2 стаканов крови, зачастую ежедневно) приводило к значимому смягчению полиурии в случае выраженного СД2, а также сопровождалось эйфорией [6], врач делал вывод об «эффективности» такого метода лечения, не задумываясь о его (скажем так, «среднесрочной») безопасности. И конечно же, в итоге пациент в представлении врача мог умереть вовсе не от ежедневной кровопотери, а сугубо от злокачественности своего недуга.
Десятки веков разделяют первое подробное описание СД в литературе (I в. н.э.) и изобретение первого действительно эффективного и сравнительно безопасного фармакологического агента инсулина в 1922 г. Спустя пару лет после этого грандиозного открытия на сцену выходит первый эффективный пероральный препарат — синталин (предшественник бигуанидов). Однако относительно высокая распространенность гепатотоксичности среди пациентов, принимавших его, привела к тому, что к началу 1940-х гг. он полностью вышел из обращения. Почти то же самое случилось в 1970-е гг. с популярным в то время фенформином из-за накопления свидетельств о повышенном риске грозного осложнения лактатацидоза, при развитии которого умирал примерно каждый второй пациент. К тому времени количество смертей, вызванных этим осложнением, по мнению некоторых, стало преобладать над любыми возможными преимуществами от его использования.
Но особый резонанс совсем недавно (в 2007 г.) вызвал набравший к тому времени большую популярность препарат росиглитазон. Был опубликован мета-анализ 42 клинических исследований с росиглитазоном (15 565 пациентов на росиглитазоне и 12 282 – в группах сравнения), суммарные данные которого позволили установить, что росиглитазон, возможно, и статистически значимо увеличивал риск инфаркта миокарда у пациентов с СД2 – на 43 % (95 % доверительный интервал [ДИ] – 1,03–1,98; p = 0,03). И это при том, что «двойник» росиглитазона пиоглитазон в мета-анализах тех же лет демонстрировал абсолютно противоположные результаты. Два тиазолидиндиона (пиоглитазон и росиглитазон) – и такие разные профили сердечно-сосудистой безопасности!
После этих открытий стало ясно: проецировать данные о безопасности одного представителя класса гипогликемических средств на другие представители того же класса нежелательно и может обойтись слишком дорого для пациентов. И Администрация по продуктам питания и медикаментам (Food and Drug Administration) Минздрава США ввела требование ко всем новым гипогликемическим лекарствам — подтвердить их сердечно-сосудистую безопасность в крупных исследованиях, обладающих достаточной статистической мощностью. По некоторым диабетическим продуктам, которым FDA отказала в регистрации, этих данных мы можем не получить никогда, потому что их производители технически не обязаны проводить крупные исследования, посвященные данной проблеме, – такие исследования-гиганты, как SAVOR (Saxagliptin Assessment of Vascular Outcomes Recorded in Patients with Diabetes Mellitus), о котором пойдет речь в данной статье.
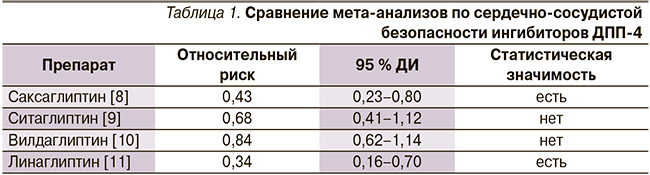
К моменту появления результатов SAVOR были проведены мета-анализы по всем зарегистрированным в России представителям группы ингибиторов дипептидилпептидазы-4 (ДПП-4; саксаглиптин, ситаглиптин, вилдаглиптин, линаглиптин). Согласно этим мета-анализам, вилдаглиптин и ситаглиптин не оказывали влияния на риск сердечно-сосудистых исходов, а саксаглиптин и линаглиптин предварительно имели благоприятные статистически значимые эффекты, снижая сердечно-сосудистый риск более чем в 2 раза (табл. 1).
Учитывая, что эти мета-анализы не позволяли сделать достоверных и окончательных выводов о сердечно-сосудистой безопасности представителей группы ингибиторов ДПП-4, каждый производитель (кроме вилдаглиптина, которому FDA отказала в регистрации) организовал специальное крупное исследование, посвященное оценке сердечно-сосудистой безопасности (табл. 2). В эту табл. 2 также включено небольшое исследование вилдаглиптина на пациентах с хронической сердечной недостаточностью, результаты которого появились на сайте Европейского общества кардиологии в формате пресс-релиза в мае 2013 г. [7].
Исследование SAVOR — это самое крупное по количеству включенных пациентов исследование в диабетологии за всю ее историю. Один этот факт привлекает к SAVOR столько внимания. А саксаглиптин — препарат, сердечно-сосудистой безопасности которого исследование SAVOR посвящено.
В SAVOR целенаправленно набирали пациентов с СД2 (с уровнем гликированного гемоглобина HbA1c 6,5–11,9 %) и высоким риском сердечно-сосудистых событий. Кандидат на включение должен был либо обладать хотя бы одним из трех факторов сердечно-сосудистого риска (артериальная гипертензия, дислипидемия, курение) в сочетании с возрастом не младше 55 лет для мужчин и 60 лет для женщин, либо иметь в анамнезе эпизод, связанный с атеросклерозом коронарных, церебральных или периферических артерий в сочетании с возрастом не младше 40 лет (для обоих полов).
В результате в исследование были набраны 16 492 пациента, половина которых случайным образом была распределена в группу, получающих саксаглиптин, и половина – в группу плацебо. Исследование было двойным слепым – о том, что принимает участник исследования (саксаглиптин или плацебо), не знал ни пациент, ни его врач на протяжении всего исследования. Длительность данного вмешательства составила примерно 2 года.
В исследование целенаправленно не включали пациентов, которые в течение последних 6 месяцев получали терапию ингибиторами ДПП-4 или агонистами глюкогоноподобного пептида-1 (ГПП-1), а также больных на хроническом диализе, после трансплантации почки и с уровнем креатинина сыворотки крови выше 530 мкмоль/л (6 мг/дл). Также при скрининге исключались пациенты, которые за последние 2 месяца перенесли острое сосудистое событие (коронарное или церебральное), а также пациенты с индексом массы тела (ИМТ) > 50 кг/м2 или постоянным уровнем артериального давления > 180/100 мм рт. ст.
Важно, что, не владея информацией о том, какой исследуемый препарат получает участник исследования (саксаглиптин или плацебо), исследователь и другие лечащие врачи имели полную свободу в плане изменения гипогликемической фармакотерапии по всем неинкретиннаправленным агентам – существовала возможность титрации дозы, назначения или отмены прочих лекарств. Данные показывают, что врачи пользовались этой возможностью по интенсификации терапии, причем существенно чаще – в группе плацебо. В частности, к концу исследования значимо больше пациентов получали инсулин на фоне плацебо, чем на фоне саксаглиптина (p = 0,0008). И если перед началом исследования в группу саксаглиптина попало меньше пациентов, не получавших ни одного гипогликемического препарата (4,1 против 4,8 %; p = 0,0496), то к его окончанию (через 2 года) доли таких пациентов в группах сравнялись (5,0 против 4,7; p = 0,43).
Уровень HbA1c до начала исследования в среднем составлял 8,0 ± 1,4 % в каждой из групп, а длительность СД в среднем равнялась 10,3 года. Средний ИМТ в группах был равен 31,1 и 31,2 кг/м2 соответственно.
В результате использования исследуемого препарата и модификации прочей терапии в группе саксаглиптина уровень HbA1c через 2 года снизился в среднем до 7,5 %, а в группе плацебо – до 7,8 %. Доля пациентов, достигших HbA1c < 7,0 %, в группе саксаглиптина через 2 года увеличилась с 25,0 до 40,0 %, в группе плацебо – с 25,9 до 30,3 %. Первичной конечной точкой в SAVOR была совокупная частота развития нефатального инфаркта миокарда, нефатального ишемического инсульта и сердечно-сосудистой смерти.
В результате исследования через 2 года соотношение рисков развития первичной конечной точки между группами на саксаглиптине и плацебо составило 1,00 (95 % ДИ – 0,89–1,12; p = 0,99 для превосходства; p < 0,001 для «непроигрышности»). То есть совокупный риск развития указанных сердечно-сосудистых событий на саксаглиптине не отличается от плацебо. Таким образом была подтверждена сердечно-сосудистая безопасность саксаглиптина.
Вторичные конечные точки в исследовании оценивали безопасность саксаглиптина по иным направлениям.
В частности, исследование SAVOR положило конец спекуляциям относительно возможного увеличения риска развития панкреатита и рака поджелудочной железы. Данный вопрос периодически поднимался в отношении инкретиннаправленной терапии.
Но именно для саксаглиптина теперь доказана безопасность в отношении этих событий. Через 2 года в обеих группах распространенность всех видов панкреатита не различалась и составила по 0,3 % (p = 0,77). В группе саксаглиптина распространенность онкологических заболеваний была зарегистрирована на уровне 3,9 % , в то время как на фоне плацебо она составила 4,4 % (p = 0,15), причем на фоне саксаглиптина было выявлено 5 случаев рака поджелудочной железы, а в группе плацебо – 12 (p = 0,095; различие статистически незначимо).
Исследование SAVOR дало всем практикующим эндокринологам большую уверенность в том, что саксаглиптин при использовании у пациентов с СД2 и повышенным сердечно-сосудистым риском не оказывает дополнительного негативного эффекта на этот и без того высокий риск.

Однако использование саксаглиптина пациентами с сопутствующей (особенно выраженной) сердечной недостаточностью требует дальнейшего изучения. В исследовании SAVOR в группе саксаглиптина частота госпитализаций по поводу сердечной недостаточности составила 3,5 % по сравнению с 2,8 % в группе плацебо (выше на 27 %; 95 % ДИ для отношения рисков – 1,07–1,51; p = 0,007). Однако смертность в результате сердечной недостаточности между группами не различалась (по 0,5 % за 2 года). Данные результаты важно рассматривать в контексте исследования VIVIDD [7] по вилдаглиптину, который испытывался у пациентов с СД2 и хронической сердечной недостаточностью, результаты которого были опубликованы в виде пресс-релиза в мае 2013 г. В VIVIDD за 52 недели исследования в группе вилдаглиптина процент пациентов, умерших от всех причин, был в 2,7 раз выше, чем в группе плацебо (8,6 против 3,2 %). Доверительный интервал и величина «p» по общей смертности в пресс-релизе VIVIDD (май 2013 г.) не сообщаются. Никаких дополнительных публикаций по результатам этого исследования обнаружить на начало марта 2014 г. не удалось.
Все это еще раз подтверждает тезис о том, что переносить данные о сердечно-сосудистой безопасности одного лекарственного препарата на другой, пусть и в рамках одной фармакологической группы, для гипогликемических средств не безопасно.
Хотелось бы завершить статью цитатой из книги 1808 г. [6], в которой автор хронологически последовательно и подробно описывает клинические случаи СД 2 типа, когда он использовал для «лечения» ежедневное кровопускание. Это всего один из нескольких дней, в которых сливание очередного немыслимого, по современным меркам, количества крови сопровождается оптимистичным описанием быстрого улучшения состояния пациента и хорошей переносимости «лечебной» процедуры. Пусть это описание будет предостережением всем нам в отношении того, что, не имея на руках результатов крупных хорошо спланированных исследований и ориентируясь на оценку лишь лежащих на поверхности симптомов, можно совершить фатальные ошибки, вызывая недоумение у потомков, точь-в-точь как автор следующего опуса: «Я слил 400 мл крови из его руки достаточно полной струей. Он хорошо перенес операцию, все время сидел и не испытывал ни малейших предвестников обморока. Пульс перед кровопусканием был 60, очень слабый и не очень регулярный. После кровопускания – 58 и более наполненный. Кровь была слита в две большие чашки… [Следующий день] После кровопускания он гулял в течение оставшегося дня; был более весел и чувствовал себя лучше – его жажда не была столь сильной, как в предыдущие дни. К вечеру он проголодался и с удовольствием съел немного поджаренной на гриле баранины. Спал хорошо и сходил по маленькому всего 4 раза за ночь» [6].



