Вопросы профилактики, диагностики и лечения острых инфекционных болезней органов дыхания у детей всегда были и остаются в центре внимания педиатров [1]. Острые респираторные инфекции (ОРИ) – наиболее частая инфекционная патология у детей, характеризующаяся сезонным осенне-зимним подъемом и способностью вызывать вспышки заболеваний в организованных коллективах [2]. Термин «острая респираторная инфекция» охватывает массу заболеваний, вызываемых различными респираторными патогенами. Преимущественным местом размножения и патогенного воздействия респираторных возбудителей служит слизистая оболочка верхних дыхательных путей, однако инфекция охватывает весь респираторный тракт, начиная от носовых ходов и до терминальных бронхиол, а также альвеол, что в итоге определяет клинические проявления заболевания. В зависимости от локализации поражения респираторного тракта принято выделять различные варианты инфекции верхних (ринит, назофарингит, тонзиллофарингит и др.) и нижних (ларинготрахеит, трахеит, бронхит, пневмония) дыхательных путей. В большинстве (90 %) случаев, когда удается обнаружить возбудителей с помощью культуральных, серологических или молекулярно-генетических методов, причиной развития ОРИ служат респираторные вирусы, что оправдывает использование термина «острая респираторная вирусная инфекция» – ОРВИ, в остальных случаях ОРИ имеют бактериальную или вирусно-бактериальную природу (табл. 1) [2–3].
Возбудителями ОРИ вирусной этиологии являются представители разных вирусных семейств, многие вирусы неоднородны по своей антигенной структуре и имеют несколько серотипов, что во многом может затруднять клиническую диагностику, т.к. это в свою очередь определяет разнообразие клинических проявлений одной и той же инфекции. Одними из самых распространенных остаются риновирусы (известно более 100 штаммов возбудителя), вызывающие заболевание в более трети случаев ОРВИ. Наряду с риновирусами причиной ОРИ служат аденовирусы, вирусы парагриппа, респираторно-синтициальный вирус (РС-вирус), энтеровирусы, а в период эпидемических вспышек – вирусы гриппа.
В настоящее время, по данным отечественных и зарубежных исследований, имеются особенности эпидемиологии и этиологической структуры острых инфекций дыхательных путей. В последние годы, особенно последние 5 лет, в мире сложилась уникальная эпидемиологическая ситуация по гриппу. Она обусловлена тем, что населению планеты одновременно угрожают циркулирующие штаммы сезонного гриппа A(H1N1), A(H3N2), В. Причем в последние годы сложилась ситуация, когда актуальность представляют две эволюционные линии вируса гриппа В, к сожалению, не обеспечивающие перекрестного единого иммунитета и создающие проблему в плане возможности несовпадения штаммого состава сезонных вакцин. Продолжает сохранять актуальность пандемический вирус гриппа A(H1N1)pdm09, при этом появилась реальная угроза широкого распространения птичьего гриппа A(H5N1), A(H7N9) и реассортанта вируса гриппа A(H3N2)swl. Кроме того, за последние годы много исследований было посвящено роли таких «новых» инфекций, как корона-, бока- и метапневмовирусная, которые в структуре респираторной вирусной заболеваемости, по различным данным, составляют от 10 до 20 % (особенно в сочетании с другими респираторными вирусами) [4–7].

Сегодня уже известно, что важными этиологическими агентами в развитии инфекций верхних дыхательных путей, а также бронхиолитов и пневмонии, крупа и обострения бронхиальной астмы являются не только вирусы гриппа и РС-вирус, но и рино-, адено-, метапневмовирусы человека, а также герпесвирусы и атипичные возбудители [3, 8–11]. Например, возбудителями внебольничных пневмоний наряду с наиболее значимым патогеном для данной патологии Streptococcus pneumoniae могут быть и РС-вирус, и риновирусы. Причем, если для взрослых при внебольничных пневмониях вирусной этиологии актуальны чаще всего вирусы гриппа, корона- и аденовирусы, то у детей спектр этиологически значимых вирусных возбудителей пневмоний гораздо шире и чаще обнаруживаются вирусные и вирусно-бактериальные ассоциации [12–14].
ОРИ из-за высокого риска развития осложнений в любые сроки от начала болезни – серьезная проблема для здоровья, особенно детей [15]. Но наиболее тяжелым заболеванием по течению и риску развития осложнений из всех ОРИ остается грипп. Ежегодно только во время сезонных вспышек в мире заболевают гриппом до 5 млн человек, смертность от гриппа в период эпидемий в разных возрастных группах колеблется от десятков до сотен случаев, а в период пандемии показатель может достигать 1000 случаев на 100 тыс. населения [16, 17]. Результаты 8-летнего эпидемиологического исследования, проведенного Центром по контролю и профилактике заболеваний (CDC – Centers for Disease Control and Prevention) в период с октября 2004 по сентябрь 2012 г. в США, показали, что риск летального исхода при гриппе высок и для детей с хронической патологией, и для здоровых детей. По данным исследования, более трети заболевших гриппом детей погибали до госпитализации, в течение 3 дней от начала появления первых симптомов заболевания средний возраст умерших пациентов составил 7 лет (вероятное отклонение: 1–12 лет). Из 794 связанных с гриппом смертельных исходов в 43 % случаев дети не имели повышенного риска заболевания. В то же время данные исследования подтвердили повышенный риск развития осложнений, включая высокий уровень смертности среди детей с сопутствующими заболеваниями: 33 % умерших детей страдали от неврологических патологий, 12 % – от генетических или хромосомных нарушений. Авторы подчеркивают, что своевременное применение противогриппозных препаратов могло бы уменьшить тяжесть заболевания и осложнений, однако сведениями о проведении противогриппозной химиотерапии располагали лишь менее половины умерших детей [18].
Эффективным методом профилактики инфекций является вакцинация – активная иммунизация, приводящая к развитию специфической невосприимчивости к инфекционным агентам [19]. В настоящее время вакцинация проводится против таких возбудителей респираторных инфекций, как грипп, пневмококковая и гемофильная (Hib – Haemophilus influenzae type b) инфекции. В связи с постоянными генетическими и антигенными изменениями вирусов гриппа Всемирная организация здравоохранения (ВОЗ) рекомендует ежегодную вакцинацию до начала сезона (http://www.who.int/ru/).
Специфическая профилактика гриппа осуществляется вакцинами, которые готовятся из актуальных штаммов вируса, рекомендуемых ВОЗ для нового эпидемического сезона, состав вакцин содержит 3 штамма: 2 – подтипов A(H1N1), A(H3N2) и 1 – вируса гриппа В. Кроме того, в текущем сезоне 2013–2014 гг. в США, Канаде и ряде стран Европы были одобрены к применению, в т.ч. детьми, четырехкомпонентные вакцины, содержащие 4 штамма: по 2 – каждого подтипа вирусов гриппа А и В (http://www.cdc.gov/flu/protect/vaccine/index.htm).
Сегодня важным моментом в профилактике респираторных инфекций у детей является возможность вакцинации против гемофильной и пневмококковой инфекций, являющихся причиной острого инфекционного заболевания у детей преимущественно в возрасте до 5 лет, а также связанных с тяжелыми бактериальными осложнениями гриппа и ОРВИ. Результаты недавнего исследования распространенности в России внебольничной пневмонии и острого среднего отита у детей в возрасте до 5 лет, проведенного в рамках программы PAPIRUS (Prospective Assessment of Pneumococcal Infection in Russia), подтвердили высокую частоту этих заболеваний, продемонстрировали ведущую роль S. pneumoniae и H. influenzae в их развитии [20]. Анализ эпидемиологических исследований о распространенности различных серотипов пневмококкового возбудителя в России в настоящее время, выявление устойчивых к антибиотикам штаммов во всех возрастных группах позволили авторам сделать следующий вывод: широкое использование современных пневмококковых вакцин в рамках программы иммунизации помог решить эту серьезную проблему отечественного здравоохранения и значительно снизить заболеваемость данными нозологическими формами [21].
С недавнего времени в нашей стране появилась возможность пассивной иммунопрофилактики РС-вирусной инфекции детей групп высокого риска по развитию тяжелых инфекций нижних дыхательных путей иммуноглобулином паливизумаб (Синагис) [22]. По данным зарубежных публикаций, ежемесячное введение населению паливизумаба в период циркуляции РС-вируса приводит к уменьшению числа тяжелых случаев инфекции у детей групп риска, требующих госпитализации, на 50 % по сравнению с плацебо [23].
Для сезонной профилактики ОРИ органов дыхания также используются методы неспецифической активации иммунной системы с применением иммуномодулирующих фармакопрепаратов, например бактериальных вакцин и синтетических иммуномодуляторов [24, 25]. Бактериальные вакцины – иммуномодуляторы микробного происхождения: очищенные бактериальные лизаты (ИРС 19, Имудон, Бронхо-мунал, Бронхо-Ваксом), комбинированные иммунокорректоры, содержащие антигены бактерий, неспецифические иммуномодуляторы ЛПС (липополисахариды) и протеогликан (Рибомунил, Иммуновак-ВП-4), а также полусинтетические аналоги (Ликопид – глюкозаминилмурамилдипептид), имеют двойное действие: специфическое (вакцинирующее) и неспецифическое (иммуностимулирующее). Из синтетических иммуномодуляторов применяют азоксимера бромид (Полиоксидоний), пидотимод (Имунорикс), индукторы интерферона тилорон (Амиксин), меглюмина акридонацетат (Циклоферон).

ВОЗ в дополнение к вакцинации как основной стратегии борьбы с гриппом рекомендует применение этиотропных химиопрепаратов, блокирующих функциональную активность вируса на разных этапах его репликативного цикла (http://www.who.int).
Медикаментозная профилактика гриппа и ОРВИ назначается как дополнение к поздней вакцинации следующим группам лиц:
- лицам группы риска в первые 2 недели после вакцинации (в период образования антител);
- детям, которые вакцинируются впервые (т.к. образование антител заканчивается ко 2-й неделе после второй вакцинации);
- пациентам с хронической патологией, сопровождающейся иммунодефицитом, у которых в результате вакцинации образуется недостаточный иммунный ответ;
- лицам, которым вакцинация против гриппа противопоказана (например, при аллергической реакции на предыдущие вакцинации);
- невакцинированным лицам после контакта с заболевшим.
Медикаментозная профилактика гриппа и ОРВИ эффективно дополняет вакцинацию и при применении во время эпидемий гриппа позволяет значительно снижать заболеваемость и смертность от инфекции (http://www.who.int). Рекомендации ВОЗ одинаковы для сезонного и пандемического гриппа, но требуют выполнения условий кратности и длительности приема противовирусного препарата. Не рекомендуется проводить химиопрофилактику позже 48 часов от момента контакта с больным. Постконтактная химиопрофилактика эффективна только в случае ежедневного приема в рекомендованных дозировках при длительности не менее 7 суток после контакта с больным. Для только что вакцинированных лиц рекомендуемая продолжительность химиопрофилактики – не менее 2 недель, т.е. до момента формирования специфического иммунитета (для детей возможно увеличение срока в зависимости от возраста и анамнеза вакцинации).
Обширный отечественный фармацевтический рынок требует четкого понимания критериев выбора этиотропного препарата. Противовирусные химиопрепараты оказывают прямое воздействие на репродукцию вируса и направлены на определенную вирусспецифическую мишень в цикле вирусной репродукции. Использование критериев исключения, включающих отсутствие доказанного механизма действия, отсутствие прямого влияния на одно из звеньев репликации вируса, невозможность достижения терапевтической концентрации препарата в плазме крови, позволяет четко ограничивать круг эффективных противовирусных средств [26].
В педиатрической практике для проведения химиопрофилактики и терапии гриппа применяют ингибиторы нейраминидазы: осельтамивир (Тамифлю) детям с 1 года, занамивир (Реленза) – с 5 лет и ингибитор слияния вируса с клеткой умифеновир (Арбидол) – с 3 лет жизни. Препараты римантадина, блокирующего М2-каналы вириона вируса гриппа А и не активного в отношении вируса гриппа В, в настоящее время не рекомендуются ВОЗ для применения из-за высокой распространенности резистентных к препарату штаммов вируса (http://www.cdc.gov/flu/antivirals//index.htm).
В отличие от ингибиторов нейраминидазы отечественный препарат умифеновир (Арбидол) активен в отношении не только вирусов гриппа А и В, но и ряда других возбудителей ОРВИ, применяется и как средство для сезонной профилактики ОРВИ, и как средство экстренной профилактики не только гриппа, но и ОРВИ в детских коллективах, в семейных очагах, в т.ч. и беременных женщин, контактировавших с больными, предотвращая развитие у них тяжелых форм заболевания [27, 28].
В комплекс профилактических мер помимо вакцинации и фармакопрофилактики входят общеукрепляющие мероприятия, направленные на снижение антигенного воздействия и повышение резистентности организма ребенка в целом – рациональный режим дня, оптимальное питание, закаливающие процедуры, санация местных очагов хронической инфекции; применение витаминно-минеральных комплексов. Использование комплекса этих мероприятий позволяет снижать частоту острых инфекционных респираторных заболеваний и обострений очагов хронической инфекции [29].
Диагностика ОРИ основана на совокупности клинико-эпидемиологических данных. Биологические свойства вирусов, так же как и особенности других микроорганизмов, определяют поражение слизистой оболочки респираторного тракта и, следовательно, клинические проявления заболевания (табл. 2, 3).
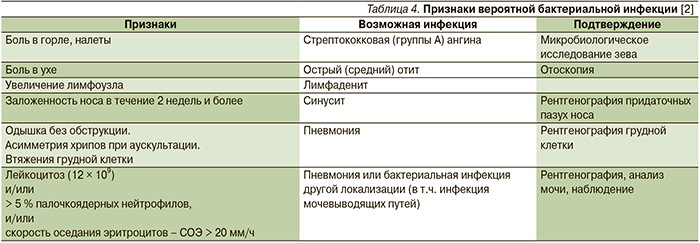
На бактериальную природу респираторной инфекции с большой долей вероятности указывают следующие симптомы: длительная, более 3 дней, фебрильная лихорадка; одышка без бронхообструкции; асимметрия хрипов; появление гнойных налетов и гнойного или слизисто-гнойного отделяемого; наличие лейкоцитоза, нейтрофилеза со сдвигом влево [2].
Бактериальные осложнения ОРВИ появляются, как правило, уже на 1–2-й день болезни, а в более поздние сроки чаще возникают вследствие суперинфекции (табл. 4).
В настоящее время для раннего подтверждения диагноза существует возможность применения лабораторных методов с использованием современных диагностических тест-систем [30]. Помимо установления этиологии заболевания и назначения адекватной терапии лабораторная диагностика имеет существенное значение в организации противоэпидемических мероприятий и мониторинге эффективности терапии. Методы экспресс-диагностики возбудителей заболевания основаны на обнаружении патогенных антигенов в материалах от больных с помощью специфических антител, маркированных флюорохромами или ферментами, молекулярно-биологических исследований. Экспресс-тесты QuickStripe-компании Savyon Diagnostics Ltd применяются для выявления респираторных вирусов, хламидий, стрептококков группы А. Лабораторная экспресс-диагностика вирусных инфекций дыхательных путей может снижать частоту назначения антибиотиков детям с ОРВИ (www.biochimmack.ru).
В диагностике бактериального (стрептококкового) тонзиллита ведущее место занимает бактериологический метод. В настоящее время в России зарегистрирован экспресс-тест (Streptatest, компания Laboratoires Dectra Pharm & Sbh) для диагностики тонзиллофарингита, вызванного β-гемолитическими стрептококками группы А (БГСА, Streptococcus pyogenes). Во многих странах Европы использование экспресс-теста на амбулаторном приеме является рутинным методом диагностики. Современные тестовые системы, основанные на иммунохроматографическом методе, позволяют получать результат через 5–10 минут с высокой специфичностью (95–100 %) и чувствительностью (70–95 %). Использование экспресс-тестов позволяет избегать ошибок при определении этиологии тонзиллофарингита, сокращать число необоснованных назначений антибиотиков и в случае положительного результата – сразу назначать антибактериальную терапию (www.antibiotic.ru).
Респираторные инфекции без адекватного лечения часто принимают осложненное или хроническое течение, легкий насморк может закончиться тяжелой пневмонией или синуситом. ОРИ могут вызывать и обострение хронических заболеваний, таких как бронхиальная астма, гломерулонефрит, заболевания сердца и др. Своевременная терапия инфекций органов дыхания способствует более быстрому выздоровлению и предупреждает развитие осложнений. Все это объясняет необходимость принятия лечащим врачом решения о проведении этиотропной терапии ОРИ. Безусловно, лечение острых респираторных заболеваний должно быть комплексным и строиться индивидуально в каждом конкретном случае. С учетом вирусной и вирусно-бактериальной этиологии ОРИ основу этиотропной терапии должны составлять противовирусные и антибактериальные средства. Однако назначение этих групп препаратов требует строго дифференцированного подхода.
Противовирусная терапия. Этиотропная противовирусная терапия в принципе показана при любом респираторно-вирусном заболевании. При гриппе ВОЗ рекомендует незамедлительное проведение противовирусной терапии пациентам группы высокого риска по осложненному течению гриппа, к которой относятся:
- дети в возрасте младше 5 и особенно до 2 лет;
- пожилые люди;
- беременные женщины или женщины в послеродовом периоде (2 недели после родов);
- лица, страдающие хроническими заболеваниями;
- пациенты с иммуносупрессивными состояниями.
В настоящее время высказываются мнения, в т.ч. и с учетом складывающейся эпидемиологической ситуации, будто противовирусные средства должны применяться шире, чем это считается целесообразным сегодня. Спрогнозировать вариант течения заболевания и его исход по первым признакам у детей невозможно, в связи с чем независимо от преморбидного состояния всем детям следует сразу назначать этиотропную терапию, как известно, эффективную при максимально раннем начале [18, 31, 32].
По определению экспертов Food and Drug Administration (США), противовирусными могут быть названы только препараты, оказывающие непосредственное прямое воздействие на репликацию вируса, т.е. действие этих препаратов направлено на определенную вирусспецифическую мишень в цикле размножения вируса. Так, мишенью действия противогриппозных препаратов адамантанового ряда (амантадин и римантадин) является М2-белок вируса гриппа А. Функцию вирусного фермента нейраминидазы блокируют противогриппозные препараты осельтамивир и занамивир. Противовирусным действием обладает малотоксичный препарат умифеновир, ингибирующий слияние липидной оболочки вирусов гриппа с мембраной эпителиальных клеток. Показанием к их назначению является установленная или высоковероятная гриппозная этиология болезни в сочетании с высоким риском неблагоприятного исхода заболевания.
Для лечения ОРВИ особенно при рецидивирующих респираторных и герпесвирусных инфекциях могут применяться препараты с комбинированным противовирусным и иммуномодулирующим действиями: инозин пранобекс (Изопринозин, Гросприносин), умифеновир (Арбидол), а также интерфероны и их индукторы – тилорон (Амиксин), метилглюкамина акридонацетат (Циклоферон). Эти препараты обладают универсальными противовирусными свойствами, подавляя репликацию как РНК, так и ДНК вирусов, стимулируя одновременно иммунологические реакции макроорганизма. Препараты интерферона детям с ОРВИ чаще применяют местно в виде мазей, капель, геля, ингаляций или ректально. Наиболее эффективными и безопасными для детей являются препараты рекомбинантного интерферона (Виферон, Генферон Лайт, Гриппферон) [33].
Антибактериальная терапия. Хотя диагностика и лечение респираторной патологии у детей занимают ведущее место в работе педиатра, антибактериальная терапия требуется практически всего 6–8 % больных этой категории – в основном с отитом, синуситом, стрептококковым тонзиллофарингитом, лимфаденитом, пневмонией, а также при бронхитах, вызванных только микоплазмой и хламидиями [34]. Для антибактериальной терапии ОРИ применяют препараты местного и системного действий.
Местная антибактериальная терапия обеспечивает непосредственное воздействие на очаг инфекции, создает оптимальную концентрацию препарата и не имеет системных побочных эффектов. Одним из эффективных местных антибактериальных препаратов лечения ОРИ у детей и взрослых является фузафунгин, обладающий двойным действием: антибактериальным и противовоспалительным. Фузафунгин можно использовать детям с 2,5 лет, он не противопоказан беременным и кормящим женщинам [35].
Показанием к назначению системных антибиотиков является развитие явно бактериального воспалительного процесса в дыхательных путях (гнойного среднего отита, гнойного синусита, острого бактериального тонзиллита – ангины, паратонзиллита, эпиглоттита, обструктивного ларингита с явлениями стеноза гортани 2–3-й степеней, острого гнойного трахеобронхита/бронхита, пневмонии). Для стартовой терапии бактериальных ОРИ используют небольшой набор антибиотиков. Применяются β-лактамные антибиотики: пенициллины и цефалоспорины 1–3-го поколений. Из группы пенициллинов при респираторной инфекции в основном используется амоксициллин, который оказывает бактерицидное действие на стрептококки, включая S. pneumoniae (пневмококк), некоторые виды стафилококков и грамотрицательных бактерий, включая H. influenzae (гемофильную палочку) и M. catarrhalis (моракселлу).
Ампициллин, ранее широко использованный в практическом здравоохранении, в настоящее время теряет свое значение в связи с нарастанием резистентности к нему респираторных патогенов, а также из-за невысокой биодоступности (низкой всасываемости из желудочно-кишечного тракта). Но пенициллины легко разрушаются β-лактамазами пневмококка, гемофильной палочки и моракселлы. Так называемые ингибиторзащищенные пенициллины (амоксициллин/клавуланат) за счет введения в их формулу ингибитора β-лактамаз клавулановой кислоты обладают намного более высокой эффективностью по отношению к таким возбудителям, как H. influenzae и M. catarrhalis. По отношению к пневмококку они тоже более активны.
Препаратом выбора при стрептококковом тонзиллофарингите остается пенициллин, поскольку S. pyogenes (БГСА) всегда чувствителен к β-лактамам in vitro. В то же время применение макролидов ограниченно в связи с резистентностью к ним БГСА, которая в России составляет около 8 % [36]. Однако клиническая эффективность пенициллина отмечается далеко не всегда, что связано прежде всего с продукцией β-лактамаз ко-патогенными бактериями ротоглотки (стафилококки, анаэробы). Еще одной причиной неэффективности пенициллина является низкая приверженность 10-дневному курсу лечения, который требуется для эрадикации БГСА и предотвращения развития поздних осложнений (острая ревматическая лихорадка, постстрептококковый гломерулонефрит).
В доказательных клинических исследованиях установлено, что при рецидивирующем тонзиллофарингите у детей амоксициллин/клавуланат (20–40 мг/кг в сутки в расчете на амоксициллин в течение 10 дней) превосходит пенициллин по клинической и микробиологической эффективности (40–60 мг/кг в сутки в течение 10 дней) [37], а при остром тонзиллофарингите у детей сокращенный курс амоксициллина/клавуланата (5 дней) по клинической и микробиологической эффективности превосходит стандартный курс пенициллина (10 дней) и сокращенный курс кларитромицина (5 дней) [38].
Препаратами выбора при остром среднем отите и остром бактериальном риносинусите у детей в настоящее время являются амоксициллин и амоксициллин/клавуланат. Преимуществом ингибиторзащищенного препарата является активность в отношении штаммов, продуцирующих β-лактамазы, – H. influenzae и M. catarrhalis, являющихся наряду с S. pyogenes основными возбудителями данных заболеваний [36]. В научной литературе представлены многочисленные рандомизированные исследования, в которых была оценена эффективность амоксициллина/клавуланата (преимущественно в дозе 40 мг/кг в сутки в расчете на амоксициллин) при остром среднем отите у детей. Установлено, что амоксициллин/клавуланат не только не уступает по эффективности пероральным цефалоспоринам 2–3-го поколений, но и превосходит их, а также цефтриаксон. Доказательные клинические исследования, проведенные на больных бактериальным риносинуситом, также свидетельствуют об эффективности амоксициллина и амоксициллина/клавуланата [39].
Амоксициллин/клавуланат (в т.ч. отечественный препарат Арлет®, ОАО «Синтез», Курган; дозировки 875 мг + 125 мг, 500 мг + 125 мг) активно используется в клинической практике внебольничных инфекций дыхательных путей. Среди пероральных антибиотиков, рекомендованных для лечения респираторных инфекций у детей (пенициллины, цефалоспорины, макролиды), амоксициллин/клавуланат обладает наибольшей активностью в отношении типичных возбудителей бактериальных респираторных инфекций. Он является препаратом выбора лечения пациентов с острым бактериальным риносинуситом в амбулаторной практике, которые получали антибиотикотерапию в предшествующие 4–6 недель или для которых антибиотикотерапия 1-й линии оказалась неуспешной. Арлет® является первым российским комбинированным препаратом амоксициллина/клавуланата в форме таблеток (начало выпуска – 2008 г.). Для пациентов с БГСА амоксициллин/клавуланат является препаратом выбора в группе пациентов, получавших антибиотикотерапию в течение предшествующего месяца, в случае бактериального фарингита, вызванного микст-инфекцией с участием анаэробных возбудителей, а также при обострении хронического тонзиллофарингита. В амбулаторной практике оптимальной формой амоксициллина/клавуланата (Арлет®) для детей от 6 до 12 лет являются таблетки 500/125 мг, назначаемые 2 раза в сутки. При этом максимальная суточная доза клавулановой кислоты составляет 10 мг/кг, амоксициллина – 45 мг/кг массы тела [40]. Назначают Арлет® детям старше 12 лет (или c массой тела > 40 кг) при легком или среднетяжелом течении инфекции – по 500/125 мг каждые 12 часов, в случае тяжелого течения инфекции и инфекций дыхательных путей — по 500/125 мг каждые 8 часов или по 875/125 мг каждые 12 часов. Детям младше 12 лет с массой тела < 40 кг доза препарата подбирается индивидуально на основании рекомендуемой схемы дозирования (для амоксициллина) – 45 мг/кг/сут в 2 приема или 40 мг/кг/сут в 3 приема (http://www.rlsnet.ru/tn_index_id_36329.htm).
Наряду с β-лактамными антибиотиками существенное место в лечении респираторной инфекции занимают макролидные препараты, активные в отношении большинства видов стрептококков, части штаммов стафилококков, атипичных возбудителей, а также таких возбудителей инфекционных заболеваний детского возраста, как коклюш и дифтерия. Доказана низкая эффективность макролидов в отношении гемофильной палочки. Азитромицин превосходит другие макролиды по активности в отношении H. influenzae. В то же время антибиотики этой группы не влияют на кишечные бактерии, энтерококки и ряд анаэробов, что делает их интактными к аэробному и анаэробному компонентам нормального биоценоза кишечника. Для макролидов характерна хорошая клиническая переносимость, они редко вызывают аллергические реакции, способны накапливаться не просто в тканях, а внутриклеточно в концентрациях, в несколько раз превышающих их содержание в крови, в результате этого достигается бактерицидный эффект препаратов против группы внутриклеточных возбудителей.
Спектр применяемых в клинической практике макролидов достаточно широк, среди них наибольшее значение имеют современные полусинтетические макролиды: 14-членные (кларитромицин, рокситромицин), 15-членные (азитромицин), 16-членные (джозамицин), активные в отношении большинства возбудителей респираторных инфекций, вызываемых как типичными, так и «атипичными» возбудителями (Chlamydia, Mycoplasma, Legionella и др.) [41].



