Ювенильный артрит (ЮА) – наиболее распространенное ревматическое заболевание у детей. ЮА – хронический воспалительный процесс в суставах неустановленной природы длительностью более 6 недель, начавшийся у пациента до 16-летнего возраста при исключении других известных нозологических групп, проявляющихся артритом. Термин ЮА объединяет гетерогенную группу заболеваний, имеющих различный этиопатогенез и иммуногенетическое происхождение, различную нозологическую принадлежность и неоднозначный прогноз. Частота встречаемости точно неизвестна. По различным данным, заболеваемость ЮА в год варьируется от 1 до 20 случаев на 100 тыс. (Япония–Норвегия), распространенность колеблется в зависимости от популяций, например от 10 : 100 тыс. во Франции до 400 : 100 тыс. детского населения в Австралии [1].
В Российской Федерации распространенность ЮА составляет 62,3 на 100 тыс., первичная заболеваемость – 16,2 на 100 тыс. [2]. Среди всех взрослых пациентов, страдающих ревматоидным артритом (РА), 2,7–5,2 % имеют начало в детском возрасте.
В соответствии с ILAR-клас-сификацией (The International League Against Rheumatism) ЮА (ювенильный идиопатический артрит – ЮИА по терминологии Международной лиги ревматологических ассоциаций) подразделяется на 7 различных категорий, имеющих свои определения и критерии исключения [3, 4]. В основе данной классификации, как и всех имеющихся ранее, лежат такие признаки, как число вовлеченных в процесс суставов, наличие экстраартикулярных, в т. ч. системных, проявлений, наличие или отсутствие ревматоидного фактора (РФ), HLA (Human Leukocyte Antigen)-B27 антигена и семейного анамнеза [1]. В табл. 1 представлены основные категории ЮИА, распознавание которых имеет существенное значение для дифференцированного подхода к терапии. Создание такой субклассификации было проведено с целью описания наиболее гомогенных групп пациентов для лучшего понимания патогенеза.
Выбор терапии для пациентов с ЮА базируется на взаимоотношениях риска, связанного с заболеванием (тяжесть болезни, развитие деструкций суставов и функциональной недостаточности, инвалидизирующих осложнений; прогностические факторы, определяющие жизненный прогноз и качество жизни), пользы и риска самой терапии.
В своей практике врач руководствуется следующими принципами:
- Выбор лечебного комплекса, позволяющего обеспечивать контроль над активностью, предотвращать прогрессирование.
- Главными ориентирами являются возраст, вариант артрита, тяжесть артрита, прогноз течения и оценка вероятности инвалидизирующего исхода.
- Если прогноз неблагоприятный, терапия должна быть опережающей и агрессивной; но риск, связанный с лечением, должен быть ниже, чем риск прогрессирования заболевания.
- Лечение должно быть комплексным, этапным и длительным.
К основным задачам лечения ЮА относятся купирование боли и других симптомов воспаления; предупреждение или замедление деструкции суставов, отдаленных повреждений, ведущих к инвалидизации; индукция длительной и стойкой ремиссии, повышение качества жизни, минимизация побочных эффектов терапии [5].
До середины 1980-х гг. терапия детей с артритами (наиболее часто называемыми ювенильными РА в США и ювенильными хроническими артритами в странах Европы) включала ограниченное количество противовоспалительных средств и кортикостероиды. Лишь небольшое число детей отвечали на монотерапию нестероидными противовоспалительными средствами (НПВС), почти все отвечали на лечение глюкокортикоидами (ГК), однако цена была слишком высокой из-за множества осложнений [6]. К настоящему времени современные ревматологи располагают достаточно большим арсеналом средств, позволяющих контролировать патологический процесс у детей с ЮА.
Составляющими лечебного комплекса, применяемого пациентами с ЮА, являются симптом-модифицирующие средства, к которым относятся НПВС и ГК, и болезнь-модифицирующие средства – базисные противовоспалительные препараты (БПВП) и генно-инженерные биологические препараты (ГИБП).

Терапия НПВС является симптоматической для уменьшения воспаления и связанной с ним боли. Основные эффекты НПВС связаны с влиянием их на простагландины (ПГ), которые играют центральную роль в развитии воспаления. По селективности своего влияния на циклооксигеназы (ЦОГ-1 и ЦОГ-2) они подразделяются на традиционные ЦОГ-1- и ЦОГ-2-ингибиторы (диклофенак натрия, индометацин, напроксен, пироксикам, ибупрофен и др.) и селективные ЦОГ-1-ингибиторы (ацетилсалициловая кислота, которая в настоящее время при ЮА не используется) и ЦОГ-2-ингибиторы (мелоксикам, нимесулид и др.) [2]. В педиатрии применение НПВС ограниченно. В реальной практике используются диклофенак натрия (разрешен с 6 лет) в дозе 2,5–3,0 мг/кг/сут, ибупрофен (с 6 месяцев) – 20–40 мг/кг/сут, нимесулид (с 2 лет) – 3–5 мг/кг/сут; напроксен (с 12 лет) – 15–20 мг/кг/сут, мелоксикам (с 12 лет) – 0,15–0,2 мг/кг/сут. Применение индометацина ограничено в последние годы использованием преимущественно при ЮА HLA-B27, ассоциированном или с высоким риском развития одного из вариантов спондилоартрита. Прием НПВС должен быть достаточно длительным в зависимости от варианта ЮА. Установлено, что примерно у трети детей артрит контролируется изолированным приемом НПВС, чаще – у пациентов с олигоартритом [6].
ГК-терапия наиболее часто применяется для лечения экстраартикулярных проявлений при системном ЮА.
К ним относятся фебрильная лихорадка, не отвечающая на прием НПВС, тяжелая анемия, миокардит или перикардит, синдром активации макрофагов [7]. До эры биологических препаратов использование ГК считалось, пожалуй, терапевтической доктриной больных с жизнеугрожающими состояниями. Многогранный, в т. ч. мощный противовоспалительный, эффект ГК обеспечивает быстрое подавление активности патологического процесса и системного воспалительного ответа, с тем чтобы, являясь «bridge»-терапией, обеспечить переход на длительно действующие БПВП [1].
Высокодозовая пульс-терапия метилпреднизолоном в дозе 10–30 мг/кг внутривенно, но не более 1 г на одно введение в течение 1–3 последовательных дней служит эффективным средством быстрого подавления воспаления. Однако эффект непродолжительный и быстро исчезает, поэтому часто необходимо продолжение системного приема ГК внутрь в дозе 0,5–1,0 мг/кг/сут преднизолона в течение 3–4 недель. Препарат вводят преимущественно в утренние часы. Дальнейшее снижение дозы осуществляется постепенно, в низких дозах по альтернирующей схеме [2, 5]. Нередко пациенты с тяжелым полиартритом, рефрактерным к другой терапии, также нуждаются в применении ГК в дозе, не превышающей 0,5 мг/кг, для уменьшения воспаления, купирования боли и облегчения восстановительной реабилитации. Но наличие большого числа побочных эффектов от применения ГК-терапии позволяет рассматривать ее лишь как терапию отчаяния и промежуточного этапа.
Внутрисуставное введение ГК было и по-прежнему остается одним из самых эффективных методов местного и отчасти системного воздействия на патологический процесс у детей с ЮА. Целью служат быстрое подавление локального воспаления, уменьшение боли и восстановление функции сустава. Нередко этого бывает достаточно для развития ремиссии у больных олигоартикулярным ЮА и значительного облегчения ситуации при полиартрите, а также эффективным средством предотвращения формирования контрактур в суставах, вальгусной деформации, разницы в длине конечностей, особенно у маленьких детей. Внутрисуставные инъекции (ВСИ), осуществляемые одновременно с применение БПВП или ГИБП, позволяют наиболее быстро и эффективно использовать лечебный потенциал последних. Такой подход может быть альтернативой использованию системной ГК-терапии, в свою очередь также обеспечивающей т. н. bridge-эффект. К наиболее часто применяемым препаратам для внутрисуставных введений в США и странах Евросоюза относятся триамцинолона гексацетонид и его аналоги. В РФ данный препарат для применения к детям не зарегистрирован и отсутствует в продаже.
В зависимости от пораженных суставов применяют триамцинолона ацетонид для крупных суставов, бетаметазон для средних и мелких суставов. Другие препараты (метилпреднизолон и др.) используются в настоящее время крайне редко [5, 7]. Несмотря на то что нет четких и окончательно принятых рекомендаций к частоте использования ВСИ, нежелательно проводить повторные введения чаще чем с интервалом в 3 месяца [7]. Согласно данным различных исследований, наибольший риск развития рецидива артрита после ВСИ имеют пациенты, страдающие системным ЮА, чем больные олиго- или полиартритом, а также больные с высоким уровнем С-реактивного белка, негативные по антинуклеарному фактору, и те, кому проводились инъекции в голеностопные суставы [7, 8]. Наиболее частыми побочными эффектами остаются подкожные атрофии и депигментация в месте введения, особенно при инъекциях в лучезапястные, голеностопные и мелкие суставы кистей. Со временем субатрофия кожи исчезает у большинства больных. Риск развития осложнений минимизируется при технически правильно выполненной процедуре. Не описано какого-либо влияния ВСИ на внутрисуставной хрящ и зоны роста [7, 9]. Известно также еще об одном местном осложнении ВСИ – это образование периартикулярных кальцинатов.
В большинстве случаев они асимптомны и распознаются случайно – при лучевом исследовании. Кроме того, перед выполнением внутрисуставных инъекций, особенно при моноартрите, в обязательном порядке должен быть исключен туберкулезный процесс.
Таким образом, ГК являются важным компонентом терапии ЮА у детей. Применение ГК позволяет обеспечивать быстрый и эффективный контроль над системным воспалительным процессом и помогает предотвращать серьезные органные нарушения. Однако не следует забывать о побочных эффектах, связанных с применением ГК, особенно пролонгированным.
К ним относятся развитие медикаментозного синдрома Иценко–Кушинга, стойкая артериальная гипертензия, тяжелый системный остеопороз, ожирение, образование стрий, эрозий и язв на коже и верхних отделах желудочно-кишечного тракта, стероидная миопатия, заднекапсулярная катаракта, стероидный диабет и др. [2].
Современный подход к терапии ЮА основывается на как можно более раннем применении БПВП, поскольку быстродействующая противоревматическая терапия (НПВС, ГК) способствует лишь быстрому уменьшению боли и воспаления в суставах, улучшению их функции, но не предотвращает развития в них деструкции и в глобальном смысле не влияет на отдаленный прогноз [4]. Группа БПВП включает метотрексат (МТХ), антималярийные препараты, сульфасалазин, лефлуномид. Препараты золота, пеницилламин, широко используемые в прошлые годы, в настоящее время при лечении ЮА не применяются. Антималярийные препараты занимают небольшую нишу в лечении хронических артритов и находят свое применение при моно- и олигоартритах без выраженной воспалительной активности и существенного прогрессирования процесса – преимущественно у детей раннего возраста. Доза составляет 6–8 мг/кг/сут.
Среди БПВП, используемых в лечении ревматических заболеваний у детей, МТХ является наиболее часто назначаемым препаратом и по праву заслуживает название «золотого» стандарта базисной терапии [10].
В большой серии контролируемых рандомизированных исследований были установлены оптимальные дозы, способы введения МТХ, пути повышения эффективности и безопасности. Согласно литературным данным и опыту многих исследователей, МТХ находится на первом месте среди всех БПВП. Частота его использования у детей с суставным вариантом ЮА, по данным Института ревматологии им. В.А. Насоновой, составила 82 %, а при системном – 70 % [10]. Для детей с ЮА доза рассчитывается на площадь поверхности тела. Эффективными считаются дозы 10–15 мг/м² в неделю внутрь или парентерально (подкожно или внутримышечно) [4, 10]. Пероральный прием осуществляется 2 раза в сутки с интервалом 12 часов 1 раз в неделю. Считается, что парентеральное введение МТХ может быть более эффективным и лучше переносится пациентами. Однако имеются сведения, будто достоверной разницы ни в плане эффективности, ни в плане переносимости между этими способами введения МТХ не определяется [1]. У пациентов с полиартритом, резистентных к проведению терапии МТХ в стандартных дозах, эффективным может оказаться использование комбинированной пульс-терапии ГК с высокими дозами МТХ (30 мг/м² в неделю, максимально – 40 мг) с переходом на еженедельное введение в дозе 15 мг/м². Как было показано в рандомизированных контролируемых исследованиях, ежедневное применение взрослыми фолиевой кислоты через 24 часа после приема МТХ снижает риск побочных эффектов [1]. Интересен факт определенной протективности МТХ в плане развития у детей с ЮА такого экстраартикулярного проявления, как увеит. В одном итальянском исследовании было показано, что у детей, получавших МТХ, значительно реже развивался увеит, чем у тех, кто его не получал (10,5–20,2 %). Наблюдение итальянских коллег подтверждает генеральный вывод: рано начатое лечение МТХ у детей с ЮА снижает риск развития увеита с 30 до 10 % [11].
Сульфасалазин (ССЗ) как препарат первой линии применяется в дозе 30–50 мг/кг/сут в 2–3 приема пациентами с олигоартритом с риском формирования одного из вариантов спондилоартрита, особенно при HLA-B27, ассоциированном ЮА у мальчиков. Применение возможно детьми старше 6-летнего возраста, осуществляется постепенно, начиная с 10–15 мг/кг и еженедельно увеличивая дозу. Эффект от его лечения можно оценить не ранее чем через 6 месяцев, а иногда и через год непрерывного приема. Категорически не рекомендуется использовать ССЗ для лечения системного артрита.
Лефлуномид (Леф) используется в дозах 10 мг однократно в сутки ежедневно или через день: у детей < 20 кг, 20–40 кг – 15 мг ежедневно (или чередуя 10 и 20 мг), свыше 40 кг – 20 мг/сут [1, 4]. Место Леф в лечении ЮА окончательно не установлено, хотя исследования его эффективности при полиартикулярном ЮА показали его равнозначность МТХ [1].
В тех случаях, когда монотерапия БПВП оказывается неэффективной, возможно применение комбинации БПВП (МТХ + ЦСА – циклоспорин А, МТХ + Леф, МТХ + ССЗ, МТХ + АХП), однако в последние годы в связи с существенным расширением спектра противоревматических средств за счет различных видов ГИБП комбинации стандартных БПВП используются все реже и реже.
По своей природе ЮА являются типичными иммуновоспалительными заболеваниями, и, как следует из названия, основа их развития – это хроническое воспаление, обусловленное дисфункцией иммунной системы [12].
В развитии воспалительной реакции принимают участие клеточные (моноциты/макрофаги, гранулоциты, дендритные клетки, Т- и В-лимфоциты, клетки сосудистого эндотелия) и многочисленные гуморальные факторы: цитокины, гормоны, антитела, гистамин, серотонин, компоненты калликреин-кининовой и гемокоагуляционной систем, система комплемента, белки острой фазы и многие др.) [12]. Среди вышеперечисленных гуморальных регуляторов воспаления существует своя иерархия, при которой одни медиаторы верхнего уровня регулируют действие медиаторов нижележащего уровня. К «верхнему этажу» системы регуляции воспаления относятся цитокины, воздействие на которые и лежит в основе использования ГИБП при ЮА. Цитокины – белковые продукты преимущественно активированных клеток иммунной системы, лишенные специфичности в отношении антигенов, обусловливающие межклеточные коммуникации при гемопоэзе, воспалении, иммунном ответе и межсистемных взаимодействиях. Цитокины составляют систему (цитокиновую сеть), характеризующуюся сильным взаимодействием компонентов и избыточностью (одна и та же функция обеспечивается разными цитокинами). Цитокины по своей роли в организме являются как бы «дирижерами» сложного «оркестра» воспаления. Примером регулирования процесса воспаления служит наличие про- и противовоспалительных цитокинов [13, 14]. К числу основных провоспалительных цитокинов относится семейство фактора некроза опухоли (ФНО), включающее на сегодняшний день 18 представителей, среди которых важнейшие – это ФНО-α и ФНО-β. ФНО является «ранним» цитокином, появляющимся в дебюте развития воспалительной реакции. К другому семейству провоспалительных цитокинов относятся представители семейства интерлейкина-1 – ИЛ-1 (не менее 11), важнейшие из которых – ИЛ-1α, ИЛ-1β, ИЛ-18 и растворимые антагонисты рецепторов ИЛ-1 (ИЛ-1ра). Последний крайне важен и является антивоспалительным цитокином, способным связываться с рецептором для ИЛ-1 без его активации и тем препятствовать его взаимодействию с молекулой ИЛ-1β с развитием всех его провоспалительных эффектов [14]. Важнейшим «поздним» цитокином является ИЛ-6. Для него характерно в значительной степени «дистантное» действие, т. е. он присутствует в кровотоке и работает подобно истинному гормону. Среди важнейших функций ИЛ-6 следует отметить его участие в индукции образования иммуноглобулинов, острофазовых белков, в т. ч. С-реактивного и сывороточного амилоидного белка А (что приводит к развитию амилоидоза), гепсидина (способствующего развитию анемии); участие в разрушении хряща, замедлении линейного роста и развитии остеопороза. Блокада функции ИЛ-6 возможна путем нарушения связывания лиганда с растворимым рецептором.
Роль и значение того или иного цитокина различны при разных заболеваниях [15]. Соответственно, при той или иной нозологии можно выделить ведущий цитокин или небольшую группу цитокинов, блокада которых приведет к подавлению всей цепи патологических реакций. Так, для системного ЮА, который представляет, по сути, обособленное заболевание, ведущую роль в патогенезе играют ИЛ-6 и ИЛ-1β. Уже в работах A.M. Prieur и соавт. [16,17] продемонстрировано, что температурные пики при системном ЮА связаны с повышением уровня ИЛ-6 и ИЛ-1ра, которые предшествуют подъему температуры. По сути, многие проявления данного заболевания (лихорадка, задержка линейного роста, остеопороз, анемия, тромбоцитоз) и развитие осложнений служат следствием действия ИЛ-6 [17]. Другой важнейший цитокин, участвующий в патогенезе системной формы ЮА, – это ИЛ-1β. Интересно отметить, что для системного ЮА характерно также нарастание уровня ИЛ-1ра в сыворотке крови, на что указывают множество работ и наши собственные данные [15, 18]. Но главным доказательством значения этих цитокинов в патогенезе системного ЮА явился успешный терапевтический опыт с блокадой указанных молекул. Следует отметить, что у одних пациентов с системным ЮА более эффективно применение ингибиторов ИЛ-6, у других – ингибиторов ИЛ-1. Возможно, в перспективе будут выделены субтипы ИЛ-6-зависимого ЮА и ИЛ-1-зависимого ЮА. Роль ФНО в генезе системного ЮА значительно скромнее, что подтверждается частым (но не тотальным) неуспехом применения ФНО-ингибиторов со стороны данных пациентов. Несомненно, ФНО занимает в генезе системного ЮА подчиненную роль, тем не менее значимую и, возможно, в первую очередь связанную с активацией эндотелия [14, 19–23]. Говоря о серопозитивном полиартикулярном варианте ЮА, можно считать, что это состояние является аналогом серопозитивного РА взрослых и все, что известно в отношении РА взрослых, применимо и к подобным пациентам детского возраста. Для этой формы заболевания ведущими медиаторами являются ФНО-α и ИЛ-6, а ИЛ-1β играет важную, но подчиненную роль, с чем и связана недостаточная эффективность ИЛ-1-ингибиторов для подобных пациентов [14, 24].
В отношении разнородной группы олигоартикулярного ЮА хочется отметить, что в их развитии имеют значение те же провоспалительные цитокины, что и при других вариантах, т. е. ФНО, ИЛ-1, ИЛ-6, но уровни этих молекул в крови и синовиальной жидкости, по данным большинства исследователей, ниже, чем при системном и полиартикулярном вариантах, и в то же время уровень антивоспалительных цитокинов выше. Соответственно, соотношение провоспалительные/антивоспалительные цитокины у этих пациентов ниже, что клинически отражается лимитированным поражением суставов [22, 23, 25–27].
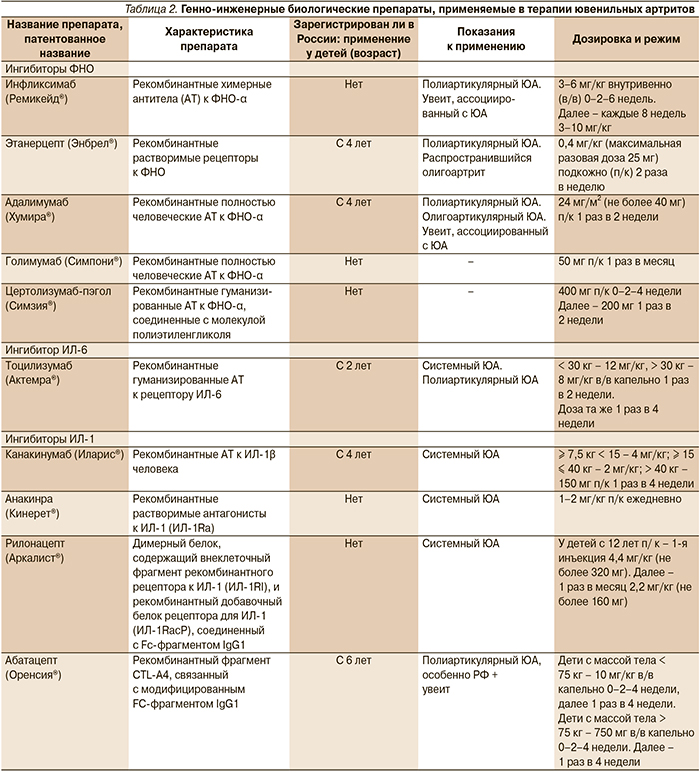
Использование биологических препаратов, действие которых направлено на подавление эффектов цитокинов, а также других факторов, участвующих в воспалении, служит основой современного лечения ЮА. Многие из препаратов достаточно хорошо изучены в рандомизированных контролируемых исследованиях и широко используются на практике [28–36]. Некоторые характеристики ГИБП и их использование при различных вариантах ЮА представлены в табл. 2.
К сожалению, до настоящего времени точно не установлено, как рано следует назначать ГИБП. Тем не менее своевременное назначение биологической терапии во многих случаях помогает избегать риска развития серьезных побочных проявлений стероидной терапии.
ЮА-ассоциированный увеит – довольно частая экстраартикулярная манифестация ЮА, нередко сопровождается развитием серьезных осложнений, таких как катаракта (20 %), глаукома (19 %), лентовидная дистрофия роговицы (16 %), у 15–30 % развивается слепота [4, 11, 37]. Тяжелые осложнения увеита, приводящие к слепоте, возникают у 1–12 % заболевших. Активное лечение увеита должно быть начато безотлагательно. При тяжелом течении воспалительного процесса развитие серьезных осложнений возможно в течение нескольких дней. Поэтому лечение детей с офтальмологическими проявлениями необходимо начинать рано и достаточно агрессивно.
Основой лечения увеита в первую очередь служит максимальное использование методов локальной терапии, осуществляемой офтальмологами. Применяются инстилляции ГК, периокулярные инъекции, интравитреальное введение. При легком течении для купирования увеита часто достаточно только местного лечения. Системную терапию назначают и корректируют ревматологи и офтальмологи, которые должны находиться в тесном контакте. При недостаточной эффективности локальной терапии увеита используются системные ГК, оказывающие быстрое и выраженное противовоспалительное действие.
Показания к назначению иммуносупрессивной терапии: недостаточная эффективность ГК-терапии, ее плохая переносимость с развитием побочных эффектов, необходимость применения высоких доз ГК для поддержания ремиссии увеита, опасных в плане возникновения осложнений. Из БПВП для лечения увеита, резистентного к локальной терапии и ГК, используются МТХ в стандартных дозировках, азатиоприн (1,5–3,0 мг/кг/сут), микофенолата мофетил (CellСept) до 1 г (600 мг/м2) 2 раза в сутки. В редких случаях – циклофосфамид внутрь 1–2 мг/кг/сут, внутривенно – 15–20 мг/кг 1 раз в 3–4 недели, хлорамбуцил внутрь 0,1–0,2 мг/кг/сут. В последние годы при увеитах, ассоциированных с ЮА, с успехом используются ГИБП, в первую очередь ФНО-ингибиторы (инфликсимаб, адалимумаб), а также абатацепт (табл. 2).
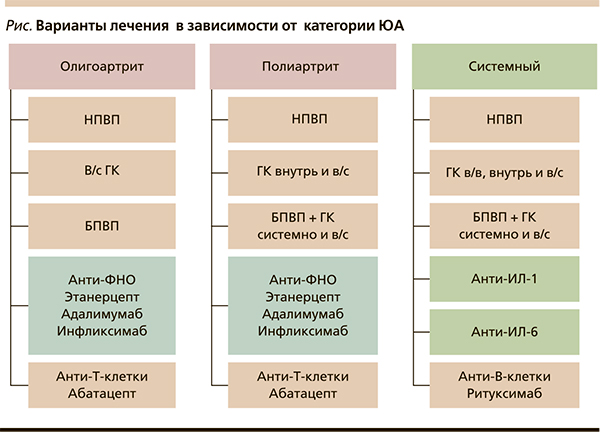
На рисунке схематично представлены варианты лечения ЮА в зависимости от его субтипа.
Таким образом, выбор начальной терапии при ЮА основывается на клинических проявлениях, активности болезни и возможностях, связанных с регистрацией того или иного препарата. В эру до использования биологической терапии ЮА чаще всего ассоциировался с тяжелым течением, деструктивными изменениями в суставах, приводящими к серьезным функциональным нарушениям, задержкой роста и физического развития, с глазными нарушениями и неблагоприятным жизненным прогнозом. За последнее десятилетие достигнут значительный прогресс в лечении ЮА, основанном на применении современных эффективных средств, позволяющем добиваться развития стойкой ремиссии и обнадеживающих отдаленных исходов заболевания.



