Лимфома зоны мантии – опухоль В-клеточного происхождения, встречающаяся в 5 % случаев среди других лимфоидных опухолей. Средний возраст заболевших составляет 60 лет, мужчины болеют в 2 раза чаще. По клиническому течению в настоящее время этот вариант неходжкинской лимфомы относят к агрессивным формам, что означает высокую частоту рецидивов и относительно небольшую продолжительность жизни (5–6 лет), хотя в ряде случаев может наблюдаться индолентное течение с относительно длительной выживаемостью. В литературе есть указания на возможность корреляции индолентного течения с индексом пролиферации Ki-67 [1]. Лимфома зоны мантии по своему происхождению относится к лимфомам герминативного центра и имеет соответствующий набор маркеров дифференцировки. На уровне герминативного центра наблюдается перестройка генов иммуноглобулинов. Клетки лимфомы зоны мантии могут нести черты как мутированного, так и немутированного варианта. При этом первый также ассоциируется с более спокойным течением. Не менее чем в 85 % случаев при лимфоме зоны мантии наблюдается реципрокная транслокация, вовлекающая 11-ю и 14-ю хромосомы и затрагивающая область гена, кодирующего белок Cyclin D1. Функция этого белка заключается в регуляции клеточного цикла путем взаимодействия с циклин-зависимой киназой.
У небольшой части пациентов выявляется экспрессия Cyclin D2 или 3. В клинической картине присутствует лимфопролиферативный синдром, поражение костного мозга встречается с частотой 60 %, центральной нервной системы до 5 %. Наилучшие результаты длительной бессобытийной и общей выживаемости получены при использовании режима R-HyperCVAD\MTx-Ara-C c консолидацией АТКМ (аутологичная трансплантация костного мозга). Однако данный режим отличается высокой токсичностью, что ограничивает его применение. HyperCVAD\MTx-Ara-C индуцирует 93,5 % ответов (38 % полных и 55,5 % частичных ремиссий). Для пациентов с полной ремиссией трехлетняя общая и безрецидивная выживаемость составляет 92 и 72 % [2, 3]. Похожие данные получены немецкой группой по изучению лимфомы зоны мантии, в исследовании которой проводилась альтернирующая терапия R-CHOP\R-DHAP + АТКМ. Благодаря внедрению этих режимов химиотерапии средняя продолжительность жизни возрастает до 7 лет, а в отдельных случаях наблюдаются и более длительные ремиссии [4, 5].
Случаи тотального лимфоматоза желудочно-кишечного тракта (ЖКТ) при лимфоме зоны мантии относятся к редким вариантам течения заболевания, где тактика лечения недостаточно разработана и большинство пациентов имеют неблагоприятный прогноз. При неходжкинских лимфомах вовлечение органов ЖКТ, по данным литературы, встречается в 4–20 % случаев, за исключением лимфомы зоны мантии, где частота поражения значимо выше и составляет 90 %, а в случае тотального полипоза известны отдельные описания. Данная форма сочетается с выраженной потерей веса, тошнотой и рвотой, болями в животе и анемией вследствие кровопотери. Наиболее часто встречается локализация опухоли в желудке (в 51–86 %), реже вовлекается кишечник (6–14 %). При этом перфорации и кровотечения развиваются с разной частотой при различных гистологических вариантах лимфомы [6].

Мы проанализировали 136 пациентов с неходжкинской лимфомой, наблюдавшихся в федеральном Центре сердца, крови, эндокринологии им. В.А. Алмазова в 2008–2012 гг.
Распределение по гистологическим группам указано в таблице.
Поражение ЖКТ лимфомой было выявлено у 12 из 136 пациентов, что составило 8 %. В анализируемой группе наблюдались также другие экстранодальные поражения: кожа – 3 %, центральная нервная система – 3 %, легкие – 1 %, селезенка – 12 %, молочная железа – 1,5 %, костный мозг – 62 %.
Связи между вовлечением органов ЖКТ и поражениями других экстранодальных локализаций не отмечено.
У пациентов с поражением ЖКТ были выявлены следующие гистологические варианты лимфом: диффузная В-крупноклеточная лимфома (ДБКЛ) (5 пациентов), лимфома Беркита (1 пациент), лимфома зоны мантии (5 пациентов), фолликулярная лимфома, гр. 1 (1 пациент).
Поражение органов ЖКТ наблюдалось при следующих гистологических вариантах: ДБКЛ – в 5 случаях, при лимфоме Беркита – в 1, при лимфоме зоны мантии – в 5, при фолликулярной, гр. 1, – в 1 случае. При анализе частоты поражения ЖКТ внутри гистологических групп получены следующие данные: при ДБКЛ – 20 % пациентов имели поражение ЖКТ, при лимфоме зоны мантии – 36 %, при лимфоме Беркита – 20 %, при фолликулярной лимфоме – 8 %. Можно отметить, что поражение ЖКТ встречалось чаще при агрессивных вариантах лимфом.
Перфоративные осложнения наблюдались только среди пациентов с ДБКЛ при поражении кишечника (3 пациента), развитие их происходило в первые 7 суток с момента начала специфического лечения. Эти пациенты имели большой объем опухолевой массы, 2 из 3 были в фазе рецидива заболевания и получали цитозарсодержащий курс химиотерапии с последующим быстрым лизисом опухолевой массы. Один пациент, получавший индукционную терапию, имел в анамнезе неспецифический язвенный колит (обострение купировано приемом глюкокортикоидов). При развившейся перфорации 1 пациент был оперирован успешно (резекция тонкого кишечника с наложением анастомоза) и хирургическое вмешательство не повлияло на сроки проведения 2-го курса противорецидивной химиотерапии, второй пациент погиб в раннем послеоперационном периоде после гемиколонэктомии на фоне явлений полиорганной недостаточности, третий – в позднем послеоперационном периоде после резекции сигмовидной кишки от прогрессирования заболевания и инфекционных осложнений. Перфоративные осложнения сопровождались высоким процентом летальности. Двум пациентам с поражением желудка до начала химиотерапии была успешно выполнена резекция желудка по Бильрот-2, после чего они получили программную химиотерапию (R-CHOP), в настоящий момент живы и находятся в ремиссии.
Таким образом, факторами риска осложнений в анализируемой группе были:
- гистологический вариант ДВКЛ;
- локализация поражения в кишечнике;
- большая опухолевая масса;
- быстрый темп деструкции при проведении химиотерапии.
У большинства больных с лимфомой зоны мантии, несмотря на высокую частоту поражения органов ЖКТ, при проведении R-CHOP-подобных режимов перфоративных осложнений не развивалось. При использовании высокодозных режимов химиотерапии, например R-HyperCVAD, где нейтропенические колиты, мукозиты встречаются с большей частотой, имеется несколько больший риск перфоративных осложнений. Описание такого наблюдения приводится ниже.
Клиническое наблюдение
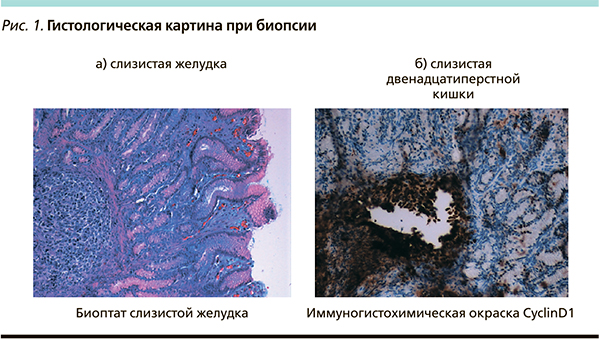
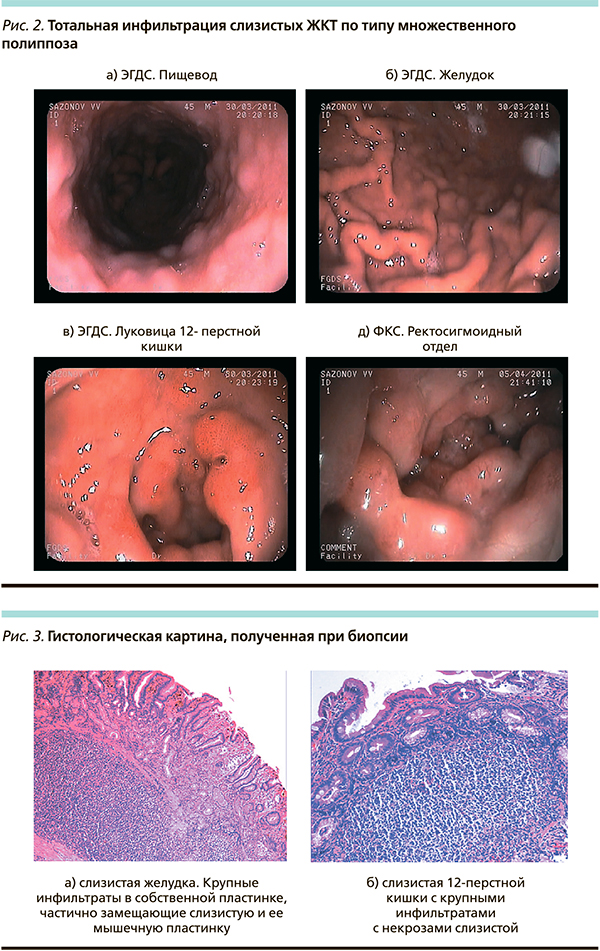
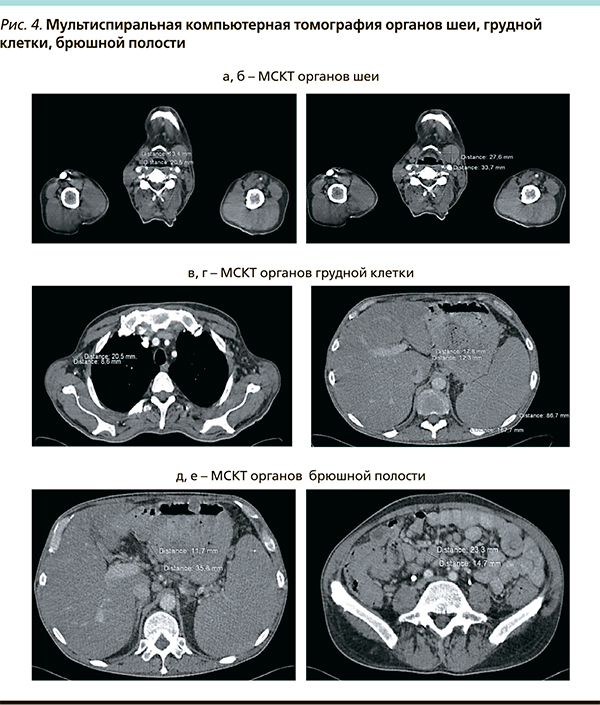
Пациент (мужчина) 45 лет в августе 2010 г. был госпитализирован с подозрением на желудочно-кишечное кровотечение в хирургическое отделение, где по экстренным показаниям были выполнены фиброгастро- и колоноскопии с биопсией (рис. 1, а, б). Была выявлена тотальная инфильтрация слизистых ЖКТ по типу множественного полипоза (рис 2). Гистологически, иммуногистохимически верифицирован диагноз лимфомы зоны мантии (ICD-O 9673/3), классический цитологический подтип. В гистологическом препарате наблюдался массивный нодулярный пролиферат из атипичных лимфоидных клеток. Атипичные клетки средних размеров имели ядра неправильной угловатой формы. В некоторых ядрах видна глубокая борозда. Хроматин неоднородный мелкодисперсный. При иммуногистохимическом исследовании атипичные лимфоидные клетки интенсивно экспрессировали на мембране СД20, СД5; циклин Д1 интенсивно экспрессирован в ядрах всех атипичных клеток (рис. 3).
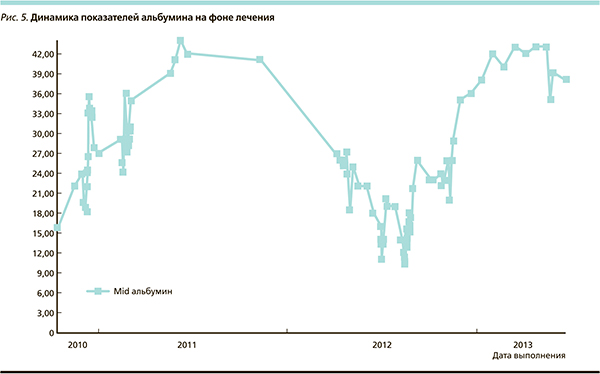
Низкий уровень пролиферативной активности Кi-67(5–7 %) не коррелировал с агрессивным течением заболевания. При мультиспиральной компьютерной томографии (рис. 4) определено поражение подчелюстных, шейных, аксиллярных, внутригрудных, абдоминальных лимфатических узлов, селезенки. Имели место проявления опухолевой интоксикации и значимая 20 %-ная потеря веса за 2 месяца. Поражений костного мозга при гистологическом исследовании не выявлено. Стадия заболевания – IV В, MIPI = 3 (Международный прогностический индекс). Объем опухоли расценивался как большой, о чем свидетельствовал высокий уровень β2-микроглобулина (β2 = 3,89 мкг/мл, норма: 0,000–2,000), при этом уровень лактатдегидрогеназы не превышал нормальных значений. Особенностью случая явилась выраженная протеинурия, которая трактовалась как паранеопластический нефротический синдром; секреция моноклонального белка не выявлена. Первый блок 1-го курса химиотерапии в режиме R-HyperCVAD был проведен 25.10–07.11.10, пациент перенес лечение относительно удовлетворительно. Положительный эффект был достигнут в виде купирования В-симптоматики, уменьшения в размерах до нормы периферических лимфатических узлов, значимого уменьшения протеинурии. Наблюдалось развитие фебрильной нейтропении 4-й ст.; стоматита – 1-й ст.; энтеропатии, обусловленной лизисом опухоли в кишечнике. К началу 2-го блока R-HyperCVAD осложнения были купированы. Оценка степени редукции поражения ЖКТ была затруднена, т. к. эта зона недостаточно хорошо визуализируется при контрастной спиральной компьютерной томографии. Технической возможности проведения позитронно-эмиссионной компьютерной томографии в тот период не было. Эндоскопически признаки инфильтрации сохранялись. Показатели нутриционного статуса оставались неудовлетворительными. Применение метотрексата и высоких доз цитозара во втором блоке R-HyperCVAD сопровождалось развитием выраженной негематологической и гематологической токсичности: нейтропении 4-й ст., анемии 3-й ст., тромбоцитопении 4-й ст. Наиболее тяжелым осложнением было развитие мукозита 4-й степени, признаков желудочно-кишечного кровотечения, распада опухоли с появлением симптомов раздражения брюшины и сепсиса, ассоциированного с Е. Coli, Enterobacteriaceae от 02.12.10. Симптомы раздражения брюшины расценены как прикрытая перфорация. На фоне антибактериальной, антисекреторной, инфузионной терапии с добавлением парентерального питания, включением в терапию гемотрансфузий, стимуляции гемопоэза гранулоцитарным колониестимулирующим фактором осложнения удалось купировать консервативно. Хирургическая тактика не была использована по причине тотального поражения ЖКТ. Возникшее угрожающее жизни осложнение не позволило продолжить программу R-HyperCVAD в дальнейшем, в т. ч. перейти к этапу трансплантации. Полной ремиссии заболевания не наблюдалось, и к моменту завершения лечения осложнений имело место возобновление прогрессирования заболевания. В качестве следующих линий терапии пациент получал бортезомиб, терапию имидами, ингибитором bcr-сигнального пути, бендамустин, часть из препаратов в комбинации с ритуксимабом. Контролировать заболевание удалось на фоне второй и более линий терапии в течение 24 месяцев, однако без достижения полной ремиссии. Наиболее рефрактерным сайтом поражения стал ЖКТ (лимфоаденопатия, спленомегалия, паранеопластический нефротический синдром были купированы). Значимое снижение синдрома мальабсорбции и прибавка веса на 20 кг с улучшением нутриционного статуса наблюдались на фоне лечения ингибитором bcr-сигнального пути. Предположительно, что уровень альбумина коррелировал со степенью ответа на терапию при данном варианте заболевания (рис. 5). На этапе улучшения нутриционного и общесоматического статуса была сделана вторая попытка интенсификации протоколом R-BAC, что не привело к купированию прогрессирования. В настоящее время пациент получает паллиативную лучевую терапию на опухолевый очаг в позвоночнике.
Обсуждение и выводы
Риск перфорации при лимфомах с поражением ЖКТ иногда заставляет врачей отдавать предпочтение постепенной циторедукции и откладывать начало интенсивной химиотерапии. Применительно к лимфоме зоны мантии с поражением ЖКТ, где риск перфорации значительно ниже, чем при ДВКЛ, и составляет, по данным литературы, 2,1 % (при терапии по программе СНОР), даже при введении в программу лечения высоких доз цитозара (частота встречаемости некроза кишки не превышает 1 на 100 случаев), несмотря на показанный случай, представляется допустимым использование интенсивной химиотерапии в дебюте. Риск гибели от прогрессирования заболевания при отказе от интенсивной терапии (R-HyperCVAD, R-CHOP/R-DHAP и АТКМ) общепризнанно считается более высоким [4]. Возможно, компромиссным решением в данном случае будет применение альтернирующего курса R-CHOP/R-DHAP, что позволит избежать метотрексат-индуцированных мукозитов, сократить период нейтропении. Терапия таргетными и иммуномодулирующими препаратами (бортезомиб, леналидомид, ингибиторы брутоновской киназы, m-TOR ингибиторы) находится в фазе активного изучения, данные о преимуществах перед интенсивной химиотерапией пока не получены, и эта группа противоопухолевых препаратов в настоящее время может использоваться не в первой линии терапии или в клинических исследованиях.
По нашему мнению, выбирая тактику лечения при тотальном лимфоматоидном полипозе, необходимо оценить следующие факторы высокого риска перфоративных осложнений:
- глубина инвазии, наличие зон некроза по данным гистологического исследования;
- объем опухолевой массы, повышение лактатдегидрогеназы и β2-микроглобулина;
- локализация в кишечнике;
- высокая степень пролиферативной активности опухолевых клеток;
- наличие синдрома мальабсорбции, осложненного белково-энергетической недостаточностью более 2-й степени;
- факторы риска клостридиального колита (длительная антибактериальная терапия) и инфицированность цитомегаловирусом.
В литературе наибольшее число сообщений о перфорации встречается при использовании бевацизумаба при опухолях кишечника, при этом обращается внимание, что риск перфорации могут усиливать «сосудистые» факторы (атеросклероз, компрессия сосудов, приводящие к ишемии органов ЖКТ), а также должно настораживать наличие болевого абдоминального синдрома [12]. Использование фекального кальпротектина как маркера воспалительной активности доказано при болезни Крона и неспецифическом язвенном колите, а также при кишечной форме реакции трансплантат против хозяина при аллогенной трансплантации гемопоэтических клеток [13]. Информативность в случае лимфоматоза кишки невысока.
В описываемом нами случае отмечено незначительное превышение нормы фекального кальпротектина без четкой связи с клиническим течением заболевания.Опыт применения интенсивной химиоиммунотерапии и трансплантации костного мозга при лимфоматоидном полипозе имеет место быть в виде единичных клинических случаев, и именно эта тактика дает наилучшие показатели выживаемости [14].



