Одной из актуальных проблем современной онкологии является лечение больных колоректальным раком (КРР). Ежегодно в мире регистрируется около 1,2 млн новых случаев заболевания раком толстой кишки и 700 тыс. случаев смерти от него. В Европе показатели составляют 370 и 200 тыс. соответственно [1]. В целом в европейских странах КРР составляет 13 % в структуре всей онкологической заболеваемости. В Российской Федерации выявляется около 57 тыс. новых случаев заболевания в год, а в структуре онкологической заболеваемости КРР стабильно занимает 2–3-е места. Не более 20 % больных на момент установления диагноза имеют I–II стадии болезни. У 40 % регистрируется вовлечение в процесс регионарных лимфоузлов, а у каждого третьего диагностируются отдаленные метастазы. Дополнительно к этому у 40–60 % больных, которым были выполнены радикальные хирургические вмешательства, в процессе наблюдения наступает диссеминация процесса, что расширяет группу пациентов, требующих проведения лекарственной терапии [2].
Наиболее часто в 1-й линии лечения метастатического КРР (мКРР) применяется двухкомпонентный режим химиотерапии (ХТ). Однако в ряде исследований с использованием трехкомпонентной схемы, включающей оксалиплатин, иринотекан и 5-фторурацил (5-ФУ), в 1-й линии ХТ мКРР продемонстрированы более высокие частота объективного ответа (ЧОО), выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ) по сравнению с двухкомпонентным режимом (FOLFIRI). Так, в рандомизированном исследовании с медианой наблюдения 18,4 месяца (244 пациента с мКРР) [3, 4] 6-месячная индукционная ХТ, включившая 5-ФУ (путем непрерывной инфузии), лейковорин, иринотекан и оксалиплатин (FOLFOXIRI), продемонстрировано статистически значимое увеличение ЧОО, частоты радикальных резекций метастазов, ВБП и ОВ по сравнению с 6-месячной индукционной ХТ, включившей 5-ФУ, лейковорин и иринотекан (FOLFIRI). Режим FOLFOXIRI обеспечил достоверное увеличение медианы ВБП (9,8 против 6,8 месяца; р < 0,001) и медианы ОВ (23,4 против 16,7 месяца; р = 0,026) с 5-летней выживаемостью 15 против 8 % для пациентов, получавших FOLFIRI. ЧОО составила 60 % в группе FOLFOXIRI против 34 % в группе FOLFIRI (р < 0,0001). Частота выполнения резекций метастазов R0 была выше в группе FOLFOXIRI: 15 против 6 % (р = 0,033) среди всех 244 пациентов и 36 против 12 % (р = 0,017) среди пациентов с наличием метастазов только в печени. Частота фебрильной нейтропении (5 % в группе FOLFOXIRI против 3 % в группе FOLFIRI) и диареи 3-й и 4-й ст. (20 против 12 %) существенно не различались. Однако в группе FOLFOXIRI отмечены явления периферической нейропатии 3-й (19 %) и нейтропения 4-й ст. (50 %), не зарегистрированные в группе FOLFIRI.
Как известно, повышение эффективности нередко сопряжено с высокой токсичностью 3-й или 4-й ст., такой как нейтропения и диарея, иногда даже приводящей к гибели пациентов. Было проведено исследование II фазы [5] ранее не леченных пациентов с мКРР с целью оценки безопасности и эффективности режима, включившего 5-ФУ, фолиниевую кислоту, оксалиплатин и иринотекан (FUFOXIRI) с еженедельным введением иринотекана 70 мг/м2, оксалиплатина 50 мг/м2, фолиниевой кислоты 500 мг/м2 и 5-ФУ 2000 мг /м2 в дни 1, 8, 15 и 22 каждые 36 дней. В исследование были включены 22 пациента. Режим FUFOXIRI в целом хорошо переносился без фебрильной нейтропении или токсичности 4-й ст. Наиболее распространенными побочными эффектами 3-й ст. были диарея и нейтропения, которые наблюдались у 24 % больных. Редукции доз из-за токсичности были проведены 48 % пациентов в целом и 60 % больных, получивших не менее двух циклов FUFOXIRI. ЧОО составила 55 %, медианы ВБП и ОВ – 10 и 18 месяцев соответственно, т.е. данное исследование продемонстрировало превосходную эффективность режима FUFOXIRI для пациентов с мКРР.
В режиме FOLFOXIRI 5-ФУ может быть заменен на капецитабин – пероральный препарат группы фторпиримидинов со схожей эффективностью. За последнее время проведено много исследований, продемонстрировавших целесообразность комбинации оксалиплатина, иринотекана и капецитабина (XELOXIRI), в которых были установлены рекомендованные дозы этих препаратов. Оценка эффективности режима XELOXIRI проведена в исследовании Vasile и соавт. [6], в котором 36 пациентов с неоперабельным мКРР получали иринотекан 165 мг/м2 и оксалиплатин 85 мг/м2 в день 1 + капецитабин 2000 мг/м2 в дни 1–7 каждые 2 недели. Нейтропения и диарея наблюдались у 30 % больных. Было зарегистрировано 2 полных и 22 частичных ответа, что соответствовало общей ЧОО – 67 %. При медиане наблюдения 17,7 месяца медианы ВБП и ОВ составили 10,1 и 17,9 месяца соответственно. Было показано, что замена 5-ФУ на капецитабин в комбинации с оксалиплатином и иринотеканом не снижает эффективности режима. Однако комбинация XELOXIRI ассоциируется с высокой частотой диареи и, следовательно, не должна рассматриваться как альтернатива FOLFOXIRI. Bajetta и соавт. [7] сообщили о результатах исследования I–II фаз, проведенного с целью определения безопасности и эффективности режима ХТ капецитабин + оксалиплатин + иринотекан (каждые две недели) для пациентов с мКРР, ранее не получавших лечения по поводу метастатической болезни. В ходе данного исследования 38 больных получили в среднем по 6 циклов ХТ. Все пациенты получали иринотекан в день 1, оксалиплатин 85 мг/м2 в день 2 и капецитабин 1000 мг/м2 перорально 2 раза в день, в дни 2–6 каждые 2 недели. Для иринотекана было изучено 3 уровня дозы – от 150 до 180 мг/м2. Рекомендованная доза препарата в исследовании II фазы составила 180 мг/м2. Токсичность было управляемой: ее наиболее тяжелыми проявлениями были диарея (24 %) и тошнота (16 %). Из 27 пациентов, получивших лечение в рекомендованной дозе, 17 достигли частичного регресса (общая ЧОО – 63 %). Восьми пациентам было выполнено удаление метастазов в печени. Медианы ВБП и ОВ составили 8,5 и 23,5 месяца соответственно. Хорошая переносимость и удобство использования позволили рекомендовать данный режим ХТ для уменьшения размеров метастазов КРР в печени перед выполнением радикальной операции.
Целью нашей работы была разработка режима 1-й линии лечения мКРР, который бы обладал высокой эффективностью и низкой токсичностью.
Материал и методы
В исследование включены больных старше 18 лет с морфологически подтвержденным КРР, ранее не получавших ХТ по поводу метастатической болезни, наличием измеряемых проявлений болезни, ожидаемой продолжительностью жизни ≥ 6 месяцев, с адекватным венозным доступом (подкожный венозный порт). Больные находились в удовлетворительном состоянии: функциональный статус пациента по шкале Восточной кооперированной онкологической группы (ECOG) – от 0 до 2 баллов. Было допустимо участие пациентов, которые в прошлом получали адъювантную или неоадъювантную ХТ по поводу КРР, а также больных, у которых прогрессирование заболевания наступило в течение > 6 месяцев после окончания адъювантной ХТ по поводу операбельного рака толстой кишки.
В исследование были включены 7 больных мКРР, находившихся на лечении в отделении химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН с марта 2013 г.
по настоящее время. Характеристика пациентов представлена в табл. 1.
Как следует из табл. 1, первичная опухоль была удалена 6 больным. Среди гистологических форм опухоли преобладала умеренно дифференцированная аденокрацинома (у 4 из 7 пациентов). Всем больным был определен K-RAS-статус опухоли («дикий» – у троих, «мутантный» – у четверых). Все пациенты имели множественные метастазы в легких (2 больных) или печени (4 больных) больших размеров (до 18,3 см). У одного больного одновременно с метастазами в печени выявлены внепеченочные проявления заболевания.
Всем больным комплексное обследование проведено до начала лечения и после каждых двух курсов ХТ. Оно включало: анализ крови на опухолевые маркеры – раково-эмбриональный антиген (РЭА) и СА 19,9; ультразвуковое исследование органов брюшной полости, забрюшинного пространства, малого таза, забрюшинных, пахово-подвздошных, бедренных лимфоузлов; компьютерную (КТ)/магнитно-резонансную томографию (МРТ) органов брюшной полости, забрюшинного пространств, таза с внутривенным контрастированием; рентгенографию и КТ органов грудной клетки; определение статуса гена К-RAS. Все больные получали ХТ в режиме: оксалиплатин 65 мг/м2, иринотекан 100 мг/м2 внутривенно дни 1 и 15; 5-ФУ 200 мг/м2/сут, постоянная инфузия, дни 1–14 с интервалами в 2 недели.
В целом в вышеуказанном режиме было проведено 49 курсов ХТ (в среднем 7 курсов на 1 больного). Одному пациенту к вышеуказанному режиму лечения был добавлен панитумумаб 6 мг/кг каждые 2 недели.
Оценка эффективности химиотерапии проводилась каждые 2 месяца (на основании критериев RECIST, редакция 1.1).
Оценка безопасности лечения проведена на основании зарегистрированных нежелательных явлений, которые классифицировались по степени тяжести в соответствии с критериями оценки токсических реакций, разработанными Национальным онкологическим институтом, в версии 4.0 (NCI CTCAE, версия 4.0).
Результаты
Объективный ответ опухоли на лечение (полная и частичная ремиссия) был достигнут в 100 (у всех 7 больных) % случаев. Полная ремиссия зарегистрирована у двоих пациентов. Одному из них проведено 8 курсов ХТ (8 месяцев лечения) с последующим динамическим наблюдением в течение 5 месяцев без признаков прогрессирования болезни (5 месяцев +). Второму пациенту также было проведено 8 курсов ХТ в вышеуказанном режиме + панитумумаб. Был достигнут частичный эффект: уменьшение размеров метастатического конгломерата в печени с 18,3 до 3,5 см. Это позволило выполнить правостороннюю гемигепатэктомию – установлен полный морфологический регресс опухоли. Время наблюдения после радикальной операции – 5 месяцев +.
Частичная ремиссия отмечена у 5 больных: 2 пациента получили 8 курсов ХТ, после чего в связи с прогрессированием они были переведены на 2-ю линию ХТ; 3 больных на момент публикации материала продолжают лечение (2+, 6+, 12+ курсов).
У всех 7 больных до начала лечения был отмечен повышенный уровень РЭА, значительное снижение которого наблюдалось уже после 1–2 курсов ХТ (например, с 3689,0 до 360,4 или с 81,56 до 8,39 нг/мл), что в значительной степени отражало эффективность лечения.
Все побочные эффекты, развившиеся в ходе лечения, представлены в табл. 2. Частота побочных эффектов рассчитана на число проведенных курсов ХТ (n = 49).
Наиболее частыми побочными эффектами в нашем исследовании были: тошнота (I ст. – 20, 4 %, II ст. – 16,3 %) и периферическая сенсорная нейропатия (16 %), причем частота нейропатии II ст. составила лишь 2,0 %. Диарея II и III cт. встречалась редко (4,1 и 4,1 % соответственно). Гематологической токсичности отмечено не было.
Пять пациентов получили лечение в полном объеме без редукции доз препаратов или увеличения интервалов между курсами. У одного больного дозы химиопрепаратов были редуцированы на 25 % в связи с диареей III ст. У одного пациента после 7 курсов ХТ был отменен оксалиплатин из-за явлений периферической сенсорной нейропатии II ст.
В качестве демонстрации эффективности нового режима I линии химиотерапии мКРР приводим клиническое наблюдение.
Больная Х. 65 лет
Из анамнеза: 06.10.2011 – двуствольная сигмостомия по поводу рака прямой кишки T4bN0M0 (гистологически – аденокарцинома; K-RAS – «дикий» тип), осложненного кишечной непроходимостью. На операции выявлен массивный неподвижный конгломерат, состоящий из обширной опухоли прямой и сигмовидной кишки с распространением на левую боковую стенку таза и тело матки.
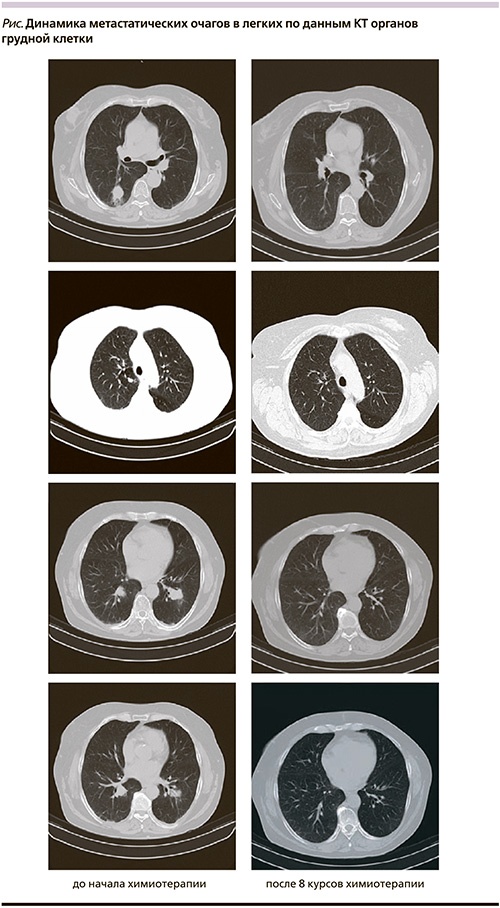
С 19.10.2011 по 11.11.2011 – курс дистанционной лучевой терапии (РОД – 4 Гр Ч 3 раза в неделю, СОД – 40 Гр) с 4 сеансами дистанционной СВЧ-гипертермии. 07.02.2012 – брюшно-промежностная экстирпация прямой кишки; экстирпация матки с придатками. Гистологическое исследование: в прямой кишке разрастание муцинозной аденокарциномы. Опухоль прорастает мышечный слой, врастает в параректальную клетчатку и миометрий. Лечебный патоморфоз II степени. Сосудистой инвазии не обнаружено. В краях резекции препарата и во влагалище – без элементов опухолевого роста. В двух лимфатических узлах – без метастазов. Далее – динамическое наблюдение до февраля 2013 г. (в течение года). При очередном контрольном обследовании (02.2013): прогрессирование заболевания – множественные метастазы в обоих легких. До начала химиотерапии: РЭА – 66,17 нг/мл (n < 2,5 нг/мл), опухолевый маркер СА 19,9 – 74,53 ЕД/мл (n < 35,0 ЕД/мл). По данным КТ органов грудной клетки от 04.03.2013: в S2 верхней доли справа – очаг размером 1,0 см, в субплевральном отделе S6 нижней доли справа – очаг размером 2,5 × 2,2 см на фоне перифокальных изменений легочной ткани в виде мелких перибронхиальных очагов, в S10 нижней доли справа по ходу бронхо-сосудистого пучка – очаг размером 2,3 × 2,0 см, в S9–S10 нижней доли левого легкого по ходу бронхо-сосудистого пучка – очаг размером 3,4 × 2,6 см, в парамедиастинальном отделе S10 нижней доли слева – очаг размером 1,4 см.
С апреля по декабрь 2013 г. в отделении химиотерапии и комбинированного лечения злокачественных опухолей ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН проведено 8 курсов ХТ (8 месяцев лечения) в режиме: иринотекан 100 мг/м2 – 160 мг внутривенно капельно, дни 1 и 15, 2 недели – перерыв; оксалиплатин 65 мг/м2 – 100 мг внутривенно капельно, дни 1 и 15, 2 недели – перерыв; инфузия 5-ФУ 200 мг/м2/сут – 350 мг/сут внутривенно непрерывно с использованием помпы со скоростью 2 мл/ч, дни 1–14, 2 недели – перерыв. После проведения 7 курсов ХТ в вышеуказанном режиме были отмечены явления периферической сенсорной нейропатии II ст., в связи с чем 8-й курс проведен без оксалиплатина. Другой клинически значимой токсичности не отмечено.
Контрольное обследование проводили после каждых двух курсов лечения. Метастазы в легких перестали определяться после проведения 4 курсов ХТ (КТ от 12.09.2013). Отмечалась нормализация опухолевого маркера СА 19,9 (26,23 ЕД/мл от 27.08.2013) и значительное снижение уровня РЭА – до 3,79 нг/мл. При контрольном обследовании после 8 курсов химиотерапии (КТ от 13.01.2014): патологических изменений в грудной полости не обнаружено (см. рисунок). Опухолевые маркеры от 09.01.2014: РЭА – 3,91 нг/мл, СА 19,9 – 27,90 ЕД/мл.
Пациентка находится под динамическим наблюдением в течение 5 месяцев с момента окончания лечения (с 19.12.2013) без признаков болезни. Достигнутый эффект – полная ремиссия множественных метастазов в легких.
Таким образом, разработанный режим I линии лечения мКРР продемонстрировал высокую эффективность и безопасность при значительных размерах множественных метастазов в легких.
Заключение
Новый режим 1-й линии ХТ мКРР, включивший комбинацию оксалиплатина, иринотекана и 5-ФУ в еженедельном и продленном режиме ± панитумумаб, продемонстрировал высокую эффективность и низкую токсичность. Объективный ответ опухоли на лечение (полная ремиссия +
частичная ремиссия) зарегистрирован в 100 % случаев. Данный режим ХТ может быть рекомендован при наличии неблагоприятных прогностических факторов, изначально нерезектабельных метастатических очагах, значительных размерах множественных метастазов в печени и легких.


