Рак молочной железы (РМЖ) является наиболее часто диагностируемым онкологическим заболеванием и ведущей причиной смерти от рака европейских женщин, что составляет одну пятую от всех случаев женской смертности, вызванной раком (рис. 1). Каждые 6,5 минут в Европе от этой патологии умирает одна женщина [1, 2].
Заболеваемость РМЖ по-прежнему растет. В России в 2012 г. насчитывалось более 380 случаев РМЖ на 100 тыс. населения [3]. Медиана общей выживаемости (ОВ) больных РМЖ остается неудовлетворительной и составляет 20–36 месяцев (по данным различных клинических исследований) [4, 5].
У 6% больных уже на момент постановки диагноза выявляется метастатический процесс (в России – у 10%). У трети женщин с ранней стадией РМЖ отдаленные метастазы (МТС) развиваются в течение 5 лет с момента постановки диагноза [6]. Диссеминированный РМЖ – это хроническая болезнь порой с длительным рецидивирующим течением и фатальным исходом. Лечение, в т.ч. лекарственное, носит паллиативный характер и призвано увеличить продолжительность жизни больной без ухудшения качества [7].
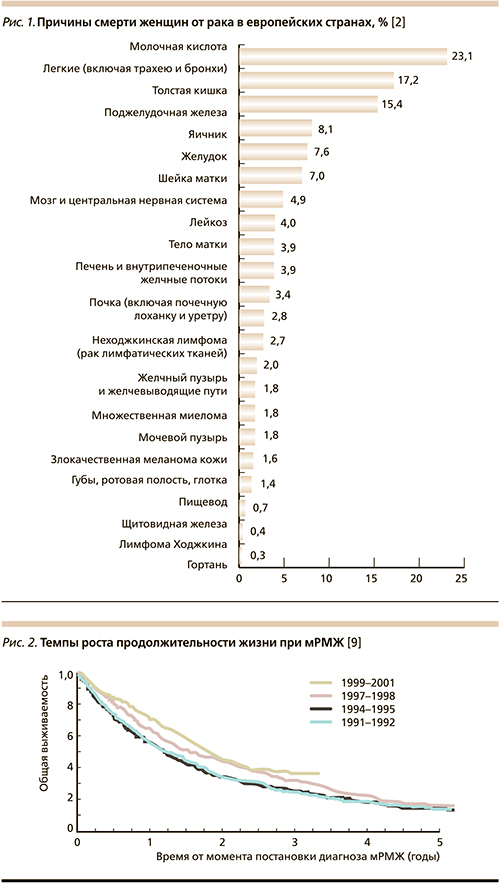
Лечение метастатического РМЖ (мРМЖ) остается нерешенной задачей [1]. Главной целью в лечении является увеличение ОВ, а вторичными целями – увеличение времени до прогрессирования заболевания, максимальный контроль симптомов заболевания, сохранение или улучшение качества жизни и предотвращение серьезных осложнений [8]. За последние годы выживаемость больных мРМЖ увеличилась благодаря достижениям специфической противоопухолевой и поддерживающей терапии [9] (рис. 2, табл. 1).
Но, несмотря на совершенствование методов лечения, 5-летняя выживаемость пациенток с метастатической формой болезни составляет менее 25% [10]. До последнего времени отсутствовали результаты исследований, демонстрирующих очевидные преимущества в отношении выживаемости среди пациенток с мРМЖ. Отсутствуют и общепринятые оптимальные стандарты лечения, по крайней мере начиная с 3-й линии химиотерапии. Базовыми для режимов 1-й и 2-й линий лечения мРМЖ остаются антрациклины и таксаны [11].
Однако в связи с хроническим течением мРМЖ лечение после 2-й линии химиотерапии не заканчивается и пациенткам требуется продолжение терапии. В настоящее время доказано отсутствие преимуществ в ОВ для комбинированной химиотерапии по сравнению с монотерапией как для 1-й, так и для последующих линий лечения [12]. Комбинации рекомендованы только при признаках быстрого клинического прогрессирования, жизнеугрожающих висцеральных МТС или необходимости скорейшего контроля симптомов и/или заболевания [1] ценой значимо более высокой токсичности, что немаловажно для предлеченных больных мРМЖ [11]. В связи с этим начиная с 3-й линии лечения рекомендуется монотерапия [13].
Неуклонное развитие биологии и генетики привело к появлению множества молекул, которые воздействуют на те или иные пути деления опухолевой клетки. Это микротрубочковые ингибиторы, моноклональные антитела, тирозинкиназные ингибиторы, PARP (Poly ADP Ribose Polymerases)-ингибиторы, инактиватор эстрогеновых рецепторов, антиметаболиты, ингибиторы мТОR (mammalian target of rapamycin) и др. В настоящее время в своем арсенале мы имеем ряд популярных цитостатиков (капецитабин, винорелбин, гемцитабин), эффективность которых в монотерапии в 3-й и последующих линиях лечения мРМЖ невысока – 15–29% [11].

Таким образом, в связи с совершенствованием поддерживающей терапии и появлением множества активных цитостатиков и таргетных препаратов в развитых странах большинство женщин становятся кандидатами на длительное лечение несколькими линиями. Обзоры клинической практики показывают, что некоторые пациентки получают 8 и более различных схем, особенно женщины с опухолями, имеющими рецепторы гормонов или HER2, которым эффективное лечение и особенности опухолевого роста позволяют применять несколько линий терапии без выраженной токсичности [14].
Предикторов эффективности химиотерапии на сегодняшний день нет. Учет биологического подтипа опухоли при назначении лекарственного лечения – это прагматический подход, и основным критерием служит клиническое течение. Если при HER2-позитивном и трижды негативном РМЖ химиотерапия – это основной компонент лечения, то при люминальном А-типе цитостатики так или иначе назначаются при гормонорезистентности или висцеральном кризисе. Таким образом, при генерализации опухолевого процесса химиотерапию на разных этапах получают почти все больные.
При принятии решения о назначении лечении мы рассматриваем ряд факторов, включая предшествующую историю терапии, время до рецидива заболевания, предпочтения пациентки, а также собственные предпочтения, доступность лекарств, токсичность и качество жизни [1].
Не существует стандарта терапии, назначаемой после антрациклинов и таксанов для лечения пациенток с мРМЖ [15–17]. Несмотря на наличие нескольких хорошо известных цитотоксических препаратов для этой группы пациенток, у некоторых больных либо отсутствует ответ на лечение, либо со временем развивается резистентность к антрациклинам и таксанам [18–19].
В связи с отсутствием результатов исследований, демонстрирующих очевидные преимущества в отношении выживаемости пациенток с мРМЖ, отсутствует общепринятое мнение относительно оптимального стандарта лечения. Существует большая потребность в наличии хорошо переносимых препаратов, которые были бы способны увеличить продолжительность жизни женщин, ранее получавших лечение по поводу мРМЖ [1, 16, 20, 21].

До последнего времени не было четких доказательств того, что какие-либо варианты цитотоксической терапии, используемые после двух стандартных линий лечения, увеличивают выживаемость больных. Однако в 2010 г. появился препарат эрибулин, который показал преимущества в отношении не только непосредственной эффективности, но и общей выживаемости по сравнению со сводными результатами, отражающими рутинную практику лечения после прогрессирования на 2-й линии, применявшейся до сих пор [20].
Эрибулина мезилат (E7389, Халавен®, Eisai Co, Токио, Япония) – нетаксановый ингибитор активности микротрубочек, который относится к противоопухолевым средствам класса галихондринов. Он представляет собой структурно модифицированный синтетический аналог галиходрина B – натурального вещества, выделенного из морской губки Halichondria okadai.
Halichondrin B показал антипролиферативную активность на некоторых клеточных линиях опухолей человека, таких как РМЖ и рак простаты, меланома и колоректальный рак [22].
Эрибулин характеризуется новым механизмом действия, отличным от действия других препаратов, мишенью которых служит тубулин [23–27]. Он подавляет фазу роста микротрубочек, не влияя на фазу укорочения, что приводит к секвестрации тубулина с образованием функционально неактивных агрегатов. В доклинических исследованиях эрибулин вызывал менее выраженную, чем паклитаксел, нейропатию [28] и сохранял активность в клеточных линиях с устойчивостью к паклитакселу, обусловленной мутациями β-тубулина [29].
Необратимый блок митоза редко встречается среди ингибиторов микротрубочек, поэтому эта особенность в сочетании с его селективным связыванием с положительным концом микротрубочек отличает механизм действия эрибулина от других препаратов, воздействующих на тубулин, включая таксаны, алкалоиды барвинка и эпотилоны [12]. Таким образом, эрибулин эффективен в отношении больных с устойчивостью к другим препаратам, мишенью которых служит тубулин [30].

Эффективность и контролируемый профиль токсичности эрибулина были продемонстрированы в ряде клинических исследований I и II фаз [13–17].
В исследованиях I [31–32] и II фаз была продемонстрирована эффективность эрибулина с предсказуемым профилем побочных эффектов для больных местнораспространенным или мРМЖ, ранее получавших несколько линий химиотерапии. В двух исследованиях II фазы [33–34] пациентки (n=103 и n=299) ранее получали 4 (медиана) схемы химиотерапии; частота объективного ответа составила 11,5% (10/87 пациенток; 95% доверительный интервал [ДИ] – 5,7–20,1) и 9,3% (25/269 пациенток в популяции для оценки эффекта; 95% ДИ – 6,1–13,4), а медиана ОВ составила 9,0 и 10,4 месяца соответственно.
На основании этих данных было проведено клиническое исследование III фазы EMBRACE (Eisai Metastatic Breast Cancer Study Assessing Physician’s Choice Versus E7389), в котором эрибулин в монотерапии сравнивался с «терапией по выбору врача» (ТВВ), т.е. с рутинной клинической практикой назначения лечения больным метастатическим и местно-рецидивирующим РМЖ, у которых заболевание прогрессировало после проведения двух и более линий лечения по поводу распространенного заболевания, в т.ч. с включением антрациклинов и таксанов. Всего были включены 762 пациентки, рандомизированные в группу лечения эрибулином или терапию по выбору врача (ТВВ) в соотношении 2:1. Данное исследование показало, что у больных в группе терапии эрибулином (n=508) (1,4 мг/м2 в дни 1 и 8 каждый 21-й день) по данным обновленного анализа было зафиксировано достоверное увеличение ОВ по сравнению с ТВВ (n=254) – 13,2 и 10,5 месяца соответственно (рис. 3). При этом однолетняя выживаемость составила 54,5 и 42,8% соответственно. Эти данные были опубликованы в 2011 г. J. Сortes и соавт. [20].
На основании результатов исследования EMBRACE препарат эрибулин (Халавен®) был зарегистрирован в США и странах Евросоюза в 2011 г., а в России – в 2012-м для лечения метастатического и местно-распространенного РМЖ в качестве 3-й и последующих линий терапии.

В другом, 301-м исследовании III фазы пациентки, которые получили до двух предшествующих схем химиотерапии по поводу распространенной формы заболевания, были рандомизированы в группу терапии эрибулином (в дозе, аналогичной таковой в исследовании EMBRACE) или капецитабином (1,25 г/м2 2 раза в сутки в дни 1 и 14 каждый 21-й день), статистически значимого преимущества эрибулина над капецитабином в отношении выживаемости показано не было [10]. Однако, по данным заранее предусмотренного подгруппового анализа, медиана ОВ была более продолжительной на фоне терапии эрибулином, чем на фоне применения капецитабина у пациенток с HER2-негативной или тройной негативной формой РМЖ.
В объединенном анализе двух исследований III фазы в совокупной популяции ОВ выживаемость без прогрессирования и частота ответа были проанализированы в ITT популяции (всей популяции больных, включенных в исследования) и в отдельных подгруппах (рис. 4).
В общей сложности 1062 пациентки были рандомизированы в группу терапии эрибулином и 802 – в контрольную группу. Медиана ОВ составила 15,2 месяца на фоне приема эрибулина по сравнению с 12,8 месяца в группе контроля (ОР=0,85; 95% ДИ – 0,77, 0,95; р=0,003). Во всех изучаемых подгруппах данные по ОВ оказались в пользу эрибулина; в некоторых подгруппах наблюдались значительные улучшения, в частности у женщин с HER2-негативной формой заболевания (ОР=0,82; р=0,002), хотя эффект у пациенток с HER2-негативной, но гормон-рецептор-позитивной формой заболевания не достиг статистической значимости; благоприятные эффекты наблюдались также в т.ч. у пациенток с эстроген-рецептор-негативной и тройной негативной формами заболевания. Эти результаты показали, что эрибулин улучшает ОВ у пациенток различных подгрупп с распространенным РМЖ/мРМЖ, которые ранее получали препараты группы антрациклинов и таксанов. Женщины с HER2-негативной формой заболевания относятся к той группе пациенток, для которых применение эрибулина также эффективно [20].
На основании результатов исследования 301 зарегистрировано расширение показания для назначения эрибулина: местно-распространенный или мРМЖ после одной линии химиотерапии по поводу распространенного заболевания. Предшествующая терапия должна включать антрациклины и таксаны в адъювантном режиме или в условиях метастатической формы заболевания, за исключением тех пациентов, которым не могли назначаться данные препараты. Таким образом, в арсенале онкологов появился эффективный, в т.ч. и в отношении ОВ, цитостатик с приемлемым токсическим профилем.
В данной статье представлен клинический случай успешного лечения интенсивно-предлеченного мРМЖ.
Клинический случай
У больной С. в 2002 г. (анамнез 13 лет) в возрасте 43 лет был выявлен рак правой молочной железы, мультицентрическая форма роста Т2N1М0, IIб ст. Сопутствующее заболевание – узловой зоб. По этому поводу было проведено комплексное лечение. Выполнена операция от 31.07.2002 – радикальная мастэктомия справа+одномоментно левосторонняя гемиструмэктомия. Гистологически: мультицентрическая форма роста рака правой молочной железы, 2 опухолевых узла, имеющих строение инфильтрирующего протокового рака с очагами ослизнения и второй узел на большем протяжении имеет строение коллоидного рака. В 3 лимфоузлах обнаружены МТС рака. В щитовидной железе – узловой коллоидный зоб.
Исследование рецепторов стероидных гормонов от 07.08.2002: опухоль рецептор-отрицательная. Статус HER2/neu и Ki-67 – неизвестены.

В послеоперационном периоде проведено адъювантное лечение: с 12.08.2002 5 курсов химиотерапии по схеме FAC (фторурацил+доксорубицин+циклофос-фамид) в стандартных дозах с последующей дистанционной гамма-терапией (СОД=44 Гр). Находилась под динамическим наблюдением в течение 3,5 лет. 26.05.2006 – выявлены изолированные МТС в печени (два узла – в левой доле печени 5,6×3,2 см, в правой – 1,3 см). Проведенное лечение представлено в табл. 2.
С июня 2006 по август 2007 г. было проведено 11 курсов монотерапии доцетакселом 75 мг/м2 каждые 3 недели. Зарегистрирована незначительная положительная динамика в рамках стабилизации. При контрольном обследовании (позитронно-эмиссионная – ПЭТ и компьютерная – КТ-томография) от 01.10.2006 – прогрессирование (продолженный рост контрольного очага+6 новых МТС от 0,5 до 2,0 см). По этому поводу с октября 2007 по март 2008 г. проведено 6 курсов химиотерапии капецитабин+винорелбин (перорально). Зарегистрирована длительная стабилизация (16 месяцев без прогрессирования). В июле 2009 г. – вновь прогрессирование (МТС в печени), поражения лимфоузлов, костей и других висцеральных органов не выявлено. С июля 2009 г. начата 3-я линия химиотерапии (реиндукция) по схеме капецитабин+винорелбин, проведено 2 курса, затем до декабря 2009 г. – монотерапия винорелбином (в связи с токсичностью). Зарегистрирован полный регресс очагов в печени. Прогрессирование зарегистрировано в июле 2010 г. – в течение 5 месяцев проводилась метрономная терапия (4-я линия химиотерапии) эндоксан 50 мг/сут ежедневно внутрь+метотрексат 2,5 мг 2 раза в неделю внутрь. В декабре 2010 г. вновь выявлены МТС в печени, а с февраля 2011 г. 5-я линия лечения – 1 курс гемцитабин+карбоплатин, затем в связи с непереносимостью карбоплатина получала монотерапию гемцитабином 800 мг/м2 в 1-й, 8 и 15-й дни по май 2011 г. без прогрессирования.
На тот период наблюдения размеры очагов в печени варьировались от 0,6 до 3,2 см, в связи с чем 01.06.2011 произведена химиоэмболизация правой печеночной артерии – ХЭППА (таксотер 100 мг+липиодол 10 мл) без осложнений.
В течение 5 лет (2006–2011) пациентка получила 5 линий химиотерапии. В тот период в клинике появилась возможность рутинного определения статуса рецептора HER2, в связи с чем 07.06.2011 выполнена биопсия МТС в печени с целью определения НЕR2/neu-статуса опухоли.
При гистологическом и иммуно-гистохимическом исследованиях подтвержден МТС инвазивно-протокового РМЖ с экспрессией РЭ (рецепторы к эстрогену)=7 баллов, РП (рецепторы к прогестерону)=3 балла, средней пролиферативной активностью (Ki 67 – 22%); НЕR2 «2+», FISH (флуоресцентная гибридизация in situ) – отрицательная.
Уточненная диагностика подтвердила люминальный А тип опухоли. Дополнительно исследованы некоторые молекулярно-биологические маркеры (июль 2011 г.): опухоль отрицательна по EGFR (epidermal growth factor receptor), отрицательна по VEGF (vascular endothelial growth factor); положительна по VEGFR2 (Vascular Endothelial Growth Factor Receptor 2).
При плановом обследовании в июне 2011 г. – дальнейшее прогрессирование заболевания (продолженный рост МТС в печени). В связи с новыми данными о молекулярных маркерах менялся и подход к терапии данной больной (табл. 3).
Параллельно с лекарственным лечением в 2011–2012 гг. проведено три химиоэмболизации:
- 01.06.2011 – химиоэмболизация правой печеночной артерии (таксотер 100 мг+липиодол 10 мл);
- 27.06.2012 – химиоэмболизация правой и левой печеночных артерий (таксотер 100 мг+липиодол 10 мл);
- 09.10.2012 – химиоэмболизация правой и левой печеночных артерий (таксотер 100 мг+липиодол 10 мл).
При обследовании в августе 2013 г. (ультразвуковое исследование, магнитно-резонансная томография и ПЭТ) прогрессирование на фоне приема эверолимуса и фулвестранта, 2/3 паренхимы печени выполнены МТС от 0,4 до 3,1 см в диаметре, сливающиеся в конгломераты, увеличение количества МТС, рост уровня СА 15-3, повышение активности трансаминаз 1-й ст.
При анализе результатов лечения замечено несоответствие клинического течения и биологического подтипа опухоли (люминальный А). Проведенные 3 линии гормонотерапии в сочетании с цитостатиками и таргетными агентами не позволили достигнуть объективного ответа.
В связи с этим было проведено повторное FISH-исследование с использованием HER2-FISH pharmDx Kit (Dako) от 03.09.2013 и получены неожиданные результаты: в 85% клеток среднее количество сигналов в ядре, соответствующих гену c-erB-2 (HER2/neu), – 3,5. Среднее количество сигналов в ядре, соответствующих центромере 17-й хромосомы (СЕР 17), – 3,1. В 15% клеток: среднее количество сигналов в ядре, соответствующих гену c-erB-2 (HER2/neu), – 6,3. Среднее количество сигналов в ядре, соответствующих центромере 17-й хромосомы (СЕР 17), – 4,3. Соотношение сигналов HER2/neu:CEP 17=1,46. Таким образом, выявлен клон с увеличением копийности гена c-erB-2 (HER2/neu) >6 сигналов и увеличением копийности центромерного региона.

Заключение: выявлена внутриопухолевая гетерогенность с малым (15%) клоном с возможной сочетанной амплификацией c-erB-2 (HER2/neu) и центромерного региона 17-й хромосомы. Последние предложения Консенсуса по исследованию статуса HER2 не исключают клинического значения подобных минорных клонов.
В связи с полученными результатами (люминальный тип В с HER2+ в 15% опухоли) изменилась и тактика лечения больной (табл. 4). С сентября 2013 г. начата анти-HER2-терапия (10-я линия): трастузумаб+лапатиниб+эндоксан (внутрь по 50 мг в метрономном режиме)+капецитабин 500 мг ежедневно в метрономном режиме). В связи с плохой переносимостью пероральных капецитабина и эндоксана произведена замена на винорелбин, однако при плановом контроле в декабре 2013 г. – про-долженный рост МТС в печени (поражение 80% печени), признаки снижения функции печени 2-й ст.
К тому времени в России уже был зарегистрирован и применялся для лечения антрациклин-таксан-резистентного мРМЖ эрибулин. При подгрупповом анализе в исследовании EMBRACE (рис. 5) преимущества по ОВ были получены и для РЭ/РП+, и для HER2+, и у пациенток с висцеральными МТС [20]. Наша пациентка подходила под эти параметры, однако очевидная множественная лекарственная резистентность, объем метастатического поражения и наличие за плечами 10 линий лечения изначально не позволяли надеяться на успех.
С 19.12.2013 начата терапия эрибулином (Халавен®) в редуцированной дозе (в связи со сниженной функцией печени) 1,1 мг/м2 в 1-й и 8-й дни на фоне продолжения терапии трастузумабом 440 мг в 1-й день (каждый 21-й день). При обследовании через 6 месяцев от начала лечения (июнь 2014 г.) зарегистрирован частичный регресс (вместо сливного конгломерата насчитывалось 7 МТС размером 2,3–3,4 см).
Пациентка продолжает получать лечение эрибулином по настоящее время. За 16 месяцев проведено 17 курсов лечения. Начиная с 11-го курса лечение проводится с интервалом 28 дней в связи с нейтропенией. По этому поводу периодически получает КСФ (колониестимулирующие факторы). Из осложнений – полинейропатия 1-й ст. Уровень трансаминаз в пределах 1–2-й ст. Признаков портальной гипертензии на фоне фиброза печени не выявлено.
В процессе лечения эффект нара-стает: при обследовании в ноябре 2014 г. – очаги в печени уменьшились до 1,5–2,0 см с лечебным патоморфозом. По данным последнего обследования, после 16-го курса от марта 2015 г. в печени на фоне фиброза четко определяются 2 МТС размером 1,8 и 1,9 см. Сохраняется частичный регресс. Кроме того, зарегистрировано снижение уровня маркера СА 15-3 с 3168,7 (20.11.2013) до 82,0 ЕД/мл (11.01.2015).
Представленный клинический случай демонстрирует неоспоримый успех длительного (16 месяцев) эффективного (частичный регресс) лечения пациентки эрибулином в 11-й линии терапии мРМЖ с сохранением удовлетворительного качества жизни. И, несмотря на данные о приоритетном показании эрибулина для больных с трижды негативным подтипом опухоли, данный случай подтверждает его высокую эффективность, в т.ч. и в увеличении продолжительности жизни, для больной люминальным В типом опухоли молочной железы.
Заключение
В настоящее время путем чередующегося характера различных схем цитотоксической, гормональной и таргетной терапии, определяемой в соответствии с биологическим подтипом РМЖ, удается значительно продлить жизнь пациенток.
Больные мРМЖ, к сожалению, часто обречены на длительное противоопухолевое лечение с частой сменой лекарственных препаратов. Выбор цитостатиков при неэффективности антрациклинов и таксанов представляется весьма затруднительным. Однако сегодня в нашем арсенале мы имеем новый препарат – эрибулин (Халавен®), обладающий множеством неоспоримых достоинств, главными из которых является эффективность при антрациклин-таксан-резистентном мРМЖ, что позволяет существенно увеличить продолжительность жизни больных с сохранением ее качества.



