Остеопороз (ОП) – заболевание скелета, характеризующееся снижением прочности кости и повышением риска переломов. Остеопоротические переломы (ОПП) определяются как произошедшие спонтанно или при падении с высоты не выше роста человека, включая переломы, развившиеся при кашле, чихании или резком движении, а также в ситуации, когда у пациента на рентгенограмме выявлен компрессионный перелом позвонка независимо от того, есть болевой синдром или нет.
Последствиями переломов позвонков и ребер являются боль, нарушение экскурсии грудной клетки, эвакуации мокроты. Переломы ребер могут приводить к развитию пневмоторакса. Деформация грудной клетки и выраженный грудной кифоз способствуют нарушению эффективной вентиляции и прогрессированию дыхательной недостаточности. У больных снижается уровень физической активности. Переломы проксимального отдела бедра приводят к необходимости постороннего ухода, летальным исходам.
ОП подразделяют на первичный и вторичный, т. е. вызванный различными заболеваниями и приемом некоторых лекарственных препаратов. Обзор посвящен проблеме вторичного ОП в практике врача-пульмонолога. Это заболевание может быть обусловлено приемом глюкокортикостероидов (ГКС), прежде всего пероральных, а также развиваться вне зависимости от проводимой терапии как осложнение тяжелого течения заболевания. ОП как коморбидное заболевание рассматривается при хронической обструктивной болезни легких (ХОБЛ), бронхиальной астме (БА), муковисцидозе (МВ), саркоидозе, интерстициальных легочных заболеваниях, у больных, нуждающихся в трансплантации легких.
Хроническая обструктивная болезнь легких
Развитие ОП у больных ХОБЛ обусловлено пожилым возрастом, снижением физической активности, курением, низким индексом массы тела (ИМТ), терапией высокими дозами ингаляционных ГКС (ИГКС) и назначением коротких курсов пероральных ГКС при обострении заболевания. Известно, что табакокурение приводит к повышению риска развития ОПП любой локализации в 1,29, а переломов шейки бедра – в 1,8 раза. Даже для прекративших курить риск переломов остается выше, чем в популяции [1].
Помимо перечисленных факторов риска значительную роль в развитии ОП уделяют основному заболеванию – ХОБЛ. Хронический воспалительный легочный процесс может приводить к появлению провоспалительных цитокинов, например интерлейкина-6 (ИЛ-6), ИЛ-1β и фактора некроза опухоли-α, в системном кровотоке. Развивается системный воспалительный процесс, инициирующий и способствующий прогрессированию коморбидных заболеваний, в т. ч. ОП [2]. Воспалительные цитокины повышают активность остеокластов – клеток, резорбирующих костную ткань, что приводит к потере костной массы. Известным механизмом увеличения остеокластогенеза при системном воспалении является нарушение соотношения лиганда рецептора активатора нуклеарного фактора κВ (RANKL), найденного на поверхности предшественников остеокластов, и остеопротогерина [3].
Результатом системного воспалительного процесса также является атрофия скелетной мускулатуры и кахексия, рассматриваемая при ХОБЛ как предиктор летальности. Эти процессы приводят к прогрессированию дыхательной недостаточности и обусловливают необходимость вентиляционной поддержки. Снижается физическая активность, увеличивается риск падений, а значит, и развития переломов.
Частота ОП у больных ХОБЛ в 2–5 раз выше, чем у лиц того же возраста без обструкции дыхательных путей [4, 5]. Для мужчин с ХОБЛ риск ОП возрастает приблизительно в 4 раза [5]. По данным систематического обзора, включившего 13 исследований (775 больных ХОБЛ), частота ОП варьировалась от 9 до 69 % (в среднем 35,1 %), низкой костной массы (остеопении) – от 27 до 67 % (в среднем 38,4 %). В сравнительных исследованиях было продемонстрировано, что частота ОП и остеопении была выше, чем при других легочных заболеваниях, таких как БА, идиопатический легочный фиброз, первичная легочная гипертензия, но ниже, чем у больных МВ [6].
Наиболее частая локализация переломов у больных ХОБЛ – ребра и тела позвонков. Они возникают спонтанно или при незначительном воздействии, например кашле. Часты ситуации, когда переломы позвонков становятся случайной находкой при рентгенографическом исследовании органов грудной клетки. Риск переломов позвонков тесно связан с тяжестью ХОБЛ [7] и возрастает даже у больных, никогда не получавших пероральных ГКС. По данным некоторых исследований, частота переломов позвонков возрастала у женщин с ХОБЛ в 2 раза с увеличением тяжести заболевания со II до III стадии по GOLD [8]; переломы позвонков были выявлены у 50 % мужчин с ХОБЛ, не принимавших ГКС [9].
Основные показания к исследованию ОП на пациентах с ХОБЛ: тяжесть заболевания (III–IV ст.), низкий ИМТ (< 21 кг/м2), низкий индекс тощей массы (fat free mass index) [2, 6].
Муковисцидоз
Прогресс в диагностике и лечении МВ привел к значительному росту продолжительности жизни при этом заболевании. В 1938 г., в год описания болезни, 70 % заболевших погибали в течение первого года жизни. В настоящее время в большинстве стран мира продолжительность жизни достигла 30–40 лет, а число взрослых стало превышать таковое детей [10, 11]. С ее увеличением приобрели значимость другие проявления МВ, такие как ОП, заболевания печени, сахарный диабет, поражения суставов и репродуктивной системы.
Предполагается, что в развитии ОП у больных МВ участвует много факторов. Некоторые из них широко известны: дефицит витамина D, низкий ИМТ, снижение физической активности, использование ГКС, задержка пубертата и гипогонадизм, влияние сахарного диабета. В молодом возрасте не происходит достижения пика костной массы, что безусловно способствует низким показателям минеральной плотности кости (МПК) взрослых. Другие факторы более специфичны для МВ, и от их влияния, возможно, зависит прогноз профилактики и лечения ОП. К ним относится тяжесть легочной инфекции и системного воспалительного процесса. У больных МВ в период обострения легочной инфекции отмечено повышение числа потенциальных предшественников остеокластов в периферической крови, которое снижалось после курса антибактериальной терапии [12, 13]. Выявлена положительная корреляция между количеством, активностью остеокластов и уровнями фактора некроза опухоли-α и ИЛ-6 в сыворотке крови [13].
Выявление взаимосвязи между обострением инфекционного процесса и усилением костной резорбции имеет большое клиническое значение. Следует предположить, что проведение мероприятий по снижению риска инфекции и адекватная антибактериальная терапия обострений могут оказать положительное влияние на костный метаболизм. Эти данные также служат обоснованием использования антирезорбтивных препаратов лечения ОП у больных МВ.
Предполагается и возможное влияние мутации трансмембранного регулятора МВ (CFTR) на костный метаболизм [14]. В качестве возможных механизмов предполагалось прямое воздействие на функцию хлорных каналов или взаимодействие с другими ионными каналами в клетках, участвующих в костном метаболизме (кишечника, почек, паращитовидных желез и кости) [15]. Имеются данные об экспрессии CFTR в человеческих остеобластах, остеоцитах и остеокластах [16]. Предполагается, что утрата активности CFTR может приводить к увеличению костной резорбции через снижение уровня остеопротогерина и увеличение продукции простагландина Е2 [17]. Существуют и контраргументы в отношении генетической взаимосвязи. Это, в частности, результаты исследований, демонстрирующих нормальную МПК у пациентов с хорошим статусом питания и неизмененной легочной функцией, прежде всего в детском возрасте, а также снижение МПК и появление переломов по мере прогрессирования МВ. Многие исследования не смогли установить корреляцию МПК с мутацией гена CFTR [18–21].
Снижение МПК у больных МВ было впервые описано в 1979 г. По данным фонда по борьбе с МВ США из приблизительно 25 тыс. пациентов, зарегистрированных в 2010 г., около 11 % в целом по группе имели низкую МПК, достигнув 40 % у больных старше 30 лет [10, 11].
По данным мета-анализа [22], распространенность рентгенологически подтвержденных переломов позвонков составила при МВ 14,0 %, периферических переломов – 19,7 %. Переломы позвонков чаще наблюдаются в грудном отделе [23, 24]. Оценка частоты переломов позвонков и периферических переломов у тяжелых больных МВ, нуждающихся в трансплантации легких, показала ее увеличение почти в 2 раза у женщин 16–34 и у мужчин 25–45 лет по сравнению с популяционными данными. Патологический угол грудного кифоза вследствие деформаций позвонков был определен более чем у 60 % пациентов с МВ. Степень его выраженности превышала обычно наблюдаемую у людей на три десятилетия старше (в возрасте > 60 лет) [18].
The Cystic Fibrosis Foundation Bone Health Consensus Committee рекомендует исследование МПК методом двуэнергетической рентгеновской абсорбиометрии (ДРА) у детей старше 8 лет при наличии таких факторов риска, как низкий ИМТ (< 90 % от идеального), активность легочного заболевания (ОФВ1 < 50 % должной), прием системных ГКС в суточной дозе ≥ 5 мг более 3 месяцев, нарушение пубертата, наличие переломов. В возрасте старше 18 лет DРA следует назначать всем пациентам вследствие высокого риска переломов.
В методических рекомендациях The North American CF Bone Health Consensus предлагается поддерживать концентрацию 25(ОН)D выше 30 нг/мл [25]. Официальное сообщение Тhe UK Cystic Fibrosis Trust Bone MineralisationWorking Group [26] рекомендует обсудить терапию бисфосфонатами взрослых больных МВ с низкотравматичными переломами; при низких значениях МПК (Z-критерии в поясничном отделе позвоночника, шейке бедра или общем показателе по бедру ≤ -2,0 стандартных отклонений [SD]) или при значительной потере костной массы (> 4 % в год), при повторном измерении МПК методом ДРА, несмотря на выполнение основных мер по улучшению состояния костной ткани; у больных, начинающих длительную (более 3 месяцев) терапию системными ГКС при МПК по Z-критерию ≤ -1,5 SD; ожидающих трансплантацию легких или после нее при МПК по Z-критерию ≤ -1,5 СО. Женщины, планирующие беременность, должны быть информированы о риске при назначении бисфосфонатов для будущего ребенка.
Саркоидоз
ОП, развивающийся на фоне терапии саркоидоза пероральными ГКС, следует отличать от саркоидоза костей. Частота саркоидоза костей варьируется в различных странах от 1 до 39 %. Наиболее часто встречается бессимптомный кистозный остеоид в малых костях рук и ног. Литические поражения редки, локализуются в позвонках, длинных трубчатых костях, тазовой кости и лопатке и обычно сопровождаются висцеральными поражениями.
В диагностике информативны рентгенография, компьютерная и магнитно-резонансная томография, радиоизотопное сканирование, однако только биопсия кости позволяет уверенно говорить о наличии гранулематоза [27].
Для саркоидоза характерно нарушение метаболизма кальция, связанное с витамином D. С одной стороны, у большинства больных наблюдается низкое содержание неактивной формы витамина D – 25(ОН)D3 – в сыворотке крови [28], с другой – неконтролируемая выработка активированными альвеолярными макрофагами и клетками гранулемы α1-гидроксилазы (в норме вырабатывается в почках) приводит к повышению уровня кальцитриола (1,25 (ОН)2D3) – активного метаболита витамина D. В результате повышения уровня 1,25(ОН)2D3 5 % больных страдают гиперкальциемией (обычно бессимптомной), 40–62 % – гиперкальциурией. Нераспознанные постоянные гиперкальциемия и гиперкальциурия могут приводить к развитию нефрокальциноза, нефролитиаза (10 % больных) и почечной недостаточности [29].
Описанные нарушения метаболизма кальция влияют на тактику лечения ОП у больных саркоидозом. В рекомендациях по ОП, в т. ч. глюкокортикоидному, неотъемлемым компонентом любой схемы лечения является назначение препаратов кальция и нативного витамина D. Однако при саркоидозе, по мнению многих экспертов, несмотря на недостаток 25(ОН)D3, большинству больных назначение этих препаратов не рекомендуется. Прием витамина D может приводить к увеличению превращения 25(ОН)D3 в 1,25(ОН)2D3 и развитию гиперкальциемии. В тех случаях, когда врач все же назначает препараты кальция и витамина D, рекомендован тщательный мониторинг кальция в сыворотке крови и суточной моче. Кальцитриол в лечении ОП не используется. Основой терапии ОП является назначение бисфосфонатов (например, алендроната) [29, 30].
Бронхиальная астма
В настоящее время ИГКС практически полностью вытеснили пероральные формы в лечении больных БА. Они являются наиболее эффективными противовоспалительными средствами для лечения персистирующей БА. По безопасности ИГКС значительно превосходят системные ГКС. По данным проспективных исследований длительностью 3 года EUROSCOP (будесонид 800 мкг/сут) [31] и TORCH (флутиказона пропионат 1000 мкг/сут) [32], не выявлено влияния ИГКС на МПК и частоту переломов. В 2001 г. в Кокрановской электронной библиотеке опубликован систематический обзор, составленный на основании 7 рандомизированных клинических исследований. Следует отметить, что только в двух работах исследовались больные БА, в остальных участвовали больные ХОБЛ легкого течения и здоровые добровольцы. Оценивалось влияние на МПК беклометазона дипропионата и будесонида в дозах до 2200 мкг/сут, флутиказона пропионата – до 1100 мкг/сут. Было показано, что применение ИГКС в течение 2–3 лет не вызывает изменений МПК и не влияет на частоту переломов. В заключении авторы указали на необходимость длительных проспективных исследований для оценки эффекта средних и высоких доз ИГКС [33].
Данные о негативных эффектах ИГКС получены в одномоментных исследованиях и исследованиях «случай–контроль», доказательность данных которых значительно ниже, чем проспективных рандомизированных клинических исследований. Была продемонстрирована взаимосвязь суточной дозы ИГКС со снижением МПК и риском развития переломов. По данным мета-анализа и систематического обзора (5 исследований «случай–контроль», 43 783 и 259 936 пациентов соответственно), риск непозвоночных переломов у пожилых пациентов возрастает на 12 % при каждом увеличении дозы ингаляционного бекламетазона дипропионата на 1000 мг/сут или эквивалентной дозы другого ИГКС. Тем не менее отмечается, что значимость ИГКС значительно ниже, чем других факторов риска переломов у пожилых людей [34].
По мнению экспертов по глюкокортикоидному остеопорозу многих стран (в т. ч. России [35]), при лечении высокими дозами ИГКС происходит снижение МПК и умеренное увеличение риска переломов, однако пока не ясно, связано ли это с применением ИГКС, или обусловлено тяжелым течением хронических бронхообструктивных заболеваний (БА, ХОБЛ), требующих назначения высоких доз ИГКС.
Согласно GINA (2011), применение взрослыми больными ИГКС в дозе, не превышающей эквивалентную 400 мкг будесонида, не сопровождается системными эффектами. Больные БА, получающие высокие дозы ИГКС или пероральные ГКС, относятся к группе риска ОП и переломов, однако не доказано, что такой риск присутствует у пациентов, получающих низкие дозы ИГКС. Измерение МПК следует рекомендовать женщинам в постменопаузе, получающим > 2 мг/сут ингаляционного беклометазона дипропионата или эквивалентную дозу другого ИГКС; всем пациентам, которые часто получают короткие курсы терапии высокими дозами пероральных ГКС [36].
Интерстициальные легочные заболевания
Проблема ОП для таких больных связана прежде всего с приемом системных (пероральных и парентеральных) ГКС. По данным массы исследований, постоянный прием ГКС уже в течение 3 месяцев может приводить к повышению риска переломов. В настоящее время принято делить суточные дозы (в преднизолоновом эквиваленте) пероральных ГКС на малые (< 2,5 мг/сут), средние (2,5–7,5 мг/сут) и высокие (≥ 7,5 мг). Крупное британское ретроспективное когортное исследование доказало взаимосвязь между суточной дозой пероральных ГКС и риском переломов [37]. Относительный риск переломов позвонков по сравнению с контролем при дозе ≥ 2,5 мг/сут составил 1,55, при дозе 2,5–7,5 мг/сут – 2,59, а при дозе ≥ 7,5 мг/сут – 5,18, для перелома проксимального отдела бедра – 0,99; 1,77; 2,27 соответственно [38]. Для пациентов, принимающих ГКС по 20 мг/сут, риск периферических переломов возрастает в 3 раза по сравнению с больными, получающими ГКС в дозах ≤ 5 мг/сут [37]. Таким образом, увеличение риска переломов наблюдается уже с начала применения низких суточных доз, а с увеличением суточной дозы риск возрастает.
В соответствии с ныне существующими рекомендациями [39] противоостеопоротические препараты назначаются одновременно с началом терапии ГКС, если лечение планируется на срок ≥ 3 месяца и применяются высокие (≥ 7,5 мг/сут) дозы пероральных ГКС.
Трансплантация легких
Трансплантация легких в настоящее время – метод, способствующий продлению жизни пациентов с различными тяжелыми заболеваниями легких и улучшающий ее качество. При принятии решения о внесении пациентов в лист ожидания трансплантации легких учитывается не только тяжесть основного заболевания, но и определенный перечень абсолютных и относительных противопоказаний. Одним из относительных противопоказаний является тяжелый ОП [40, 41].
Заболевания, при которых проводится пересадка легких (прежде всего ХОБЛ, МВ, легочный фиброз), часто сопровождаются развитием ОП. По некоторым данным, его частота достигает 60 % [42]. К основным факторам риска относят длительный прием ГКС, табакокурение, ограничение физической активности, низкий питательный статус, гипогонадизм, низкий уровень 25(ОН)D3, гипоксию и гиперкапнию, системный воспалительный процесс.
В течение года после трансплантации легких даже у больных с исходно нормальной костной массой темпы снижения МПК достигают 2–5 % [43], а переломы развиваются у 18–37 % пациентов [44]. Увеличение риска переломов после трансплантации легких связано не только с приемом иммуносупрессантов, но и с большей активностью больных. В связи с этим в протоколы ведения пациентов после трансплантации легких введены препараты лечения ОП группы бисфосфонатов.
Диагностика остеопороза
Основные исследования при остеопорозе:
- клинический осмотр (в т. ч. измерение роста);
- оценка факторов риска и определение абсолютного риска переломов у мужчин старше 50 лет и женщин в постменопаузе в течение ближайших 10 лет с помощью калькулятора FRAX®;
- ДРА поясничного отдела позвоночника и проксимального отдела бедра: является основным методом измерения МПК и при возможности должна проводиться всем больным, которым планируется или уже проводится длительная терапия пероральными ГКС;
- рентгенография позвоночника в боковой проекции для выявления деформаций позвонков: основными показаниями к исследованию являются кифоз, снижение роста > 2 см за год или > 4 см по сравнению с молодым возрастом, боли в спине, низкая МПК;
- лабораторное исследование (в т. ч. общий анализ крови, уровни креатинина, кальция, фосфора, щелочной фосфатазы, альбумина, 25(ОН)D3
- в сыворотке крови, исследование кальция с суточной моче) проводится для дифференциальной диагностики с другими причинами вторичного ОП.
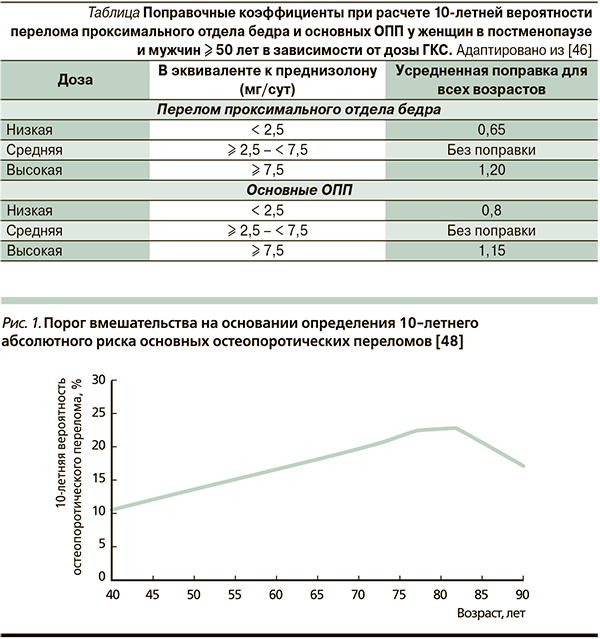
Компьютеризированный алгоритм FRAX® позволяет подсчитать две цифры, показывающие 10-летнюю вероятность основных ОПП (клинически манифестного перелома позвонка, переломов дистального отдела предплечья, проксимального отдела бедра или плечевой кости) и отдельно перелома проксимального отдела бедра. Существует российская модель FRAX® (http://www.shef.ac.uk/FRAX/tool.jsp?country=13). Десятилетний абсолютный риск переломов определяют на основе возраста, пола, ИМТ и клинических факторов риска (предшествующий ОПП, перелом проксимального отдела бедра у родителей, курение в настоящее время, прием пероральных ГКС сейчас или ранее, ревматоидный артрит, заболевания, которые могут приводить к вторичному ОП [в т. ч. ХОБЛ], прием алкоголя ≥ 3 единиц в день). FRAX® можно подсчитывать как без учета данных денситометрии (например, в отсутствие доступа к денситометрическому оборудованию), так и с введением в соответствующую графу показтеля МПК шейки бедра (г/см2 или Т-критерий).
Одно из ограничений FRAX® заключается в использовании пероральных ГКС как дихотомического фактора риска (да/нет) и при этом не учитывается ни суточная доза, ни длительность приема (за исключением того, что прием ГКС – 3 месяца – вообще не регистрируется). При более длительном применении ГКС FRAX® подсчитывает риск для средней их дозы (от 2,5 мг до 7,5 мг/сут) [45]. Однако следует учитывать, что дозы выше средней (≥ 7,5 мг/сут) ассоциированы с более высоким риском переломов и, наоборот, суточные дозы ниже средней (< 2,5 мг) – с меньшим риском. Определены поправочные коэффициенты, которые могут быть использованы при расчете 10-летней вероятности ОПП в зависимости от суточной дозы ГКС (см. таблицу) [46]. При этом для суточной дозы ≥ 2,5 < 7,5 мг абсолютный риск переломов соответствует рассчитанному по FRAX®.
В настоящее время диагноз ОП женщинам в постменопаузе и мужчинам 50 лет и старше устанавливается [48]:
- клинически на основании перенесенного перелома при минимальной травме или спонтанного перелома (за исключением переломов костей пальцев или черепа, нехарактерных для ОП) при исключении других причин;
- при выявлении низких показателей МПК методом ДРА (Т-критерий ≤ -2,5 SD, а у больных, принимающих пероральные ГКС ≥ 3 месяцев, при Т критерии ≤ -1,5 SD).
Решение о начале лечения ОП может быть принято на основании подсчета абсолютного риска развития переломов в ближайшие 10 лет методом FRAX®. Тактика врача определяется на основании графика (рис. 1), на котором приведен рекомендованный порог вмешательства в зависимости от возраста пациента и 10-летнего абсолютного риска основных ООП. Если пересечение этих двух параметров пришлось на красную зону графика, пациенту показано лечение противоостеопоротическими препаратами, если в зеленую зону – лечение можно не проводить и оценку риска перелома следует повторить через год [47].
Женщинам детородного возраста (в пременопаузе) и мужчинам моложе 50 лет диагноз ОП устанавливается только на основании низкоэнергетического перелома в анамнезе. МПК оценивается по Z-критерию, при этом заключение о снижении костной массы по сравнению с возрастной нормой может быть сделано на основании Z-критерия -2,0 SD и ниже [44]. При выявлении низкой МПК, не сопровождающейся низкоэнергетическими переломами, решение о назначении лечения ОП принимается только при учете всех факторов риска и на основе тщательного рассмотрения всей клинической ситуации.
Профилактика и лечение глюкокортикоидного остеопороза
Существует ряд общих рекомендаций по ведению пациентов, получающих ГКС. Доза пероральных ГКС должна регулярно пересматриваться, следует назначать минимальные эффективные дозы и при возможности снижать их вплоть до полной отмены. Адекватное количество кальция (1200–1500 мг/сут) по возможности следует получать из продуктов питания, при необходимости дополняя недостающее количество приемом лекарственных препаратов. Доза витамина D для большинства пациентов составляет 800–1000 МЕ/сут. Препараты витамина D и кальция должны быть обязательным компонентом любой схемы лечения ОП, однако они не могут быть использованы в качестве монотерапии. Имеются ограничения назначения этих препаратов при саркоидозе. Рекомендуются рациональное питание с достаточным содержанием белка, поддержание нормального веса тела, регулярные физические упражнения в соответствии с общим состоянием, прекращение табакокурения и ограничение употребления алкоголя. Необходимо оценить риск падений и принять меры по его уменьшению [39].
К противоостеопоротическим препаратам первого выбора относятся бисфосфонаты (алендронат, ризедронат, золедроновая кислота), препаратам второго выбора – альфакальцидол (ограничения при саркоидозе). При отмене ГКС возможно прекращение лечения [39].
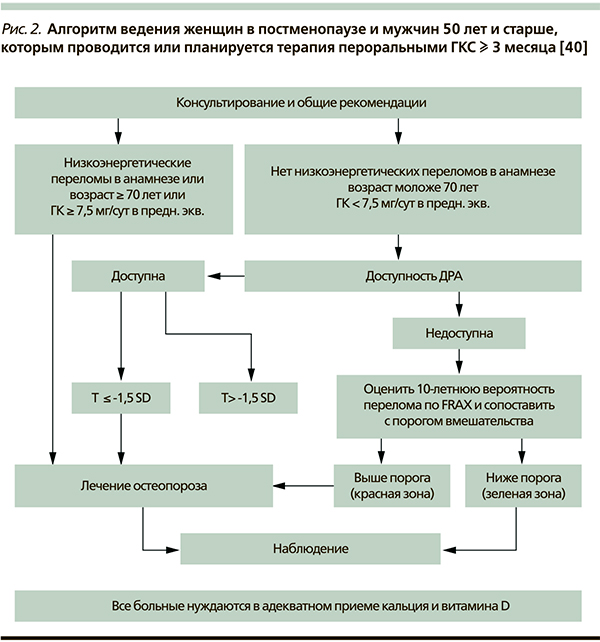
Алгоритм обследования и лечения женщин в постменопаузе и мужчин 50 лет и старше, которым проводится или планируется длительная (≥ 3 месяца) терапия ГКС, приведен на рис. 2 [39]. Лечение противоостеопоротическими препаратами следует назначать пациентам с низкоэнергетическими переломами в анамнезе. В этих случаях диагноз ОП выставляется клинически, показатели денситометрии в норме или более -1,5 SD по Т-критерию не влияют на постановку диагноза и принятие решения о назначении лечения. Показанием к назначению противоостеопоротических препаратов является возраст пациента ≥ 70 лет, поскольку большинство больных этой возрастной категории при приеме пероральных ГКС имеют порог вмешательства по FRAX® в “красной зоне”. В лечении нуждаются также пациенты в возрасте от 50 до 70 лет, получающие высокие дозы ГКС (≥ 7,5 мг/сут).
В остальных случаях следует проводить ДРА. При показателях МПК по Т-критерию ≤ -1,5 SD ставят диагноз ОП и назначают лечение. Рекомендации касаются как женщин, так и мужчин.
В отсутствие вышеперечисленных критериев назначения терапии, а также при недоступности остеоденситометрии женщинам в постменопаузе и мужчинам 50 лет и старше проводится расчет 10-летней вероятности переломов по FRAX® с учетом поправочного коэффициента.
Если пересечение параметров возраста и 10-летнего абсолютного риска основных ОПП пришлось на “красную зону”, диагностируется вероятный ОП и назначается лечение. Остальные пациенты нуждаются в наблюдении.
Показанием к назначению лечения женщин в пременопаузе и мужчин моложе 50 лет, которым проводится или планируется длительная (≥ 3 месяца) терапия ГКС, является наличие низкоэнергетических переломов в анамнезе. В отношении остальных пациентов решение о назначении лечения должно приниматься индивидуально, доказательной базы необходимости назначения терапии в этих случаях пока нет [39].
Наблюдение за пациентами, принимающими пероральные ГКС, включает ежегодное измерение МПК при доступности ДРА, ежегодное измерение роста для контроля его снижения, проведение рентгенографии или ДРА позвоночника в боковой проекции при подозрении на переломы позвонков, оценку при-верженности к терапии пациентов, получающих противоостеопоротическое лечение, кальций и витамин D.
Заключение
ОП является междисциплинарной проблемой. Данные многочисленных исследований демонстрируют высокую частоту ОП и переломов у больных хроническими бронхолегочными заболеваниями. Вторичный ОП следует рассматривать как многофакторное заболевание, в генезе которого необходимо учитывать роль основного заболевания, его тяжесть, проводимую терапию.



