Введение
Ионы магния жизненно необходимы для функционирования нервной, сердечно-сосудистой, мочевыделительной и других систем организма. Для компенсации повсеместно распространенной пищевой недостаточности магния используются различные неорганические и органические его соединения, значительно различающиеся по фармакокинетике и в фармакодинамике. Перспективно использование препаратов на основе органических солей магния, характеризующихся более высокой биоусвояемостью по сравнению с неорганическими солями [1].
Каждый препарат на основе той или иной органической соли магния имеет ряд особенностей при клиническом применении. Например, оротат магния (ОМ) в отличие от неорганических оксида или сульфата магния не оказывает слабительного действия и не понижает кислотность желудка. Показана эффективность ОМ при состояниях, сопровождающихся дефицитом магния, в т. ч. у больных, подвергшихся коронарной хирургии [2–4]. Клиническая практика показывает, что ОМ оказывает антиаритмическое и сосудорасширяющее действия, благоприятно влияет на клиническое течение инфаркта миокарда и сердечной недостаточности [5]. Во многом эти эффекты обусловлены самим ионом магния (Mg2+), биодоступность которого значительно повышена за счет использования органического лиганда для его связывания. Возникает резонный вопрос – каков вклад собственно лиганда (оротат-аниона) в молекулярно-фармакологические свойства ОМ?
Оротовая кислота (ОК) образуется в организме в качестве промежуточного продукта при синтезе пиримидиновых нуклеотидов (оротидинфосфата, уридинтрифосфата, цитидинтрифосфата) [6]. Среди продуктов питания наибольшее количества ОК содержат козье и коровье молоко, морковь и свекла. ОК и ее производные являются нутриентами для микробиоты [7]. Например, геномы молочнокислых бактерий Lactobacillus содержат гены, кодирующие специальные белки для транспорта и биотрансформаций ОК [8]. В научной литературе ОК известна под многими синонимами (orotic acid, orodin, orotonin, oroturic, orotyl, orotate, vitamin b13, 6-uracilcarboxylic acid, lactinium, whey factor и др.) и по своей химической структуре является гетероциклическим соединением – 2,6-диоксипиримидин-4-карбоновой кислотой (рис. 1).
В настоящей работе проводится анализ фармакологических «возможностей» химической структуры ОК на основе хемоинформационного подхода – сравнения химической структуры молекулы оротата (молекулярной структуры с недостаточно изученными молекулярно-фармакологическими свойствами) с десятками тысяч других молекул (для которых молекулярно-фармакологические свойства известны). Данное сравнение было проведено с использованием современных методов прикладной математики и интеллектуального анализа данных [9–16], разработанных в рамках алгебраического подхода к распознаванию научной школы акад. РАН Ю.И. Журавлева и чл.-корр. РАН К.В. Рудакова [10–14].
Методы
Хемоинформатика – область исследований на стыке структурной химии, фармакологии и биоинформатики, в которой взаимосвязи типа «химическая структура–свойство вещества» исследуются методами современной информатики. В настоящей работе для проведения хемоинформационного анализа (ХИА) был разработан новый математический метод, основанный на комбинаторной теории разрешимости [9–12]. Имеющиеся в публичном доступе системы для поиска структур, схожих с заданной молекулой (PubChem, ChemSpider и др.), не позволяют получать интересные результаты с практической точки зрения.
Комбинаторная теория разрешимости, представляющая собой развитие алгебраического подхода к задачам распознавания, является современным инструментом для исследования признаковых описаний объектов. В случае задачи установления молекул, химическая структура которых схожа с заданной, объектами исследования являются хемографы. Хемограф (χ-граф) – особая разновидность графа (т. е. математического объекта, являющегося совокупностью множества вершин и множества ребер – связей между вершинами). Хемографом называется конечный связный неориентированный размеченный граф без петель с кликовым числом, не превышающим 3.
В рамках комбинаторной теории разрешимости χ-графы рассматриваются как объекты, а их инварианты (или кортежи инвариантов) – как признаковые описания объектов. В применении к хемографам практически важны теорема о полноте кортежей инвариантов произвольного хемографа и теорема соответствия критерия полноты инварианта критерию разрешимости/регулярности, основной результат которых можно записать в следующей форме: (1), где Pr – множество прецедентов графов (полученный из заданного набора молекулярных структур); iso(G) – метка, указывающая на принадлежность графа G к некоторому классу изоморфных графов (очевидна из описаний молекулы в базе данных химических структур); χ – множество элементарных χ-инвариантов (фрагментов химической структуры); – кортеж-инвариант (список фрагментов структур, применимый к структуре любой молекулы). Если условие (1) выполнено для заданного множества χ, то χ обеспечивает разрешимость задачи над Pr и позволяет систематически исследовать все фрагменты углеродных скелетов органических молекул. Если множество Pr регулярно, т. е. не содержит двух идентичных хемографов (молекул), то множество χ устанавливается на основе стандартного подхода к вычислению характеристической функции множества информативных значений признаков T(α) [11] для множества χ, так что T(α), α определяется на основе выбора элемента кортеж-инварианта (т. е. типа фрагмента углеродного скелета) с наибольшим рангом информативности α: (2).
Данная процедура способствует находить такой кортеж-инвариант, который бы позволял отличать каждый хемограф (молекулу) в Pr от всех остальных. Тестирование (1, 2) проведено на случайных выборках 50 тыс. попарно различных структур молекул из базы данных PubChem [17] с использованием бинарных кортеж-инвариантов над множеством χ-цепей (цепных фрагментов химической структуры) длины n (n = 1… 7). В результате вычислений было установлено, что при n = 7 аккуратность отличения одной молекулы от другой составила 99,4 % и даже при более коротких длинах χ-цепей (n = 4, 5) достигались довольно высокие показатели аккуратности (93… 97 %).
С использованием полученного множества χ и метрики Хэмминга функция расстояния между хемографами dχ над бинарными χ-инвариантами определяется следующим образом: (3).
Данное выражение, отражающее «химическое расстояние» между двумя произвольными молекулами, и было использовано для решения задачи поиска молекул, структурно схожих с ОК.
Результаты
С использованием описанного выше метода анализа хемографов был проведен анализ схожести химической структуры молекулы ОК (оротат-аниона) с молекулами в базе данных метаболома человека и в базах данных лекарственных средств. Как известно, метаболомом называется совокупность всех низкомолекулярных веществ (т. е. с низкими молекулярными массами – не более 1000 дальтон), найденных в клетках и тканях организма. Установление схожести молекулярной структуры действующего начала препарата с элементами метаболома принципиально важно для установления всех эффектов воздействия препарата на организм [18].
 В качестве модели метаболома человека использовалось более 40 тыс. соединений, приведенных в базе данных HMDB (Human Metabolome Database) [19]. В их число входит большинство соединений, измеряемых в плазме крови человека, включая экзогенные вещества (в частности, лекарственные препараты).
В качестве модели метаболома человека использовалось более 40 тыс. соединений, приведенных в базе данных HMDB (Human Metabolome Database) [19]. В их число входит большинство соединений, измеряемых в плазме крови человека, включая экзогенные вещества (в частности, лекарственные препараты).
В соответствии с упомянутым в разделе «Методы» подходом к анализу множеств хемографов были рассчитаны расстояния dχ от структуры молекулы оротата до структур всех молекул в модели метаболома. Гистограмма полученных расстояний (рис. 2) показывает, что структуры большинства молекул метаболома находились на большом расстоянии (dχ более 0,8) от молекулы оротата и только 200... 300 молекул находились на сколько-нибудь приемлемом расстоянии (dχ = 0,7 и менее).
В результате использования порога dχ < 0,8 был получен список из 632 молекул, наиболее близких к оротату по химической структуре. Для каждой из этих молекул из баз данных HMDB и PubChem были извлечены текстовые описания, проведен анализ средних химических расстояний и частоты встречаемости различных ключевых слов в этих текстовых описаниях (рис. 3). Полученные результаты позволяют сделать несколько интересных выводов.
Во-первых, в описаниях молекул наиболее часто встречались термины, относящиеся к особенностям химической структуры молекул: кольцо (молекула оротата содержит кольцевой фрагмент), ароматический (кольцо в оротате – ароматическая система), подобная пирролу и бензойной кислоте. Среди таких терминов наименьшими значениями среднего химического расстояния характеризовались пурин (0,65 ± 0,18) и пиримидин (0,68 ± 0,21), что наглядно иллюстрирует адекватность используемого метода для анализа текстовых описаний схожих с оротатом молекул.
Во-вторых, среди схожих с оротат-анионом молекул отмечено значительное число компонентов растительных экстрактов. Оротат схож с многими алкалоидами коры, кожуры, корней, фруктов цитрусовых и других растений. Например, антиоксидант метил-2-аминобензойная кислота (dχ = 0,68) содержится в эфирных маслах бергамота, апельсиновой цедры, цедры лимона, жасмина, черного чая и рисовых отрубей. Оротат схож с рядом алкалоидов руты (гидрокси-3-метокси-10-митилакридон и др.).
В народной медицине экстракты руты (Ruta graveolens) используются как средства, снижающие ревматические и невралгические боли. На достаточно близком расстоянии (dχ = 0,58) находились антиоксиданты авентрамиды А, В, С, D экстракта зерен овса (Avena Sativa). р-Аминобензойная кислота (dχ = 0,68) является важным нутриентом для бактерий (витамин Вх), а ее калиевая соль используется в терапии фиброзных заболеваний кожи [20]. Многие из растительных экстрактов характеризуются противовоспалительными свойствами, например салицилаты (dχ = 0,70...0,75), полифенолы типа циннамовой, кофеиновой кислот (dχ = 0,7… 0,8) и апигенин (dχ = 0,63). Заметим, что полифенол апигенин входит в состав прополиса, сельдерея, петрушки, аптечной ромашки, обладает отчетливыми противораковыми свойствами.
В-третьих, можно отметить термины, относящиеся к катионам макро- и микроэлементов: кальций, калий, железо, магний. Присутствие этих терминов в описаниях, схожих с оротатом молекул, обусловлено частичным сходством оротата с органическими анионами в составе органических солей железа (фумарат), кальция (фумарат, сорбат, бензоат, метилфолинат), калия (фумарат, аминобензоат) и магния (фумарат, салицилат). Таким образом, оротат-анион обладает существенным сходством с анионами других органических кислот, которые используются как лиганды для переноса эссенциальных микроэлементов.
В-четвертых, наименьшими значениями dχ характеризовались термины, относящиеся к метаболизму производных кофеина, теофиллина и мочевой кислоты (МК). Последнее неудивительно, т. к. оротат наряду с МК является одним из важных метаболитов пуринового и пиримидинового метаболизма. Эти сходства будут более подробно рассмотрены ниже.
Анализ текстовых описаний, схожих с ОК молекул, позволил выделить несколько десятков соединений, характеризующихся известной фармакологической активностью. К их числу, в частности, относятся урацил, кинуреновая кислота, тимин, фторурацил, 5-гидроксиметилурацил, 2-индолкарбоновая кислота, пиррол-2-карбоновая кислота, темурин, оксипуринол, эноксимон и т. д. Наиболее интересные результаты анализа сходства молекулы ОК с фармакологически активными веществами представлены ниже и связаны с противовоспалительным действием, иммуномодуляцией, нейропротекторными и кардиопротекторными эффектами.
Противовоспалительное действие: противодействие МК
 ОК является одним из промежуточных продуктов пиримидинового метаболизма. Поэтому неудивительно, что структура оротат-аниона схожа со структурами различных производных МК (dχ = 0,40...0,50): 1-метил-МК (один из трех основных метаболитов теофиллина [21]), 1,3-диметил-МК (продукт метаболизма теофиллина [21, 22]), 1,7-диметил-МК (основной метаболит кофеина в моче, образуется при посредстве цитохрома CYP2A6 [23]), 5-ацетиламино-6-амино-3-метилурацилом (один из основных метаболитов кофеина) и т. д.
ОК является одним из промежуточных продуктов пиримидинового метаболизма. Поэтому неудивительно, что структура оротат-аниона схожа со структурами различных производных МК (dχ = 0,40...0,50): 1-метил-МК (один из трех основных метаболитов теофиллина [21]), 1,3-диметил-МК (продукт метаболизма теофиллина [21, 22]), 1,7-диметил-МК (основной метаболит кофеина в моче, образуется при посредстве цитохрома CYP2A6 [23]), 5-ацетиламино-6-амино-3-метилурацилом (один из основных метаболитов кофеина) и т. д.
МК – один из основных продуктов азотистого обмена и является продуктом окисления в метаболизме пуриновых оснований, получающимся с помощью фермента ксантиноксидазы. Фермент уриказа производит дальнейшее окисление МК в аллантоин. Потеря активности уриказы имеет схожую симптоматику с дефицитом аскорбиновой кислоты. В то же время избыток МК в организме ассоциирован с сахарным диабетом и формированием камней в почках [24]. Сходство структур МК и ОК позволяет предполагать, что ОК может тормозить эффекты МК (в частности, ингибировать образование уратных камней в почках и снижать воспаление).
Многие из производных МК обладают ценными фармакологическими свойствами. Например, темурин (dχ = 0,50) проявляет противовоспалительный и обезболивающий эффекты, а 5-гидроксиметил-4-метилурацил (dχ = 0,60) используется в комбинации с токсичными антибиотиками для уменьшения их токсичности, стимулирует лейкоцитопоэз и иммунитет.
Противовоспалительное действие: сходство с НПВС
ХИА показал сходство структуры молекулы ОК с таковыми ряда нестероидных противовоспалительных средств (НПВС), такими как мефенамовая кислота (dχ = 0,64), меклофенамовая кислота (dχ = 0,67), 3-аминосалициловая кислота, антипирин, салициламид, индометацин, толметин и нифлумовая кислота (dχ = 0,73… 0,75).
Отмечено также сходство с парацетамолом (dχ = 0,65), который обладает слабыми противовоспалительными свойствами и оказывает жаропонижающий эффект через модуляцию синтеза простагландинов.
Как известно, НВПС зачастую оказывают не только противовоспалительный, но и обезболивающий, а также жаропонижающий эффекты, что обусловлено воздействием на простагландиновый метаболизм за счет ингибирования циклооксигеназы-2 (ЦОГ-2). Основываясь на сходстве молекулярной структуры оротата с НПВС, можно предположить, что оротат способен взаимодействовать с ЦОГ, несколько замедляя синтез провоспалительных простагландинов.
В эксперименте прием ОК снижал уровни ω-6 полиненасыщенных жирных кислот, из которых синтезируются провоспалительные эйкозаноиды [25]. В целом исследование эффектов ОК на воспаление является перспективным направлением исследований.
Иммуномодуляция
Ряд схожих с оротатом молекул обладает иммуномодулирующим воздействием. Например, фторурацил (dχ = 0,47) – аналог пиримидина, противоопухолевое средство, препятствует синтезу ДНК, блокируя метаболизм тимидиловой кислоты. Тимин (dχ = 0,50) – одно из четырех оснований, образующих последовательность ДНК, которое также характеризуется противовирусным действием (например, по отношению к вирусу гриппа) [26]. Соединение 5-гидроксиметилурацил (dχ = 0,50) – иммуномодулятор клеточного и гуморального ответа, используется для лечения язвенной болезни желудка и при эрозивном поражении кишечника [27, 28], а 5-гидроксиметил-4-метилурацил стимулирует лейкоцитопоэз (dχ = 0,60).
Иммуномодулирующим действием обладают и упомянутые ранее антиоксиданты растительных экстрактов – темурин, авенантрамиды, муконин, пиперолактамы. Темурин (dχ = 0,52) – пуриновый алкалоид плодового дерева Theobroma grandiflorum и камелии, характеризуется противовоспалительным и обезболивающим эффектами [29]. Кроме того, он представляет собой один из метаболитов МК, структурно схожий с кофеином. Полифенол овса авенантрамид L (dχ = 0,52) характеризуется антиоксидантным потенциалом и противовоспалительной активностью [30]. Алкалоид муконин (dχ = 0,61) из ствола и коры дерева карри, широко используемого в восточной кулинарии, имеет антипролиферативную активность [31].
Отдельно отметим умеренное сходство ОК с молекулами хинолоновых антибиотиков (перфлоксацин, норфлоксацин, ципрофлоксацин, энрофлоксацин, розоксацин; dχ = 0,71… 0,72) и антипаразитарных препаратов (мебендазол, никлозамид, дилоксанид; dχ = 0,69… 0,70). Отмечено также заметное сходство ОК со структурой пиррол-2-карбоновой кислоты (dχ = 0,50), специфическим ингибитором ферментов типа пролинрацемазы, снижающим активность одноклеточного паразита Trypanosoma cruzi за счет торможения его дифференциации внутри клеток хозяина [32].
Нейропротекторные эффекты
Наблюдается сходство структуры молекулы оротата с рядом нейропротекторных метаболитов, прежде всего с кинуреновой кислотой (dχ = 0,45) – эндогенным антагонистом глутаматных ионотропных (NMDA) рецепторов, обладающим нейропротекторным и противосудорожным действиями. Увеличение содержания кинуреновой кислоты в ЦНС происходит непосредственно перед рождением, а после рождения происходит резкий спад ее уровня. Этот весьма интересный феномен может способствовать усилению нейропротекции ЦНС плода во время родов. Кинуреновая кислота играет роль в синаптической пластичности, а ухудшение когнитивных функций при различных нейродегенеративных расстройствах сопровождается нарушениями ее метаболизма [33, 34].
Ранее уже было отмечено, что ОК характеризуется заметной схожестью с метаболитами кофеина (производными МК), в меньшей степени – с самим кофеином (dχ = 0,74). Кофеин – пуриновый растительный алкалоид, который является антагонистом аденозиновых рецепторов классов A1 и A2A. Аденозин – эндогенный нейромодулятор с ингибирующим действием, поэтому антагонизм аденозиновых рецепторов при взаимодействии с кофеином, как правило, приводит к стимулирующим эффектам. Кофеин, как и другие метилксантины, характеризуется противовоспалительным действием [35].
Определенные черты молекулы оротата присущи серотонину (dχ = 0,79) – нейромодулятору, который регулирует состояние сна/бодрствования и настроение. Дефицит серотонинергической активности вызывает такие расстройства, как депрессия, фобии, обсессивно-компульсивные нарушения [36]. Оротат имеет сходство с метаболитом серотонина формил-5-гидроксикинуренамином (dχ = 0,64), поэтому возможные воздействия ОК на серотониновый метаболизм нельзя полностью исключать.
Кардиопротекторные эффекты
Кардиопротекторные эффекты оротата магния наблюдаются в клинической практике уже более 20 лет. Традиционно они связывались только с компенсацией дефицита магния у пациентов с острым инфарктом миокарда, пролапсом митрального клапана, алкогольной миокардиодистрофией, тахиаритмией и др. Результаты настоящего хемоинформационного анализа указывают на самостоятельный кардиопротекторный эффект и самого лиганда магния – оротат-аниона.
Прежде чем рассмотреть структурное сходство молекулы ОК с веществами, имеющими кардиопротекторный эффект, упомянем кардиопротекторные свойства образующихся из ОК пиримидиновых нуклеотидов. Прием ОК или ее солей увеличивает концентрацию уридинмонофосфата, уридиндифосфата (УДФ) и уридинтрифосфата. Эти три уридинфосфата могут опосредовать положительное воздействие оротата на сердечно-сосудистую систему. Они обладают значительным кардиопротективным действием, в особенности в раннем периоде острой ишемии [37]. Наиболее вероятно, что физиологическое действие уридинфосфатов осуществляется через пуринергические рецепторы, вовлеченные в вазореактивные реакции, апоптоз и секрецию цитокинов. Подобно адренергическим и аденозиновым рецепторам, пуринергические рецепторы активируют G-белки, а через них – внутриклеточные магний-зависимые аденилатциклазы [38, 39].
Результаты проведенного хемоинформационного анализа указывают на многие другие молекулярные механизмы, посредством которых молекула оротата может стимулировать кардиопротекцию. К их числу относятся прежде всего регуляция фермента N-ацетилглюкозаминтрансферазы (N-АГТ), ингибирование фосфодиэстераз (ФДЭ) и регуляция эффектов витаминоподобного вещества кофермент PQQ.
Регуляция N-АГТ. ОК характеризуется высокой степенью сходства с урацилом (dχ = 0,44) – пиримидиновым основанием в РНК, образующимся при трансляции любого гена из тимина в последовательности ДНК. Помимо участия в формировании генетического кода урацил и его производные служат аллостерическими регуляторами и коферментами для ряда биохимических реакций. Как сходство ОК с уридином, так и образующийся из ОК УДФ могут существенно влиять на процессы аллостерической регуляции активности ферментов.
В частности, УДФ-глюкоза регулирует превращение глюкозы и галактозы в печени и других тканях. Урацил является регулирующим компонентом метаболизма β-аланина, биосинтеза пантотената и кофермента А. Регулируемый УДФ фермент N-АГТ (ген OGT) [40] катализирует перенос N-ацетилглюкозамина от УДФ-глюкозамина к сериновым/треониновым остаткам цитоплазматических и внутриядерных белков, включая гистоны H2B, сигнальный фермент AKT1, гликолитический фермент фосфофруктокиназу печени (PFKL) и др.
Важно отметить, что N-АГТ способствует резистентности к инсулину в мышцах и адипоцитах, гликозилируя компоненты сигнального каскада инсулина, и тормозит процесс гликолиза, снижая активность фермента 6-фосфофруктокиназы (ген PFKL). Митохондриальная изоформа N-АГТ является цитотоксичной и запускает апоптоз в нескольких типах клеток. Фермент ингибируется УДФ [40] и, возможно, непосредственно ОК. Торможение активности N-АГТ будет таким образом способствовать активации углеводного метаболизма и снижению апоптоза кардиомио-цитов.
Ингибирование ФДЭ. ХИА показал существенное сходство между ОК и рядом ингибиторов ФДЭ – эноксимоном, амриноном, теофиллином, милриноном. Как известно, ФДЭ участвуют в регуляции внутриклеточной передачи сигнала от рецепторов различных типов (адренергических, метаботропных ацетилхолиновых и глутаматных, дофаминовых, аденозиновых, гистаминовых, глюкагоновых и др.) [41]. Фермент 3',5'-ФДЭ расщепляет цАМФ, тем самым ослабляя передачу сигналов от соответствующих рецепторов. И наоборот, ингибирование ФДЭ улучшает передачу сигнала по сигнальным каскадам.
Эноксимон (dχ = 0,56) – селективный ингибитор ФДЭ. Характеризуется сосудорасширяющим действием и положительной инотропной активностью, которая не изменяет потребление кислорода миокардом. Используется пациентами с хронической сердечной недостаточностью [42].
Амринон (dχ = 0,71) – ингибитор пиридина ФДЭ, используется для лечения хронической сердечной недостаточности, увеличивает сократимость сердца за счет повышения поступления ионов кальция в кардиомиоциты.
Теофиллин (dχ = 0,73) – метилксантиновый препарат, используемый в терапии респираторных заболеваний (хроническая обструктивная болезнь легких, бронхиальная астма). Встречается в черном и зеленом чае, является мочегонным средством, гладкомышечным релаксантом, бронходилататором, стимулирует сердечно-сосудистую и центральную нервную системы. Теофиллин также ингибирует 3’,5’-ФДЭ.
Милринон (dχ = 0,75) обладает положительным инотропным кардиотоническим действием и сосудорасширяющим эффектом, ингибирует ФДЭ цАМФ в миокарде и гладкой мускулатуре сосудов. Является производным амринона и имеет в 20–30 раз более высокую ионотропную активность.
Следует подчеркнуть, что передача сигнала от рецепторов через цАМФ-зависимые каскады осуществляется при посредстве магний-зависимых аденилатциклаз. С этой точки зрения ингибиторы ФДЭ, предотвращающие инактивацию внутриклеточных сигнальных молекул цАМФ и цГМФ, являются фармакодинамическими синергистами магния.
Пирролохинолин хинон (кофермент PQQ). Данное витаминоподобное вещество заслуживает особого рассмотрения, т. к. по химической структуре достаточно схоже с ОК (dχ = 0,62) и проявляет антиоксидантный, митохондриальный, нейро- и кардиопротекторный эффекты. Кофермент PQQ и связывающие PQQ ферменты (хинобелки) играют важную роль в окислительно-восстановительном метаболизме, поддержке структурной целостности клеток и тканей [43]. К числу хинобелков относятся аминоадипатполуальдегид-дегидрогеназа (присоединяет жирные кислоты к коферменту А), флавинредуктаза (восстанавливает коферменты, превращает биливердин в билирубин), дофамин-β-гидроксилаза (трансформирует дофамин в норадреналин), инозитол-зависимая киназа IRE1 (инициирует апоптоз) [44]. Приведенные ниже результаты новых биохимических исследований позволяют предполагать, что эффекты кофермента PQQ не ограничиваются взаимодействием с этими четырьмя ферментами.
Было показано, что PQQ защищает митохондрии от окислительного стресса и способствует митохондриальному биогенезу в стареющих клетках [45], подобно воздействию на эти клетки интенсивных аэробных упражнений [46] и/или диеты со строгим ограничением калорийности [47]. Эти эффекты осуществляются PQQ двумя основными механизмами [45]: активацией экспрессии гена PCG-1α и активацией сигнального белка CREB. Активация экспрессии гена PCG-1α стимулирует в свою очередь экспрессию генов, участвующих в митохондриальном и клеточном дыхании, делении клеток, нормализации артериального давления и уровня холестерина [48]. Стимуляция белка CREB способствует росту новых митохондрий и важна для процессов эмбриогенеза [49].
В эксперименте были показаны нейропротекторные свойства PQQ: восстановление когнитивных нарушений, вызванных хроническим окислительным стрессом [50], влияние на синтез/секрецию факторов роста нервов [51], защита нейронов от окислительного повреждения после ишемии/реперфузии [22]. Прием PQQ непосредственно перед моделированием инсульта значительно уменьшал размер очага ишемического повреждения [52]. PQQ также модулирует активность NMDA-глутаматных рецепторов [53], снижая эксайтотоксичность избытка глутамата при ишемических повреждениях.
Нейропротекторные эффекты PQQ, по всей видимости, способствуют наблюдаемому в экспериментальных [54] и клинических исследованиях [55] его действию на когнитивную функцию. В рандомизированном исследовании прием кофермента PQQ по 20 мг/сут приводил к улучшению показателей когнитивных тестов в группе лиц среднего и пожилого возраста, причем установленный эффект превзошел эффект плацебо более чем в 2 раза [55].
Экспериментальные исследования свидетельствуют и о кардиопротекторном действии кофермента PQQ: уменьшении зоны повреждения в моделях инфаркта миокарда при введении как до, так и после ишемического события [56]. Сравнение эффектов PQQ со стандартным β-адреноблокатором метопрололом показало, что эти вещества снижали размер инфаркта посредством различных механизмов. PQQ также увеличивал продукцию АТФ митохондриями и снижал степень перекисного окисления липидов [57], защищая кардиомиоциты от острого окислительного стресса [58].
Другие механизмы. ХИА обнаружил и на другие возможные механизмы кардиопротекторного действия ОК. Например, схожая с ОК 2-индолкарбоновая кислота (dχ = 0,50), один из полифенольных компонентов женьшеня и других растительных экстрактов, является сильным ингибитором перекисного окисления липидов [59]. Схожий с оротатом оксипуринол (dχ = 0,55) является ингибитором ксантиноксидазы и используется для лечения хронической сердечной недостаточности [60]. Теобромин (dχ = 0,73) проявляет сосудорасширяющий и кардиостимулирующий эффекты [61].
Можно также отметить умеренное структурное сходство ОК с антикоагулянтами, схожа с варфарином. Производные кумариновой кислоты (dχ = 0,79) встречаются во многих растениях (кассия, корица, донник, лаванда, зеленый чай, мята, сельдерей, черника). Это позволяет предполагать, что оротат-анион вносит определенный вклад в антикоагуляционные эффекты ОМ.
Результаты клинических исследований ОМ подтверждают приводимые выше выводы. Например, исследование пациентов с тяжелой сердечной недостаточностью, получавших лечение ОМ, показало, что их однолетняя выживаемость составила 76 % по сравнению с 52 % в группе плацебо. Использование ОМ увеличивает толерантность больных ишемической болезнью сердца к физическим нагрузкам. Прием препарата Магнерот пожилыми пациентами с ИБС улучшал параметры качества их жизни и психоэмоционального статуса [62–66].
Заключение
Изучение тонких молекулярных механизмов воздействия ОМ на сердечно-сосудистую и другие системы организма представляет значительный интерес, принимая во внимание имеющиеся экспериментальные и клинические данные. Долгое время клинические эффекты, наблюдаемые при использовании органических солей магния, приписывались исключительно магнию, а роль органических анионов ограничивалась лишь повышением биодоступности магния при пероральном приеме препаратов. Независимые позитивные эффекты анионов на физиологию человека, как правило, не рассматривались, и оротат-анион оставался одним из наименее исследованных анионов, участвующих в транспорте магния внутрь клеток.
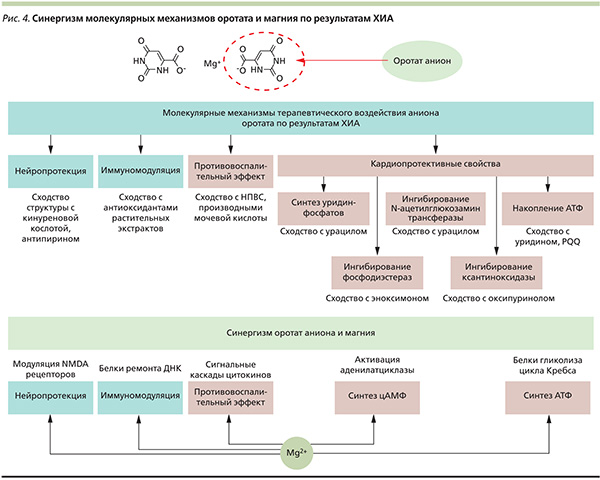
Проведенный в рамках настоящей работы ХИА (т. е. анализ схожести химических структур молекул) позволил систематически рассматривать возможные молекулярные механизмы терапевтического воздействия ОК, являющейся эндогенным веществом, элементом метаболома человека. Установленные сходства оротата с некоторыми молекулами метаболома человека и различными лекарственными веществами позволяют предполагать фармакологическую предопределенность иммуномодулирующего противовоспалительного нейро- и кардиопротекторного вектора действия ОК (рис. 4).
Кардиопротекторные свойства ОК могут реализовываться, в частности, за счет образования кардиопротективных УДФ, воздействия на аденозиновые рецепторы, регуляции N-АГТ, ингибирования ФДЭ, регуляции эффектов кофермента PQQ, ингибирования ксантиноксидазы и антиоксидантного эффекта. Полученные результаты указывают на перспективные направления дальнейших экспериментальных и клинических исследований ОК.
Работа выполнена при поддержке Российского Фонда фундаментальных исследований.



