В настоящее время ни у кого не вызывает сомнений [1], что главной задачей при лечении
пациента с артериальной гипертензией (АГ) является достижение целевого уровня артериального давления(АД). Именно снижение АД приводит к уменьшению частоты сердечно-сосудистых заболеваний и смертности. В исследовании HOT (Hypertension Optimal Treatment) [11] впервые был
определен т. н. целевой уровень АД, т. е. такие цифры АД, при которых риск сердечно-сосудистых осложнений, например инфаркта миокарда, инсульта и сердечной недостаточности, сведен к минимуму.
Комбинированная антигипертензивная терапия позволяет сразу воздействовать на большее количество самых различных звеньев патогенеза АГ (активацию ренин-ангиотензинальдостероновой и симпатоадреналовой систем, нарушение функции эндотелия и почек, гипертрофию миокарда и сосудистой стенки). Таким образом, именно комбинированная антигипертензивная терапия в наибольшей степени решает проблему многофакторности АГ. Клиническим следствием этого является более высокая эффективность лечения (на 20–30 % по сравнению с монотерапией).
В настоящее время большинству врачей хорошо известны оптимальные комбинации антигипертензивных препаратов: ингибиторы ангиотензинпревращающего фермента (ИАПФ)/антагонисты рецепторов ангиотензина II (АРАII) и диуретики, блокаторы кальциевых каналов (БКК) и ИАПФ/АРАII, β-адреноблокаторы (β-АБ) и БКК.
Европейское общество по артериальной гипертензии [8] дало четкие рекомендации по дифференцированному применению комбинированной терапии (см. таблицу).
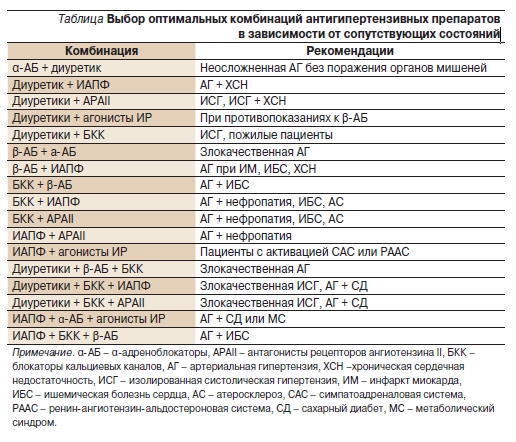
В российских рекомендациях Всероссийского научного общества кардиологов по диагностике и лечению АГ комбинация β-АБ и дигидропиридинового БКК также рассматривается как рациональная терапия, рекомендуемая при ИБС, атеросклерозе сонных и коронарных артерий, тахиаритмии, изолированной систолической АГ и пожилым пациентам.
В настоящее время на отечественном фармацевтическом рынке присутствует более 50 различных фиксированных комбинаций антигипертензивных препаратов, что, с одной стороны, дает практическому врачу большую воз-можность фармакотерапевтического маневра, с другой – требует дифференцированного и патогенетически обоснованного выбора конкретной комбинации.
Одним из ключевых звеньев патогенеза АГ как в ее оригинальной мозаичной теории [13], так и в ее современной модификации [17] признается нарушение гемодинамики и повышение частоты сердечных сокращений (ЧСС). Более того, если рассматривать повышение АД при АГ как результат несоответствия величины сердечного выброса (произведение ЧСС и ударного объема) и сосудистого сопротивления, то становится очевидным, что оптимальный гемодинамический путь снижения АД
лежит через нормализацию этих показателей. С этой позиции становится очевидным, что большинство имеющихся фиксированных комбинаций уменьшают либо вазоконстрикцию (ИАПФ/АРА + БКК), либо вазоконстрикцию и гиперволемию (ИАПФ/АРА + диуретики), в то время как комбинация β-АБ + БКК уменьшает кардиальный гиперкинетический синдром и вазоконстрикцию, α-, β-АБ +
диуретики – гиперкинетический синдром и гиперволемию. Таким образом, комбинации с использованием β-АБ позволяют решать проблемы (в т. ч. и гиперактивацию САС), которые не могут решать другие комбинации, и обладают синергизмом в гемодинамических эффектах (рис. 1).

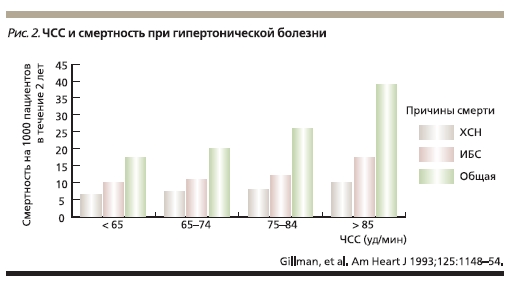
В настоящее время очевидно, что величина ЧСС при АГ имеет важное прогностическое значение (рис. 2). Так же как и хорошо известные риски при АГ, высокая ЧСС в покое – менее известный, но значимый фактор риска развития сердечно-сосудистых заболеваний и смерти от любой причины [18]. Во многих долгосрочных проспективных исследованиях было отмечено, что при наличии высокой
ЧСС возрастают риски смерти от любой причины, развития сердечно-сосудистого заболевания и внезапной смерти пациентов с подтвержденной или предполагаемой ИБС, пациентов, перенесших ИМ и пациентов с АГ. Причем у пациентов с АГ в целом ЧСС в покое выше, чем у похожих по характеристикам нормотензивных пациентов. И наоборот, низкая ЧСС в покое ассоциируется с меньшим риском развития ИБС и внезапной смерти. Данные Фремингемского исследования (Framingham Heart Study) с периодом наблюдения 36 лет показали, что пациенты с АГ и высокой ЧСС в покое подвергаются намного большему риску развития сердечно-сосудистых заболеваний, ИБС и смерти от любой причины, чем пациенты с меньшими значениями ЧСС [18]. Кроме того, кластеризация (группировка) факторов риска развития ИБС у людей с высокой ЧСС в покое свидетельствует, что
симпатическая гиперактивность также вносит вклад в повышение сердечно-сосудистой смертности, наблюдаемое среди лиц с тахикардией [14].
В Швеции было проведено исследование Goteborg Primary Prevention по первичной профилактике с участием 7455 пациентов с разными значениями ЧСС в покое. Этих пациентов наблюдали в среднем 11,8 года. Случаи смерти классифицировали как смерть от любой причины, ИБС, рака, инсульта и от других причин. Следует отметить, что уровни смерти от любой причины и от сердечно-сосудистого
заболевания прямо коррелировали с увеличением ЧСС в покое или когда частота пульса возрастала выше 84 уд/мин [18]. В исследовании Syst-Eur пожилых пациентов с систолической АГ было показано, что у пациентов с ЧСС в покое > 79 уд/мин риск смерти был на 89 % выше, чем у пациентов с ЧСС ≤ 79 уд/мин. Тенденции были схожими у лиц обоего пола, поскольку уровень смертности был относительно стабильным вплоть до третьего квинтиля ЧСС; затем увеличивался до четвертого квинтиля и демонстрировал дальнейший значимый прирост с четвертого квинтиля до пятого. Вполне
обоснованно считать, что “тахикардия может рассматриваться как маркер гиперсимпатикотонии” [14].
При этом доказано, что профилактический прием β-АБ уменьшает риск повторного ИМ, внезапной смерти и смерти от любой причины; эти эффекты коррелируют со снижением ЧСС,
что дает убедительные основания использовать препараты, снижающие ЧСС.
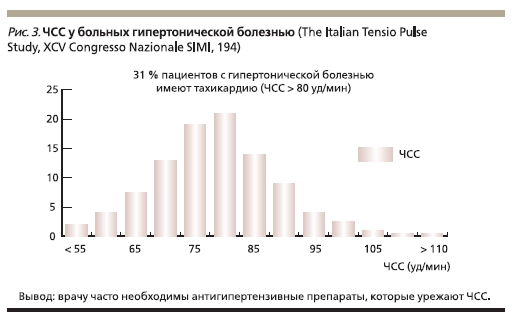
Логичен такой вопрос: насколько часто среди пациентов с АГ встречаются потенциальные кандидаты на терапию комбинацией β-АБ и БКК? По-видимому, приблизительно 30 % пациентов с АГ в режиме моно- или комбинированной терапии требуются БКК (рис. 3). По данным Tecumseh study, треть пациентов с АГ имеет “гиперкинетический” тип кровообращения (тахикардия и повышение сердечного выброса), который сочетается с повышением уровня норадреналина плазмы.
Помимо всего механизм антигипертензивного действия β-АБ обусловлен самыми различными причинами:
• уменьшением сердечного выброса в результате ослабления сократительной способности миокарда левого желудочка и урежения ЧСС;
• торможением секреции ренина;
• перестройкой барорефлекторных механизмов дуги аорты и каротидного синуса;
• увеличением высвобождения вазодилатирующих веществ (простагландинов Е2 и I2, оксида азота,
предсердного натрийуретического фактора и др.);
• уменьшением общего периферического сосудистого сопротивления;
• влиянием на сосудодвигательные центры продолговатого мозга.
То есть этот класс препаратов располагает возможностью оказывать положительное влияние на РААС наряду со способностью подавлять активность САС.
При применении β-АБ в качестве антигипертензивных средств необходимо помнить, что их эффект достигает максимума к концу 3-й недели. На 1-й неделе на терапию β-АБ отвечают около 30 % больных, на второй – 65 %, поэтому судить об эффективности антигипертензивной терапии β-АБ
следует лишь к концу 2–3-й недели. Необходимо подчеркнуть, что комбинация β-АБ и БКК имеет хорошую доказательную базу применения при АГ в виде исследования HOT, в котором она была использована. При этом более 30 % пациентов в этом исследовании достигли целевого АД именно на
ней. Кроме этого была показана перспективность применения ацетилсалициловой кислоты на ее фоне. Такое сочетание препаратов обеспечивает уменьшение тахикардии, активации САС (β-АБ) и уменьшение вазоконстрикции (БКК). В недавно завершившемся исследовании ACCORD для достижения целевого АД в группе интенсивной терапии β-АБ назначили 54 % пациентов, а в группе стандартной терапии – 33 %.
Комбинация бисопролола и амлодипина представляется на сегодняшний день наиболее современной и безопасной среди других комбинаций β-АБ и БКК в силу особенностей препаратов, ее составляющих.
В настоящее время амлодипин – представитель БКК из подгруппы дигидропиридинов, прочно занял
одну из лидирующих позиций среди массы антигипертензивных препаратов. Это обусловлено не только клинико-фармакологическими особенностями препарата, но и имею-щейся в настоящее время его доказательной базой применения при АГ. В механизме действия дигидропиридиновых БКК основной является способность вызывать дилатацию периферических артерий. В отличие от недигидропиридиновых БКК — верапамила и дилтиазема — дигидропиридиновые БКК в незначительной степени влияют на сократимость миокарда и вообще не влияют на функцию синусового узла и атриовентрикулярную проводимость. Эти их свойства в значительной степени определяют особенности клинического применения.
Амлодипин обладает весьма длительным периодом полувыведения
(35–45 часов), что гарантирует поддержание постоянного уровня его концентрации в крови. По той же причине на фоне приема амлодипина гораздо реже возникают побочные эффекты, типич-
ные для короткодействующих БКК [3]. К несомненным достоинствам амлодипина можно отнести наличие у него антиангинального эффекта, подтвержденного результатами исследования CAPE больных стабильной стенокардией напряжения.
Наиболее важными с позиций доказательной медицины исследованиями по применению амлодипина при АГ стали:
• TOMHS, в котором сравнивалась эффективность различных классов антигипертензивных препаратов в отношении больных мягкой АГ. При одинаковой эффективности с β-АБ, диуретиками, ИАПФ и α-АБ амлодипин обеспечивал наилучшую приверженность пациентов лечению;
• ALLHAT, убедительно продемонстрировавшее эффективность и безопасность применения амлодипина
для пациентов с АГ при сравнении с диуретиком и ИАПФ;
• VALUE, в которое были включены 15 245 больных АГ старше 50 лет, имевших повышенный риск
сердечно-сосудистых осложнений, продемонстрировало, что гипотензивный эффект амлодипина более
выражен, особенно в первые месяцы лечения, по сравнению с валзартаном;
• ASCOT-BPLA, в котором сравнивалось влияние двух терапевтических тактик на частоту развития
сердечно-сосудистых осложнений у 19 257 пациентов с АГ и тремя и более факторами риска сердечно-
сосудистых заболеваний [5]. Было доказано, что терапия, основанная на амлодипине, привела к достовер-ному снижению частоты фатальных и нефатальных инсультов, общих сердечно-сосудистых исходов или процедур реваскуляризации, общей смертности и частоты развития новых случаев СД и почечной недостаточности.
Еще одним несомненным достоинством амлодипина является тот факт, что он убедительно доказал наличие у него антиатеросклеротического эффекта. Этот факт основательно подтвержден результатами PREVENT и CAMELOT. Помимо всех вышеперечисленных исследований важное место в понимании роли амлодипина в лечении пациентов с сердечно-сосудистой патологией занимает исследование PRAISE, в котором препарат добавляли к стандартной терапии сердечной недостаточности у больных с выраженными нарушениями сократительной функции левого желудочка (фракцией выброса менее 30 %) и при этом не выявили негативного влияния на жесткие конечные точки. Естественно, это не означает, что амлодипин рекомендуется пациентам с ХСН, но это
дает возможность и не драматизировать возможные негативные последствия его применения этой категорией пациентов [17].
Важно отметить, что сочетание амлодипина и аторвастатина наиболее оптимально для реализации синергетического взаимодействия. В одном из исследований было показано, что именно комбинация амлодипина и аторвастатина в наибольшей степени обеспечивает не только достижение целевого уровня липидов, но и АД [8]. Объяснением этого факта служит благоприятное влияние комбинации амлодипин + аторвастатин на уровень интерлейкина-6, фактора некроза опухоли α и на чувствительность к инсулину (инсулинорезистентность). Таким образом, комбинация амлодипин + аторвастатин не только обладает более выраженным антигипертензивным эффектом, но и значительно сильнее уменьшает проявления инсулинорезистености и воспаления. Многие авторы считают, что возможно взаимодействие между амлодипином и статинами на молекулярном уровне,
которое приводит к стабилизации атеросклеротической бляшки и обусловливает более выраженное снижение риска коронарных событий [8].
На протяжении ряда лет не утихают споры о целесообразности применения β-АБ при ряде сердечно-сосудистых заболеваний, в т. ч. при АГ. Во-первых, критичные по отношению к β-АБ мета-анализы фактически касаются “старых” β-АБ, прежде всего атенолола [3, 5, 7]. Никакой компрометации более современных представителей этого класса (бисопролола, карведилола, небивилола) не было. Во-вторых, по ряду ключевых для антигипертензивного препарата характеристик (кардиоселективность, длительность действия, метаболическая нейтральность и т. д.) бисопролол занимает лидирующие позиции. В-третьих, он обладает одной из наиболее мощных доказательных баз целесообразности своего применения пациентами с сопутствующей сердечной недостаточностью различных функциональных классов (исследования CIBIS). Следовательно, бисопролол радикально отличается от атенолола и других “старых” β-АБ, которые поставили под сомнение целесообразность их применения лицами с АГ и высоким риском сердечно-сосудистых осложнений.
Бисопролол является одним из самых высокоселективных β-АБ. Так, его селективность к β1-адренорецепторам более чем втрое превосходит таковую у метопролола. Длительный период полувыведения бисопролола делает возможным его однократный прием (необходимо отметить, что по своим фармакокинетическим характеристикам он близок к амлодипину, что делает их сочетание в комбинации особенно рациональным). Благодаря высокой кардиоселективности бисопролол практически не оказывает отрицательного влияния на гладкую мускулатуру бронхов, периферических артерий, углеводный и липидный обмены [1]. Двойной путь выведения бисопролола позволяет назначать его пациентам с нарушениями почечной или печеночной функций. Важно отметить, что биспролол в бóльшей степени (на 23 %), чем метопролол, предотвращает повышение АД при физической нагрузке (исследование BISOMET) [10]. Бисопролол столь же эффективно уменьшает гипертрофию левого желудочка при АГ, как и ИАПФ эналаприл [9]. Важно отметить, что в исследовании BIMS (Bisoprolol International Multicenter Study) при сравнении антигипертензивной эффективности среди курящих больных АГ бисопролол и атенолол оказались эффективными в
отншении этой группы пациентов в 80 и 52 % случаев соответственно [4].
Наиболее важными с позиций доказательной медицины исследованиями по применению бисопролола стали:
• CIBIS (Cardiac Insufficiency Bisoprolol Study) – при анализе групп больных ХСН ишемического генеза и в группе пациентов с застойной кардиомиопатией в подгруппах приема бисопролола общая смертность была более чем в 2 раза ниже по сравнению с подгруппой плацебо [2];
• CIBIS II продемонстрировало, что стартовая монотерапия бисопрололом с последующим переводом на комбинированную терапию с эналаприлом по сравнению с традиционным обратным назначением
препаратов (старт – с монотерапии эналаприлом с последующим присоединением бисопролола) обладает аналогичной эффективностью и безопасностью [6];
• MIRSA-исследование показало, что бисопролол уменьшает суммарную ишемическую нагрузку и улучшает прогноз пациентов с ИБС [7].
• TIBBS продемонстрировало, что у больных стабильной стенокардией бисопролол уменьшает число эпизодов ишемии миокарда, общую продолжительность ишемии миокарда и достоверно снижает число ишемических атак в утренние часы. При этом те пациенты, у которых в результате лечения полностью устранялась транзиторная ишемия миокарда, имели более низкий риск смерти по сравнению с больными, у которых сохранялись ишемические эпизоды.
Бисопролол также продемонстрировал высокую эффективность при лечении желудочковых и наджелудочковых экстрасистол, при постоянной форме мерцательной аритмии [15]. Таким образом, имеется достаточно патогенетических и клинико-фармакологических предпосылок к использованию синергизма амлодипина и бисопролола в комбинации, и она недавно появилась в России под названием Конкор АМ. Весьма интересен уже имеющийся опыт ее применения. В недавно проведенном исследовании собирали данные из реальной практики по эффективности и безопасности бисопролола и амлодипина в комбинированной терапии при АГ 2-й степени [16]. Это исследование было открытым, проспективным с участием 801 взрослого пациента из 169 медицинских центров с впервые диагностированной АГ 2-й степени. Пациенты получали фиксированную комбинацию амлодипина 5 мг и бисопролола 5 мг по 1 таблетке 1 раз в сутки. Пациентов считали ответившими на лечение, если у них достигалось целевое АД < 140/90 мм рт. ст. в конце 4-недельного периода лечения. Исследователи оценивали общую эффективность по четырем показателям (отличная, хорошая, удовлетво-рительная или плохая) на основании общего снижения АД и улучшения состояния пациента. Кроме того, регистрировали нежелательные явления, оценивали общую переносимость по тем же значениям и определяли приверженность пациентов лечению. Через 4 недели терапии систолическое АД (САД) снизилось на 21,8 %: со 171,9 ± 17,9 до 134,3 ± 10,1 мм рт. ст. К концу 4-й недели приема Конкора АМ целевое САД/ДАД < 140/90 мм рт. ст. было достигнуто 82,5 % пациентов. Через 4 недели лечения среднее ДАД снизилось на 19,7 %: со 103,9 ± 9,6 до 83,4 ± 6,2 мм рт. ст. Среднее ДАД < 90 мм рт. ст.
было достигнуто в течение 2 недель лечения. К концу 4-й недели приема Конкора АМ целевое САД/ДАД < 140/90 мм рт. ст. было достигнуто 82,5 % пациентов. За 4 недели средняя ЧСС снизилась на 10,4 %: с 83,3 уд/мин на исходном этапе до 74,6. Исследователи расценили эффективность препарата
как отличную или хорошую для 91,4 % пациентов. Наиболее часто отмечавшимся побочным эффектом был отек голеней, возникший у 8 % пациентов (для сравнения: в исследованиях VALUE и CAMELOT он был у 32,3 % пациентов). Другие нежелательные явления включали головную боль (4 %), утомляемость (3 %), судороги ног (3 %) и сухость слизистой оболочки рта (1 %). Все отмеченные нежелатель-
ные явления были легкими и не требовали госпитализации или отмены лечения. Необходимо сделать акцент на следующем: достигнутый гипотензивный эффект был одним из наиболее выраженных при опосредованном сравнении с другими комбинациями.
Интересно, что в российском исследовании ЭТНА с произвольной комбинацией БКК и β-АБ достижение
целевого АД также было отмечено у 9 из 10 пациентов с АГ, при этом частота отеков также была существенно ниже.
Конкор АМ имеет различные сочетания препаратов (бисопролол 5 мг + амлодипин 5 мг, бисопролол 5 мг + амлодипин 10 мг, бисопролол 10 мг + амлодипин 5 мг, бисопролол 10 мг + амлодипин 10 мг), что обеспечивает большую гибкость дозирования и дифференцированное применение в зависимости от конкретной клинической ситуации.
Таким образом, появление Конкора АМ существенно расширяет возможности современной антигипертензивной терапии. Если следовать официальным рекомендациям, то его целесообразно использовать больным с сочетанием АГ и ИБС и как основу для тройной терапии. Среди возможных
клинических ситуаций, при которых можно отдать предпочтение Конкору АМ, выделяют следующие:
• любая АГ с тахикардией;
• резистентная АГ;
• АГ в молодом возрасте (имеются данные об улучшении на фоне лечения бисопрололом потенции);
• систолодиастолическая и диастолическая АГ;
• пожилые пациенты с остеопорозом;
• АГ после перенесенного ИМ;
• АГ в сочетании с желудочковыми и наджелудочковыми экстрасистолами и постоянной формой мерцательной аритмии.
Необходимо помнить о и показаниях Off label, официально не прописанных в инструкции по применению, но возможных в связи с наличием β-АБ в комбинации (эссенциальный тремор, повышенная тревожность и глаукома).



