Введение
Одним из способов своевременной диагностики меланомы кожи является активное динамическое наблюдение за образованиями с клиническими признаками атипии, особенно у пациентов группы повышенного риска развития злокачественной опухоли. Cовершенствование дерматоскопической техники и внедрение в практику цифровых приборов позволяют без существенных временных затрат проводить фотодокументирование отдельных образований и объективно оценивать их дальнейшее клиническое течение.
Литературные данные
Первые сообщения о выявленных подобным образом меланомах приходятся на начало XXI в., причем большинство из них описывают единичные наблюдения без подробных характеристик диагностированных опухолей. Так, в работе H. Kittler et al. выявлено 8 случаев поверхностно-распространяющейся меланомы (5 – in situ, 3 – инвазивные толщиной 0,3–0,6 мм по Бреслоу) среди 1271 наблюдаемого образования у 202 пациентов. Показанием к удалению в этих случаях служили изменение дерматоскопической картины (появление периферических точек черного цвета, атипичных полос или участка рубцово-подобной депигментации, изменение рисунка пигментной сети) и увеличение размера образования, сопровождаемое изменением его формы [1]. S.W. Menzies et al. выявили 7 ранних меланом (5 – in situ, 2 – инвазивные толщиной 0,2–0,3 мм по Бреслоу) среди взятых под наблюдение 318 атипичных образований. Авторы описывают любые изменения размера, формы, характера окрашивания образования или его дерматоскопической структуры, выявляемые за короткий период наблюдения (в среднем 3 месяца) как подозрительные в отношении возможного наличия злокачественной опухоли [2]. J. Malvehy et al. выявили 8 меланом (2 – in situ, 6 – инвазивные толщиной до 0,8 мм по Бреслоу) среди 3170 наблюдаемых образований у 290 пациентов. Авторы указывают, что при первичном осмотре выявленные опухоли мало отличались от остальных образований пациента. Критериями для выполнения эксцизионной биопсии в работе стали значительное увеличение или уменьшение размера наблюдаемого образования, изменение его дерматоскопической картины (изменение рисунка пигментной сети или характера распределения точек и глобул, появление атипичных полос, бело-голубых структур и атипичных сосудов), а также появление новых оттенков цвета [3]. J. Robinson et al. описывают 4 меланомы in situ, выявленные в среднем за 12,3 месяца среди 3482 наблюдаемых образований у 100 пациентов. Наблюдавшиеся в опухолях изменения включали увеличение размера пигментного образования и структурные изменения дерматоскопической картины (появление атипичных полос, периферических точек черного цвета, изменение рисунка пигментной сети) [4]. J. Bauer et al. диагностировали 2 случая меланомы in situ за 4–17 месяцев наблюдения среди 2015 наблюдаемых образований у 196 пациентов. В опухолях отмечалось увеличение размера образования и появление атипичных полос либо формирование рисунка атипичной пигментной сети [5]. S.R. Fuller et al. описали 1 случай меланомы in situ у пациента 39 лет, выявленной среди 5945 наблюдаемых образований у 297 пациентов. За 28 месяцев опухоль увеличилась в диаметре, изменила форму и характер окрашивания, общую дерматоскопическую модель строения [6]. Из-за возникающих изменений дерматоскопической картины в период краткосрочного динамического наблюдения (1,5–4,5 месяца) D. Altamura et al. выявили 81 случай меланомы (55 – in situ, 26 – инвазивные толщиной ≤0,8 мм по Бреслоу) [7]. H. Haenssle et al. в своем исследовании отмечают, что средняя толщина 32 меланом, выявленных в процессе динамического наблюдения за 11 137 образованиями у 688 пациентов, была меньше по сравнению с опухолями, выявленными в той же работе иным способом (0,41 против 0,62 мм, p=0,04) [8].
G. Argenziano et al. описали 12 случаев меланомы (6 – in situ, 6 – инвазивные толщиной 0,35–0,7 мм по Бреслоу), выявленных в процессе наблюдения за 600 образованиями у 405 пациентов. Средний возраст пациентов с диагностированной опухолью был 43,9 года, средняя продолжительность наблюдения перед удалением образования – 18,2 месяца [9]. Характер выявленных изменений дерматоскопической картины, требующий проведения диагностической биопсии, совпадал с критериями в работах H. Kittler [1] и S.W. Menzies [2]. Более подробные сведения о 103 развивавшихся меланомах G. Argenziano et al. приводят в ретроспективном многоцентровом исследовании. Средний возраст пациентов составил 46±16 лет, продолжительность наблюдения варьировала от 1 до 10 лет, в среднем составила 20 месяцев. При первичном осмотре опухоли были представлены преимущественно ретикулярной (62,1%), неспецифической (15,5%) и многокомпонентной (9,7%) моделями строения. В большинстве (78,6%) образований определялось наличие структурной или цветовой асимметрии, а также структур регресса в 35,9% случаев. За период наблюдения отмечалось увеличение 59,2% образований на 1–2 мм, 24,3% – более чем на 2 мм. Дерматоскопическое строение изменилось асимметрично в 63,1% образований, в 31,1% изменения носили равномерный и симметричный характер, а в остальных 5,8% случаев оставалось стабильным. Появление новой атипичной дерматоскопической структуры отмечалось в 33% образований. В 47,6% случаев была диагностирована меланома in situ, средняя толщина инвазивных опухолей составила 0,5 мм по Бреслоу [10].
В работе G. Salerni et al. описывают дерматоскопические характеристики 60 меланом, выявленных у 11 396 наблюдаемых образований у 688 пациентов. Авторы использовали схожие с работой H. Kittler et al. критерии изменений дерматоскопической картины, причем наибольшее значение они придавали выявляемым очаговым изменениям окрашивания образования или его дерматоскопического строения. На момент удаления в большинстве опухолей имело место наличие структурной или цветовой асимметрии дерматоскопической картины (65%) 1–2 оттенков цвета (68,35%), преобладание ретикулярной модели строения (68,3%). Значение общего дерматоскопического индекса (ОДИ) дерматоскопического правила ABCD соответствовало проявлениям доброкачественного образования только в 38,3%. Диагностированные опухоли были представлены преимущественно поверхностно-распространяющейся формой меланомы (93,3%), в 56,7% случаев была диагностирована меланома in situ, толщина инвазивных опухолей по Бреслоу варьировалась от 0,3 до 1 мм [11].
T. Firkle et al. описывают опыт выявления 11 меланом среди 1027 наблюдаемых образований у 121 пациента. Средний возраст пациентов на момент удаления опухолей составил 54,1 года, средняя продолжительность наблюдения – 9,4 месяца. За указанный период отмечались следующие изменения: увеличение размера на 25% от изначальной площади или на ≥2 мм (36,4%), изменение формы (54,5%), появление меланома-специфичного дерматоскопического признака (90,9%), нового оттенка цвета или изменение окрашивания (63,6%). При гистологическом исследовании в 7 случаях была диагностирована меланома in situ, толщина инвазивных опухолей по Бреслоу варьировалась от 0,3 до 0,5 мм [12].
L. Ungureanu et al. выявили 6 меланом среди взятых под наблюдение 2965 образований у 1406 пациентов. Наиболее значимыми изменениями дерматоскопической картины оказались асимметричное увеличение образования, изменение рисунка пигментной сети, появление структур серо-синего цвета и бесструктурных зон гипопигментации [13]. Для выявления 91 меланомы C. Rinner et al. потребовалось наблюдение продолжительностью 4,2±3,4 года. В образованиях, оказавшихся злокачественной опухолью, при первичном осмотре преобладала модель строения с рисунком пигментной сети (53,8%). Половина выявленных опухолей оказалась меланомой in situ, толщина большинства инвазивных меланом не превышала 1 мм по Бреслоу [14]. В исследовании E. Moscarella et al. указаны преимущественно гистологические характеристики 60 выявленных меланом среди 3823 наблюдаемых образований у 541 пациента. За краткосрочный интервал (3–6 месяцев) выявлено 23 опухоли, остальные – за более продолжительный период наблюдения. Авторы подчеркивают, что 25% выявленных в процессе длительного наблюдения опухолей не были изначально взяты под контроль. Чуть менее половины (46,7%) образований диагностированы как меланома in situ, толщина инвазивных опухолей варьировалась от 0,2 до 1 мм по Бреслоу [15].
R. Pampena et al. провели ретроспективный анализ 86 меланом, развившихся самостоятельно и на фоне существовавшего ранее меланоцитарного невуса. Большинство (83,7%) опухолей увеличились за период наблюдения, однако изменение окрашивания наблюдалось только в 19,8% случаев. Меланомы, возникшие de novo, отличались большим полиморфизмом дерматоскопической картины при первичном осмотре и требовали более короткого периода наблюдения (8 месяцев против 18,6; p=0,001). В невус-ассоциированных меланомах чаще становился более выраженным рисунок атипичной пигментной сети, негативной сети и «дерматоскопического острова», либо имело место формирование нового атипичного признака. В самостоятельно развивающихся опухолях чаще наблюдалось усиление имеющихся признаков атипии, в частности изменение рисунка атипичной пигментной сети, характера окрашивания, распределения точек и глобул, степени выраженности «дерматоскопического острова» и явлений регресса [16].
Среди 13 меланом, выявленных S.P. Saura et al. в процессе динамического наблюдения, только 6 случаев были доступными для оценки изменений дерматоскопической картины. В наблюдаемых образованиях авторы отмечали асимметричное увеличение опухолей, очаговые структурные изменения и изменение окрашивания.
В 5 случаях опухоли не были ранее взяты под наблюдение и изменения стали заметными при повторном клиническом осмотре, в остальных 2 случаях отмечалось формирование нового образования [17].
Собственные наблюдения
Для более подробного описания клинико-дерматоскопических характеристик развивающихся опухолей мы провели ретроспективный анализ собственных случаев меланомы кожи, выявленных в процессе динамического наблюдения за меланоцитарными образованиями при помощи дерматоскопии за 2018–2021 гг. Оценка и сравнение дерматоскопических изображений, полученных при помощи цифрового дерматоскопа РДС-2 и ручного дерматоскопа Heine Delta 20, проводились согласно критериям H. Kittler [1] и G. Argenziano [10] (см. таблицу).

Во всех случаях диагноз подтверждался гистологическим исследованием.
Меланома была выявлена у 18 (78,3%) женщин и 5 (21,7%) мужчин. Возраст больных варьировал от 28 до 70 лет, в среднем составил 36,7±10,5 года. У 22 из 23 пациентов отмечались значимые факторы риска развития меланомы кожи, в т.ч. синдром диспластических невусов (65,2%), множественные меланоцитарные невусы (17,4%), отягощенный личный анамнез по меланоме (8,7%) и немеланомному раку кожи (4,3%). Выявленные опухоли одинаково часто располагались на нижних конечностях и туловище (по 47,8% каждая локализация), в одном случае – на волосистой части головы (4,4%).
Клинические проявления опухолей при первичном осмотре мало отличались от остальных меланоцитарных невусов за исключением одного случая, в связи с чем изначальные внешние проявления большинства образований были недоступны для анализа. Первичная фотодокументация дерматоскопической картины проводилось из-за выявленных врачом умеренных признаков атипии в образовании (47,8% случаев) и жалоб пациента на появление нового или изменение старого образования (17,4%).
В остальных (34,8%) случаях не отмечалось каких-либо признаков атипии и исходное изображение было получено только благодаря документации всех осматриваемых образований цифровым дерматоскопом. Средний диаметр образований составил 4,2±2,2 мм. Дерматоскопическая модель строения с преобладанием рисунка пигментной сети была выявлена в 78,3% образований с преобладанием бесструктурных зон – в 17,4%, глобулярная модель – в 4,3%. Значение ОДИ дерматоскопического правила ABCD варьировало от 1,5 до 5,4 балла, среднее составило 3,4±0,9 балла.
Наблюдение за пигментными образованиями до принятия решения об удалении проводилось в течение 3–24 месяцев, в среднем – 10,5±5,4 месяца. При повторном осмотре большинство опухолей было окрашено в два (82,6%) цвета, имело неправильную форму (52,2%), неравномерную окраску (73,9%) и резкие границы (95,6%). За указанный период средний диаметр наблюдаемых образований увеличился до 5,4±2,3 мм, а среднее значение ОДИ дерматоскопического правила ABCD возросло до 4,6±1,2. Отличия данных характеристик при первичном и повторном осмотрах носили статически значимый характер (p<0,05, t-тест). Изменения дерматоскопической картины проявлялись асимметричным увеличением образования и/или изменением его формы в 43,5% случаев, появлением нового оттенка цвета – в 69,6%, формированием атипичной дерматоскопической структуры – в 65,2%, изменением рисунка пигментной сети в 56,5%. Существенно реже отмечалось изменение дерматоскопической модели строения всего образования и частичный регресс образования – в 21,7 и 4,3% наблюдений соответственно. Только один из указанных вариантов изменения дерматоскопической картины отмечался в 17,4% случаев, одновременно 2 или 3 – в 30,4% случаев каждый, 4 – в 17,4% и 5 – в 4,4% случаев. Указанные изменения носили незначительный характер в 8,7% случаев, умеренный – в 47,8%, выраженный – в 43,5%. Изменения дерматоскопической картины в процессе динамического наблюдения приведены на рис. 1–6.
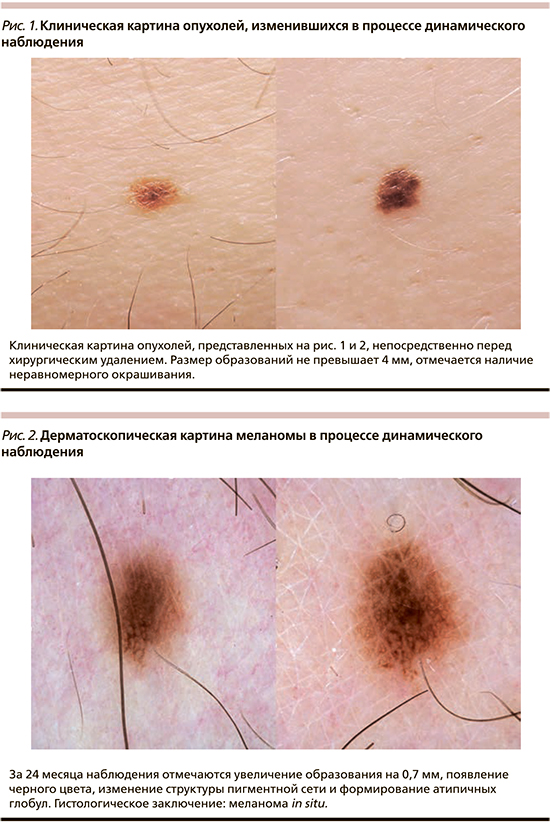
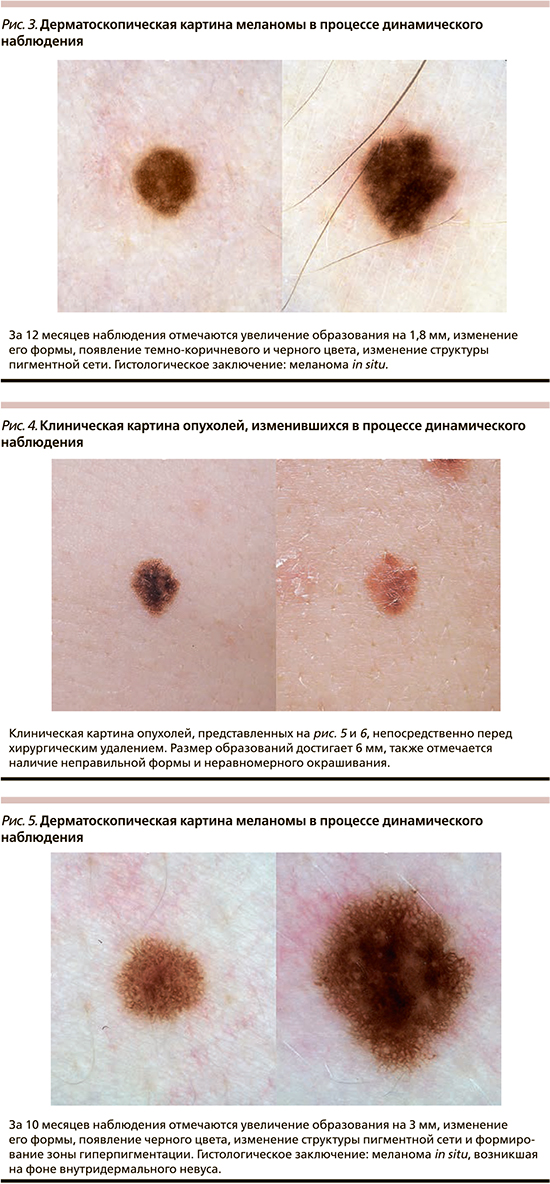
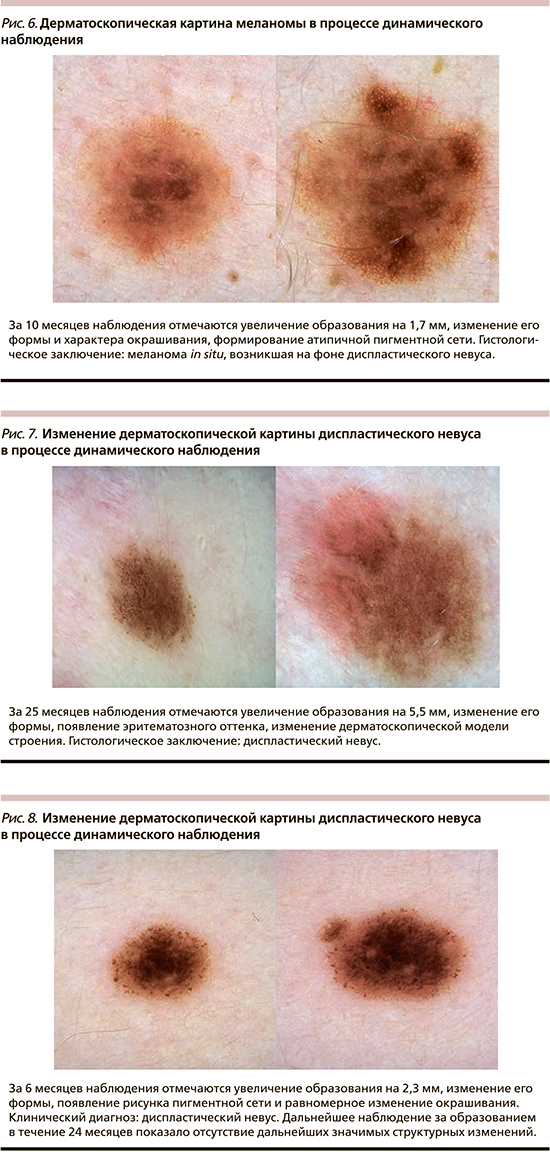
При морфологическом исследовании 52,2% опухолей располагались внутриэпидермально (меланома in situ), остальные частично проникали в сосочковый слой дермы (II уровень инвазии по Кларку). Толщина инвазивных опухолей по Бреслоу варьировала от 0,2 до 0,5 мм, в среднем составила 0,3±0,1 мм. В 73,9% случаев меланома представлена поверхностно-распространяющейся гистологической разновидностью, в 13% – лентигинозной, в 8,7% горизонтальная фаза роста не могла быть классифицирована, в 4,4% выявлена лентиго-меланома. Только 26,1% опухолей развились на фоне существовавшего ранее меланоцитарного невуса, причем в большинстве случаев фоновым образованием являлся внутридермальный или малый врожденный меланоцитарный невус без признаков атипии.
Обсуждение
Результаты текущего исследования соответствуют приведенным выше данным, а также работам, посвященным своевременной диагностике меланомы и опубликованным до этого в отечественной литературе [18, 19]. На разных выборках, включая текущую, мы показали, что начальные проявления меланомы кожи существенно отличаются от привычных представлений об этой злокачественной опухоли и чрезвычайно сложны с диагностической точки зрения. Помимо предлагаемой нами ранее тактики активного выявления образований, отличающихся по дерматоскопической картине от привычных моделей строения меланоцитарных невусов, помочь выявить раннюю меланому могут описанные в статье изменения дерматоскопической картины.
Полученные данные интересны с точки зрения скорости развития опухоли и продолжительности наблюдения атипичных образований. Ориентируясь на значение средней продолжительности наблюдения перед удалением опухоли, можно считать нецелесообразным краткосрочное динамическое наблюдение (период менее 6 месяцев) за образованиями с незначительными и/или умеренными признаками атипии. В таком случае постепенное удлинение интервалов между осмотрами пациентов из группы риска (например, до 9–12 месяцев при первичном обращении и до 12–18 месяцев при повторном) позволит более точно судить о необходимости удаления существующих образований с признаками атипии. Более остро, на наш взгляд, стоит вопрос о частоте повторных осмотров пациентов без дополнительных факторов риска развития рака кожи. Распространенная практика проведения ежегодного обследования таким людям видится нецелесообразной при отсутствии жалоб на появление нового образования, отличного от существующих, или видимого изменения имевшегося ранее образования. Результаты различных скрининговых кампаний, направленных на выявление меланомы кожи, показывают неоднозначную эффективность таких программ и возможность более редкого обследования пациентов без факторов риска [20–22].
Продолжая обсуждение оптимальной тактики ведения пациента, обратившегося для осмотра новообразований кожи, следует подчеркнуть необходимость формирования обширной базы дерматоскопических изображений существующих пигментных образований при первичном обращении пациента. Особенностью используемого авторами цифрового дерматоскопа РДС-2 является одномоментное сохранение дерматоскопического изображения во время проведения осмотра. Получаемое изображение в любой последующий момент времени может быть запрошено из архива, привязано к локализации (т.е. «картировано») и сопоставлено с другими снимками. Стандартизация порядка осмотра кожного покрова, заключающаяся в последовательной, воспроизводимой на каждом повторном визите оценке разных участков кожи и существующих образований, позволяет врачу в большинстве случаев сопоставлять внешние проявления пигментного образования, даже не взятого ранее под наблюдение, с имеющимися фотографиями из архива. Именно таким образом выявлена треть опухолей, включенных в исследование и проявлявшихся при первичном осмотре полным отсутствием каких-либо признаков атипии, но задокументированных при помощи цифрового дерматоскопа и сопоставленных в динамике на повторном визите.
Существующий альтернативный подход к наблюдению за пациентами группы риска, включающий в т.ч. сравнение обзорных изображений всей поверхности кожи для выявления изменяющихся или новых образований, имеет некоторые ограничения. При изменении ранее некартированного образования и отсутствии возможности объективной оценки этих изменений врачу может потребоваться дополнительное время для принятия обоснованного решения о необходимости его удаления. Так, опухоли со слабовыраженными или умеренными признаками атипии дерматоскопической структуры (рис. 1–3) могли бы быть ошибочно оставлены под дальнейшее наблюдение в случае отсутствия исходного дерматоскопического изображения. Кроме того, незначительное увеличение размера (не более 1 мм в 43,4% случаев исследуемой выборки) может быть плохо различимо на обзорном снимке и остаться незамеченным.
Отдельного обсуждения требует выявленный, преимущественно умеренный, характер изменения дерматоскопической картины в ранних меланомах. Наши собственные наблюдения и описанные ранее литературные данные [23] свидетельствуют о возможном схожем изменении структуры формирующихся диспластических невусов и развивающейся злокачественной опухоли. Неправильная форма, неоднородный характер окрашивания, более крупный размер, дерматоскопические признаки цветовой и структурной асимметрии диспластических невусов становятся заметными только со временем (рис. 7, 8) и не позволяют исключать начальные проявления меланомы. В связи с этим важно начинать объективное наблюдение за пациентами группы риска максимально рано, чтобы точнее понимать длительность существования того или иного образования и динамику его развития. Клиническим признаком, позволяющим в таких ситуациях думать о доброкачественном процессе, будет обнаружение однотипных изменений со стороны остальных образований пациента.
Заключение
Выявление значимых структурных изменений со стороны единичного образования у пациента группы риска следует рассматривать как показание к проведению эксцизионной диагностической биопсии.



