В связи с влиянием постинфарктного кардиосклероза (ПИКС) на прогрессирование заболевания и продолжительность жизни данной группы пациентов выработка тактики лечения пациентов с ПИКС и оценка его эффективности являются одной из наиболее важных проблем современной кардиологии. Представлены результаты анализа динамики функциональных и лабораторных показателей 68 больных ПИКС (43 мужчин и 25 женщин), получавших рекомендованную фармакотерапию, в реальной клинической практике. Средний срок наблюдения составил 8,1 ± 5 лет. У всех больных ПИКС отмечены сопутствующие заболевания. Фармакотерапия пациентов с перенесенным инфарктом миокарда включала ?-адреноблокаторы (82,4 %), ингибиторы ангиотензинпревращающего фермента (80,9 %), антиагреганты (94 %), диуретики, нитраты, статины. В процессе лечения зарегистрировано снижение артериального давления (АД), целевой уровень которого достигнут 46,7 % пациентов. Достигнуто снижение индекса массы миокарда левого желудочка (ИММЛЖ), уменьшение доли больных с концентрической и эксцентрической гипертрофией левого желудочка (ЛЖ), у части пациентов восстановилась нормальная геометрия ЛЖ. Показатели функции почек, углеводного и липидного обмена не изменились. Таким образом, фармакотерапия пациентов с перенесенным инфарктом миокарда в основном соответствовала рекомендациям ВНОК, отмечено недостаточное назначение гиполипидемической терапии. Достигнуто снижение АД и ИММЛЖ, уменьшилась доля больных с неблагоприятным типом ремоделирования миокарда.
Введение
Инфаркт миокарда (ИМ) является одной из ведущих причин смерти от сердечно-сосудистых заболеваний и самой частой причиной внезапной смерти [1, 2]. В Российской Федерации ИМ ежегодно развивается у 0,2–0,6 % мужчин в возрасте 40–59 лет; заболеваемость ИМ возрастает до 1,7 % у
мужчин старшей возрастной группы (60–64 года) [1, 2]. Больные с перенесенным ИМ имеют множество сопутствующих заболеваний [3], среди которых наиболее часто встречаются артериальная гипертензия, хроническая сердечная недостаточность, нарушение функции почек, которые, образуя
сердечно-сосудистый и кардиоренальный континуум, способствуют ухудшению прогноза пациентов с постинфарктным кардиосклерозом (ПИКС) [4]. Наиболее значимым фактором для определения прогноза у больных ИМ является ремоделирование сердца, приводящее к сердечной недостаточности [5, 6]. Эксцентрическая гипертрофия способствует появлению систолической дисфункции миокарда левого желудочка (ЛЖ) со снижением фракции выброса [7]. Неблагоприятные последствия концентрической гипертрофии ЛЖ (ГЛЖ) обусловливают диастолическая дисфункция ЛЖ и электрическая нестабильность миокарда [8]. Терапия ингибиторами ангиотензинпревращающего фермента (ИАПФ) и β-адреноблокаторами улучшает состояние диастолической функции ЛЖ [9, 10].
Для увеличения продолжительности жизни пациентов с перенесенным ИМ применяются препараты, доказавшие снижение риска повторного ИМ и смертности: ацетилсалициловая кислота, клопидогрел (в течение года после ИМ), статины, β-адреноблокаторы, ИАПФ, нитраты и диуретики по показаниям [11–13]. Реальная клиническая практика врачебных назначений и приема пациентами лекарственных препаратов зачастую отличается от клинических рекомендаций [14, 15].Недостаточное назначение пациентам с перенесенным ИМ препаратов указанных групп выявлено в регистре NRMI, исследованиях MONICA, EUROASPIRE II. В российских фармакоэпидемиологических исследованиях также отмечено недостаточное назначение ИАПФ, кардиоселективных β-адреноблокаторов, спиронолактона,
статинов, антиагрегантов [16–19].
Несмотря на обилие исследований, посвященных изучению клинических аспектов влияния ИАПФ,
β-адреноблокаторов и других лекарственных препаратов на течение ПИКС и сердечной недостаточности, не до конца изучена динамика клинических, лабораторных, функциональных показателей пациентов с перенесенным ИМ и полиморбидной сопутствующей патологией, получающих рекомендованное лечение в реальной клинической практике.
Цель исследования – оценить динамику функциональных и лабораторных показателей у больных ПТКС,
получающих рекомендованную фармакотерапию, в реальной клинической практике.
Материал и методы
Методом случайного отбора выбраны амбулаторные карты больных, наблюдавшихся в городской поли-
клинике № 3 Сыктывкара по поводу ПИКС. Изучался анамнез заболевания, оценивались результаты лабораторного и инструментального исследований, Эхо-кардиографии (Эхо-КГ), клиническое состояние; регистрировалось артериальное давление (АД) на приеме. Все показатели оценивались
в динамике – в начале врачебного наблюдения по амбулаторной карте и на момент последнего обращения пациента. Всего проанализировано 68 амбулаторных карт, в т. ч. 43 мужчин и 25 женщин; средний возраст больных – 68,8 ± 10,1 года. Средний срок наблюдения по амбулаторным картам
составил 8,1 ± 5,1 года.
Масса миокарда ЛЖ (ММЛЖ, г) рассчитана по формуле Devereux (1986): ММЛЖ = 1,04 × [(КДР +
ЗСЛЖ+МЖП)3-КДР3]-13,6, где КДР – конечный диастолический размер ЛЖ, ЗСЛЖ – толщина задней стенки ЛЖ, МЖП – толщина межжелудочковой перегородки [20]. Индекс массы миокарда ЛЖ (ИММЛЖ) рассчитан по формуле: ММЛЖ/площадь поверхности тела (г/м2). Индекс относительной толщины стенок ЛЖ (ОТС ЛЖ, мм) рассчитан по формуле: толщина ЗСЛЖ + МЖП/КДР ЛЖ. Оценена геометрическая модель ЛЖ: при концентрической ГЛЖ: ИММЛЖ у мужчин – более 125 г/м2, у женщин – более 110 г/м2 (ЕОК, ЕОГ 2004), ОТС ЛЖ более 0,45; при эксцентрической ГЛЖ наблюдалось увеличение ИММЛЖ, ОТС ЛЖ менее 0,45; при концентрическом ремоделировании (КРМ) – ИММЛЖ менее 125–110 г/м2, ОТС ЛЖ более 0,45 [21]. Скорость клубочковой фильтрации (СКФ) рассчитана по формуле, полученной в исследовании MDRD (Modification of Diet in Renal Disease Study,1999) [22]: СКФ (мл/мин/1,73 м2) = 186 × (креатинин сыворотки, мг/дл)-1,154 × (возраст, годы)-0,203; для женщин
результат умножают на 0,742, для лиц негроидной расы – на 1,210. Стадия хронической болезни почек определена в соответствии с классификацией K/DOQI 2002 (Kidney Disease Outcome Quality Initiative Advisory Board) [23].
Формирование базы данных осуществлено в формате Microsoft Excel. Статистическая обработка данных произведена с использованием программы BIOSTAT. Применены стандартные параметры описательной статистики. Проверка статистической гипотезы о нормальности распределения осуществлена с использованием критерия Шапиро–Уилка. Количественные величины представлены в виде среднего арифметического значения ± стандартное отклонение. Сравнение величин с интервальной шкалой измерения, представленных в виде среднего арифметического значения ± стандартное отклонение, осуществлено с помощью t-критерия Стьюдента для независимых выборок.
В отдельных случаях (при непараметрическом распределении значений переменной определяли с помощью критерия Колмогорова–Смирнова), для описания количественных переменных использована медиана (25; 75 процентиль). Сравнение количественных величин, представленных в виде медианы (25; 75 процентиль), осуществлено с использованием U-теста Манна–Уитни (для двух независимых
выборок), при сравнении результатов до и после лечения – теста Уилкоксона и метода знаков. Дискретные величины представлены в виде частот (процент наблюдений к общему числу обследованных). Для сравнения дискретных величин в независимых группах использован критерий Пирсона χ2 для частотной таблицы 2 × 2 с введением поправки на непрерывность (по Йетсу). Уровень статистической значимости принят равным р < 0,05.
Результаты
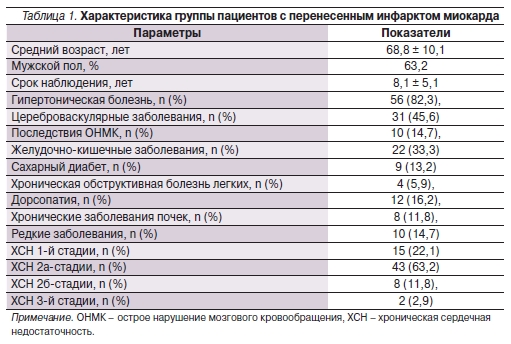
Характеристика группы пациентов с ПИКС представлена в табл. 1. В структуре пациентов с ПИКС преобладали мужчины (63 %). У всех больных ПИКС отмечались сопутствующие заболевания; в структуре сопутствующей патологии ведущими являлись гипертоническая болезнь (82,3 %), цереброваскулярные заболевания (45,6 %), большинство больных имели ХСН 2а-стадии и выше. Уровень креатинина определен для 66 (97,1 %) больных. Среднее расчетное значение СКФ в начале наблюдения – 87,7 ± 16,3 мл/мин/1,73 м2.
Функциональное состояние почек у больных ПИКС в начале наблюдения представлено в табл. 2. Нормальные показатели функции почек выявлены у 31,8 % пациентов с перенесенным ИМ, у половины больных имелось умеренное снижение функции почек. Значительное снижение СКФ (менее 60 мл/мин/1,73 м2) выявлено в 18,2 % случаев; пациенты этой группы были старше, чем больные 1-й и 2-й групп (р = 0,017).
Таблица 2.
Функциональное состояние почек у больных ПИКС в начале наблюдения (n = 66).
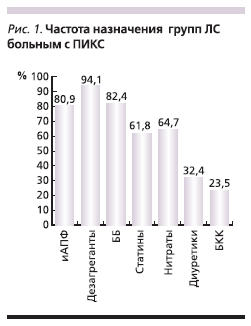
Частота назначения различных групп лекарственных средств больным ПИКС в начале наблюдения представ-лена на рисунке.
Фармакотерапия пациентов с перенесенным ИМ по назначениям врачей включила β-адреноблокаторы (82,4 %), ИАПФ (80,9 %), антиагреганты (94,1 %), диуретики, нитраты, статины, блокаторы кальциевых каналов. Было отмечено недостаточное назначение гиполипидемических препаратов и β-адреноблокаторов.
Таблица 3.
Частота назначения и доза лекарственных препаратов в начале наблюдения.
Частота назначения и дозы лекарственных средств в начале наблюдения представлены в табл. 3. В группе ИАПФ наиболее часто назначали эналаприл (80 %); β-адреноблокаторов – бисопролол (55,3 %), в группе диуретиков – гидрохлоротиазид (40,9 %), дезагрегантов – ацетилсалициловую кислоту (100 %). Назначения лекарственных средств соответствовали общепринятым рекомендациям, в то же время имели место недостаточные дозировки гиполипидемических препаратов.
Динамика клинических и лабораторных показателей у больных ПИКС за период наблюдения представлена в табл. 4.
Таблица 4.
Динамика клинических и лабораторных показателей у больных ПИКС за период наблюдения (n = 68).
В начале наблюдения больных отмечено умеренное повышение средних показателей систолического АД и холестерина, умеренное снижение СКФ. За период наблюдения достигнуто снижение систолического АД на 3 % (4,6 мм рт. ст.) и диастолического АД на 5 % (3,8 мм рт. ст., р = 0,001); целевого уровня АД достигли 28 (46,7 %) из 60 пациентов с сопутствующей гипертонической болезнью. Показатели глюкозы крови, холестерина, креатинина и СКФ за период наблюдения не претерпели статистически значимых изменений.
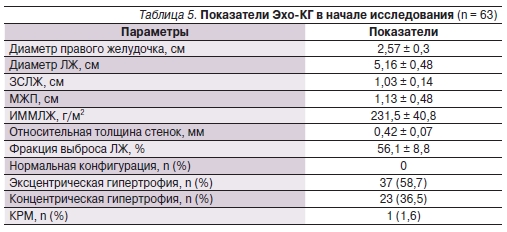
Эхо-КГ проведено в начале наблюдения 63 (92,6 %) больным. Показатели Эхо-КГ в начале исследования представлены в табл. 5.
В начале исследования отмечено увеличение показателей ИММЛЖ, снижение показателя ОТС, преобладание ремоделирования миокарда по эксцентрическому типу.
Динамику показателей Эхо-КГ среди больных ПИКС за период наблюдения удалось проследить у 36 пациентов. Динамика показателей Эхо-КГ представлена в табл. 6.
Таблица 6.
Динамика показателей Эхо-КГ у больных ПИКС за период наблюдения (n = 36).
За период наблюдения статистически значимо снизился ИММЛЖ без существенных изменений других параметров. Тип конфигурации сердца за время наблюдения также претерпел существенные изменения (р = 0,009): в начале наблюдения у пациентов преобладал эксцентрический тип ГЛЖ (58,3 %), в динамике отмечено уменьшение доли пациентов с концентрической (на 33 %, р = 0,058) и эксцентрической (на 43 %) ГЛЖ, а у 36,1 % пациентов восстановилась нормальная геометрия ЛЖ (р < 0,0001). В группе пациентов с изначальной концентрической ГЛЖ (n = 15) к концу периода наблюдения нормальная конфигурация сердца отмечена у 3 (20 %) больных, эксцентрическая гипертрофия – у 4 (26,7 %), концентрическая гипертрофия – у 8 (53,4 %) больных. В группе больных
ПИКС с изначальной эксцентрической гипертрофией (n = 21) за период наблюдения тип конфигурации ЛЖ претерпел следующие изменения: нормальная конфигурация сердца зарегистрирована у 10 (47,6 %) больных, концентрическая гипертрофия – у 2 (9,5 %) пациентов, эксцентрическая гипертрофия – у 8 (38,1 %), КРМ – у 1 (4,8 %) больного.
Таким образом, за счет уменьшения массы миокарда ЛЖ достигнуто уменьшение числа больных с
прогностически неблагоприятным типом ремоделирования – эксцентрической и концентрической ГЛЖ
и восстановление нормальной геометрии ЛЖ у значительного числа пациентов.
Обсуждение
В настоящем исследовании показано, что больные, перенесшие ИМ, – это полиморбидные пациенты со
сформировавшимся сердечно-сосудистым и кардиоренальным континуумом, неблагоприятным ремоделированием миокарда ЛЖ, высоким риском сердечно-сосудистых осложнений и смертности. Лечение таких больных представляет для врача непростую задачу. Национальными руководствами таким пациентам рекомендованы лекарственные препараты с доказанной эффективностью и безопасностью, в то же время в реальной клинической практике не всегда удается строго выполнять
указанные рекомендации. Несмотря на некоторые недостатки в лечении пациентов, выявленные в настоящем исследовании, необходимо констатировать, что в процессе лечения за период наблюдения зарегистрировано снижение АД, целевой уровень АД достигнут у 46,7 % пациентов; достигнуто снижение ИММЛЖ, уменьшение доли пациентов с неблагоприятным типом ремоделирования миокарда – концентрической и эксцентрической ГЛЖ, у части пациентов восстановилась нормальная геометрия ЛЖ; не прогрессировала степень почечной дисфункции. Наблюдаемые позитивные сдвиги способствуют уменьшению риска сердечно-сосудистых осложнений и смертности. Считаем целесообразным рекомендовать усиление терапии β-адренобло-каторами и гиполипидемическими препаратами.
Выводы
Пациенты, перенесшие ИМ, имеют множество сопутствующих заболеваний, среди которых наиболее часто встречаются гипертоническая болезнь, цереброваскулярные заболевания, хроническая сердечная недостаточность, снижение функции почек. По данным Эхо-КГ, в начале наблюдения было зарегистрировано повышение ИММЛЖ, снижение ОТС, преобладание ремоделирования миокарда по
эксцентрическому типу.
Фармакотерапия больных, перенесших ИМ, в основном соответствовала рекомендациям ВНОК; было
отмечено недостаточное назначение β-адреноблокаторов и гиполипидемической терапии.
В процессе лечения было зарегистрировано снижение АД; целевой уровень АД был достигнут 46,7 % пациентов. Достигнуто снижение ИММЛЖ, уменьшение доли пациентов с неблагоприятным типом ремо-делирования миокарда – концентрической и эксцентрической ГЛЖ, у части пациентов восстановилась нормальная геометрия ЛЖ.