Абсанс (от французского absence – буквально отсутствие) – внезапное и кратковременное выключение сознания. Атипичные абсансы (АА) – эпилептические приступы абсансов, ассоциированные на электроэнцефалограмме (ЭЭГ) с паттернами нерегулярной медленной пикволновой активности с частотой менее 2,5 Гц или пароксизмальной быстрой активностью при замедлении основной активности фоновой записи [Stedman’s Medical Dictionary, 2006]. Данное определение является в настоящее время классическим, но вызывает много нареканий.
В 1950 г. W.G. Леннокс и J.P. Дэвис [17] впервые предложили термин “атипичные абсансы” – приступы замираний с выключением сознания, сопровождающиеся на ЭЭГ медленными разрядами комплексов острая– медленная волна – “petit mal variant”. Данный тип приступов считался облигатным для синдрома Леннокса–Гасто. Позже были описаны другие эпилептические синдромы: эпилепсия с миоклонически статическими приступами (синдром Доозе), эпилепсия с миоклоническими абсансами (синдром Тассинари) и др., в структуру которых также входили АА [23].
Параллельно было сформулировано еще одно смысловое значение АА как “псевдогенерализованных приступов” – приступов, имеющих кинематические характеристики генерализованных, диффузные иктальные ЭЭГ-паттерны, но по механизму возникновения являющиеся фокальными [7]. В основе данного типа приступов лежит феномен вторичной билатеральной синхронизации – ВБС [24]. Дальнейшие работы подтвердили существование АА, связанных со структурными локальными нарушениями коры головного мозга при симптоматической фокальной эпилепсии [1, 3, 13]. Развитие медицинских технологий в последние десятилетия позволило показать, что АА при синдроме Леннокса–Гасто в большинстве случаев являются псевдогенерализованными (в рамках феномена ВБС), а сам синдром часто является фенокопией, “маской” симптоматических фокальных/мультифокальных эпилепсий, связанных с органическим повреждением головного мозга или с наследственными генетическими заболеваниями [2, 3, 12].
Атипичные абсансы также выявляются у пациентов с особой группой эпилептических энцефалопатий, ассоциированных с доброкачественными эпилептиформными паттернами детства и электрическим статусом медленного сна. К ним относят синдромы Ландау–Клеффнера (СЛК), псевдо-Леннокса, эпилепсию с электрическим эпилептическим статусом медленного сна [6]. В этой группе заболеваний АА рассматривают как псевдогенерализованные приступы.
Большинство исследователей сходятся во мнении, что эпилептические синдромы, ассоциированные с АА, как правило, тяжело поддаются лечению антиэпилептическими препаратами. Нередки случаи резистентного течения заболевания, сочетающиеся с интеллектуально-мнестическими расстройствами и глубокой инвалидизацией пациентов [8].
Цель исследования: изучение эффективности антиэпилептической терапии в лечении эпилептических синдромов, ассоциированных с АА.
Материал и методы исследования
В исследование вошли 129 пациентов, у которых в ходе заболевания были зарегистрированы АА с различ- ными формами эпилепсии и дебютом приступов от первых суток жизни до 18 лет. Пациенты наблюдались с 1999 по 2011 г. Исследование проводилось на клинической базе Института детской неврологии и эпилепсии им. Святителя Луки.
Диагностика эпилептических синдромов базировалась, согласно критериям Международной классификации эпилепсий, эпилептических синдромов и схожих заболеваний (1989), а также на основании доклада комис- сии ILAE (International League Against Epilepsy) по классификации и терминологии (2001).
Все пациенты были клинически обследованы неврологом; проведено рутинное ЭЭГ-исследование; также во всех случаях проводился продолженный видео-ЭЭГ-мониторинг с включением сна (аппарат электроэнцефалограф-анализатор ЭЭГА-21/26 ЭНЦЕФАЛАН-131-03, модификация 11, Медиком МТД; видео-ЭЭГ-мониторинг “Нейроскоп 6.1.508”, Биола). Всем больным было проведено МРТ-исследование (магнитно-резонансная система Sigma Infinity GE с напряжением магнитного поля 1,5 Тесла).
Результаты исследования
Исследование показало, что АА встречались при 13 эпилептических синдромах (табл. 1).
Таблица 1. Общие характеристики пациентов с атипичными абсансами
Наиболее часто выявлялись криптогенная и симптоматическая фокальные формы эпилепсии – в 20,8 и 18,6 % случаев соответственно. Идиопатическая фокальная эпилепсия с псевдогенерализованными приступами (ИФЭ-ПГП) отмечена у 13,8 % пациентов. С одинаковой частотой в 7,0 % случаев наблюдались синдром Леннокса–Гасто, фокальная эпилепсия детства со структурными изменениями в мозге и доброкачественными эпилептиформными паттернами детства (ФЭДСИМ-ДЭПД), эпилепсия с электрическим эпилептическим статусом медленного сна (ESES-синдром). СЛК и эпилепсия с миоклоническими абсансами (ЭМА) были выявлены в 6,2 % случаев. У 4,7 % пациентов констатировали синдром псевдо-Леннокса (СПЛ), у
3,9 % – эпилепсию с миоклонически-астатическими приступами (МАЭ). В редких случаях (1,6 % больных) АА регистрировали при прогрессирующих формах эпилепсии с миоклонусом (болезни Унферрихта–Лунборга и Лафора), тяжелой миоклонической эпилепсии младенчества (синдром Драве), эпилепсии с эпилептическим миоклонусом век и абсансами (синдром Дживонса).
Исследование показало, что при эпилепсии, ассоциированной с АА, могут отмечаться различные типы приступов. Всего было выделено с учетом семиологических особенностей 16 типов приступов. Наиболее часто у пациентов с АА регистрировались вторично генерализованные судорожные приступы (ВГСП) – 33,3 % случаев, тонические приступы – 21,7 %, гемиклонические – 18,6 %, миоклонические – 17,1 % и негативный миоклонус – 15,5 %. Реже констатировались следующие типы эпилептических пароксизмов: генерализованные судорожные приступы – 11,6 % пациентов, фебрильные – 11,6 %, фокальные версивные – 10,9 %, эпилептические спазмы – 9,3 %, генерализованные атонические – 6,9 %, эпилептический миоклонус век – 5,4 % пациентов. В единичных случаях у больных АА выявлялись миоклонически-астатические приступы – 4,6 % случаев, затылочные приступы – 3,1 %, фокальные аутомоторные – 3,1 %, фокальный корковый миоклонус – 3,1 %, фокальные атонические приступы (“височные синкопы”) – 2,3 %.
Атипичные абсансы проявлялись кратковременным выключением сознания (однако сознание могло и флуктуировать на протяжении приступов) с прекращением деятельности, амимичным маскообразным лицом; нередко возникало форсированное моргание или миоклонус век; иногда гиперсаливация в момент приступов. У части больных АА клинически сопровождались атоническим компонентом в виде легких кивков, наклонов туловища с опусканием плеч, а также автоматизмами по типу ороалиментарных или жестовых. Продолжительность АА варьировалась от 5 до 35 секунд. У части пациентов с задержкой умственного развития определение факта наличия абсансов (т. е. приступов с изменением сознания), а также начало и окончание приступа представляли затруднения в связи со сложностями контакта и кратковременностью эпизода. Абсансные приступы могли иметь ”стертый” характер и практически не выявлялись в повседневной жизни пациента; их наличие доказывалось только в ходе видео-ЭЭГ-мониторинга.
Во всех случаях у пациентов с АА в ходе видео-ЭЭГ-мониторинга выявлялась диффузная эпилептиформная активность, представленная разрядами комплексов острая-медленная волна, пик-волна, полипик-волна, а также диффузными разрядами медленных комплексов острая-медленная волна. Следует отметить, что в подавляющем большинстве случаев наблюдалось нарастание индекса диффузных разрядов во сне по сравнению с бодрствованием. Постоянная продолженная диффузная эпилептиформная активность в фазу медленного сна констатировалась в 26,4 % случаев. В большинстве случаев диффузная эпилептиформная активность возникала в рамках ВБС.
В интериктальный период региональная/мультирегиональная эпилептиформная активность выявлялась в 98,4 % случаев. Важно отметить высокий процент констатации доброкачественных эпилептиформных паттернов детства (ДЭПД), регистрируемых в 38,8 % случаев среди всех пациентов с АА.
При назначении антиэпилептической терапии в виде как моно-, так и политерапии в различных комбинациях клиническая ремиссия была достигнута лишь в 53,5 % случаев эпилепсии, ассоциированной с АА. Снижение частоты всех типов приступов (на 50 % и более) на фоне антиэпилептических препаратов (АЭП) наблюдалось у 38,0 % пациентов. Отсутствие эффекта отмечено в 8,5 % случаев. Купирование приступов на фоне монотерапии достигнуто у 16,3 % больных. В этих случаях (монотерапия) ремиссия наблюдалась у 85,7 % пациентов на фоне приема производных вальпроевой кислоты и у 14,3 % при приеме сукцинимидов.
Исследование показало различную эффективность АЭП при лечении отдельных эпилептических синдромов, ассоциированных с АА (табл. 1). Высокий процент ремиссии наблюдался при следующих формах эпилепсии: МАЭ, эпилептический миоклонус век с абсансами (в 100 % случаев), ИФЭ-ПГП, СПЛ (83,3 %), ФЭДСИМ-ДЭПД (77,8 %). В самых больших группах пациентов в нашем исследовании – криптогенной и симптоматической фокальных форм эпилепсии ремиссия была достигнута только у 40,7 и 41,7 % больных. При синдроме Драве и прогрессирующих формах эпилепсии с миоклонусом ни в одном случае ремиссии достигнуто не было.
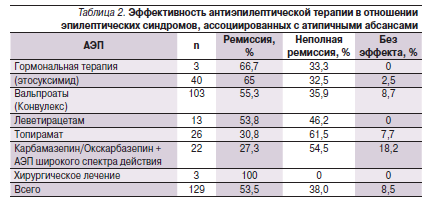
Представляет интерес анализ эффективности отдельных антиэпилептических препаратов, применяемых в лечении эпилептических синдромов, ассоциированных с АА (табл. 2).
Стартовая терапия в большинстве случаев осуществлялась с монотерапии вальпроатами (Конвулекс). Конвулекс применялся в растворе (для детей младшего возраста), капсулах и таблетках пролонгированного действия (форма ретард). Вальпроаты применялись в дозе 600–2000 мг/сут (30–75 мг/кг/сут). Ремиссия на фоне приема Конвулекса отмечена в 55,3 % случаев эпилептических синдромов, ассоциированных с АА. Снижение частоты приступов на 50 % и более констатировано в 35,9 % случаев. Отсутствие эффекта наблюдалось лишь у 8,7 % пациентов. При применении вальпроатов отмечен хороший эффект как в отношении псевдогенерализованных приступов (эпилептический миоклонус, АА), так и при фокальных пароксизмах, включая вторично генерализованные судорожные приступы.
При преобладании в клинической картине приступов АА и частых диффузных разрядов на ЭЭГ добавлялись сукцинимиды (этосуксимид) в дозе 250–1000 мг/сут (25–35 мг/кг/сут). При наличии исключительно псевдогенерализованных приступов и отсутствии фокальных, а также тонических пароксизмов этосуксимид применялся в виде монотерапии. Была констатирована высокая эффективность этосуксимида при псевдогенерализованных приступах (исключая тонические) и особенно в отношении блокирования частых диффузных разрядов на ЭЭГ. Ремиссия приступов на фоне приема этосуксимида была достигнута в 65 % случаев, снижение частоты приступов на 50 % и более – в 32,5 %. Отсутствие эффекта наблюдалось только в 2,5 % случаев. Наибольший эффект наблюдался при добавлении этосуксимида к Конвулексу.
Топирамат назначали в дозе 50–250 мг/сут (3–7 мг/кг/сут) в 2 приема. Препарат был высокоэффективен в отношении фокальных моторных, вторично генерализованных судорожных приступов и, что особенно важно, тонических пароксизмов. Применение топирамата привело к купированию приступов у 30,8 % пациентов, значительному улучшению – в 61,5 %; без эффекта – в 7,7 %.
Леветирацетам назначали преимущественно в комбинации с вальпроатами в дозе 375–3000 мг/сут (25–60 мг/кг/сут). Леветирацетам показал эффективность в отношени фокальных моторных, вторично генерализованных, тонических и миоклонических приступов. Блокирование приступов отмечено в 53,8 % случаев, снижение частоты приступов – в 46,2 %. Отсутствие эффекта не отмечено у пациентов, принимавших леветирацетам.
При применении препаратов группы карбамазепина в качестве монотерапии учащение приступов было отмечено в 83,3 % случаев. Имела место аггравация – в основном АА и эпилептического миоклонуса, а также диффузных эпилептиформных разрядов на ЭЭГ. Однако добавление препаратов карбамазепина в небольших и средних дозах к Конвулексу или топирамату в 27,3 % случаев приводило к полному купированию приступов и в 54,5 % – к их урежению. У данных пациентов также применялась комбинация окскарбазепина с Конвулексом или топираматом. Дозы препаратов карбамазепина варьировались от 200 до 900 мг/сут (10–25 мг/кг/сут), а окскарбазепина – от 300 до 1200 мг/сут (10–40 мг/кг/ сут). Препараты карбамазепина и окскарбазепин как добавочные были эффективными при наличии в клинической картине фокальных моторных, вторично генерализованных судорожных и тонических приступов.
При недостаточной эффективности АЭП в трех случаях эпилептических энцефалопатий, ассоциированных с продолженной эпилептиформной активностью в фазу медленного сна, применялись кортикостероидные гормоны (гидрокортизон перорально). Гормональная терапия привела к электроклинической ремиссии у двух пациентов, в одном случае отмечено уменьшение частоты приступов и снижение индекса эпилептиформной активности на ЭЭГ.
В трех случаях резистентной симптоматической фокальной эпилепсии (фокальная кортикальная дисплазия, полимикрогирия, порэнцефалическая киста) с феноменом ВБС на ЭЭГ после комплекса прехирургической диагностики в ИДНЭ им. Святителя Луки было проведено хирургическое лечение (НИИ нейрохирургии им. Н.Н. Бурденко). Во всех данных случаях длительное катамнестическое наблюдение после оперативного вмешательства показало полную ремиссию приступов.
Обсуждение
Исследование продемонстрировало широкий круг форм эпилепсии и эпилептических синдромов, ассоцииро- ванных с АА. При этом каждый синдром имел оригинальные клинические, электроэнцефалографические и нейровизуализационные особенности и самое главное – прогноз. Высокий процент ремиссии наблюдался при следующих формах эпилепсии: МАЭ, синдроме Дживонса (в 100 % случаев), ИФЭ-ПГП, СПЛ (83,3 % пациентов), ФЭДСИМ-ДЭПД (77,8 %). В самых больших группах пациентов в нашем исследовании (криптогенной и симптоматической фокальных форм эпилепсии) ремиссия была достигнута только для 40,7 и 41,7 % больных соответственно. При синдроме Драве и прогрессирующих формах эпилепсии с миоклонусом ни в одном случае ремиссии достигнуто не было.
Большой нозологический спектр эпилептических синдромов с различным течением и прогнозом, многообразие других типов приступов, ассоциированных с АА, показывают, что правильная диагностика, основанная только на анамнестических и клинических данных, невозможна, что диктует необходимость в дополнительном детальном изучении электроэнцефалографических особенностей, как иктальных, так и интериктальных; проведении нейровизуализации, а в ряде случаев – и генетического обследования.
Нами установлено, что АА могут сочетаться с 16 различными типами эпилептических приступов при разных формах эпилепсии. При этом правильная трактовка семиологии всех типов приступов в клинической картине позволяет еще на ранних этапах диагностики значительно сузить диагностический поиск. В связи с этим, по нашему мнению, недопустим термин “эпилепсия с полиморфными приступами”, не позволяющий уточнить диагноз, а следовательно, и адекватно назначить АЭП.
Исследование показало, что в группе пациентов с АА преобладают криптогенные/симптоматические формы эпилепсии с феноменом ВБС на ЭЭГ. Результаты исследования подтверждают работы разных авторов, отметивших, что АА могут возникать при симптоматических фокальных формах эпилепсии в рамках псевдогенерализованных приступов с феноменом ВБС на ЭЭГ [9–12]. При этом АА сочетаются с другими псевдогенерализованными пароксизмами, фокальными моторными и вторично генерализованными судорожными приступами.
В настоящем исследовании, а также в других наших публикациях [3] показана высокая эффективность вальпроатов (Конвулекса) и сукцинимидов (этосуксимида) в отношении купирования псевдогенерализованных приступов и блокирования частых диффузных разрядов у пациентов с симптоматическими/криптогенными фокальными формами эпилепсии с феноменом ВБС на ЭЭГ.
Атипичные абсансы также нередко выявляются при эпилептических энцефалопатиях, ассоциированных с доброкачественными эпилептиформными паттернами детства и продолженной эпилептиформной активностью в фазу медленного сна. При этих формах эпилептических приступов может и не быть или они единичны в анамнезе, но постоянная продолженная эпилептиформная активность с нарастанием во сне приводит к возникновению когнитивных, психических и речевых нарушений, которые могут вызывать серьезную инвалидизацию пациентов [7]. По нашему мнению, вальпроаты (Конвулекс) и сукцинимиды (этосуксимид) при этих синдромах являются препаратами первого выбора [7]. Показана высокая эффективность сукцинимидов, в меньшей степени – вальпроатов в отношении продолженной диффузной эпилептиформной активности во сне [4, 18, 20]. Однако в виде монотерапии назначение сукцинимидов
оправданно только в случае отсутствия моторных приступов (фокальных и генерализованных). В остальных случаях этосуксимид должен назначаться добавочным препаратом к базовой терапии вальпроатами.
Ряд авторов, учитывая нередкий полиморфизм приступов при эпилептических синдромах, ассоциированных с АА, предлагают применение политерапии [15], что увеличивает риск побочных эффектов. Вместе с тем большинство экспертов в области эпилептологии настоятельно рекомендуют лечение одним препаратом, имеющим широкий спектр терапевтической эффективности. В этой ситуации основной группой АЭП являются производные вальпроевой кислоты, а одним из основных препаратов – Конвулекс. Преимущество вальпроатов обусловлено их высокой терапевтической активностью в отношении всех типов эпилептических приступов [14], как генерализовных/псевдогенерализованных, так и фокальных [5, 19]. Наше исследование, а также другие многочисленные публикации показывают, что эпилептические синдромы, ассоциированные с АА, во многих случаях резистентны к терапии АЭП [8]. Тем не менее в нашем исследовании 55,3 % больных при применении Конвулекса удалось достичь ремиссии и в 35,9 % случаев – существенного урежения частоты приступов (что выше среднего показателя ремиссии в общей группе).
С учетом терапевтической резистентности у больных СФЭ с феноменом ВБС перспективным является вопрос о возможности хирургического вмешательства. Длительное персистирование приступов и частых диффузных эпилептиформных разрядов на ЭЭГ может с течением времени приводить к нарастанию нарушений высших психических функций [7, 16]. Большинство авторов рекомендуют хирургическое лечение при абсолютной резистентности приступов к терапии АЭП [21, 25]. В нашем исследовании нейрохирургическое вмешательство, проведенное в трех случаях, привело к ремиссии резистентной эпилепсии.


