Введение
Больные с легкой черепно-мозговой травмой (ЛЧМТ) составляют около 80 % от числа госпитализированных по поводу ЧМТ лиц [1]. Главная особенность ЛЧМТ – потенциальная обратимость неврологических нарушений, однако у многих пациентов после нее возникают относительно стойкие посттравматические нарушения, сохраняющиеся на протяжение недель, месяцев и даже лет, что можно считать основным парадоксом данной патологии [1, 7]. Чаще всего страдают лица молодого
трудоспособного возраста, что превращает ЛЧМТ в значимую медицинскую и социально-экономическую проблему, поэтому выработка наиболее оптимальных подходов к лечению ЛЧТМ и
связанных с ней посттравматических расстройств является актуальной задачей современной неврологии.
Нарушения, возникающие после перенесенной ЛЧМТ, объединяются понятием “посткоммоционный синдром” и включают общую слабость, головную боль, головокружение, снижение внимания и памяти, замедленность психической деятельности, быструю утомляемость, нарушение сна, раздражительность, тревогу, депрессию, аффективную лабильность, апатию, вегетативную дисфункцию [9, 8].
В настоящее время с помощью методов функциональной нейровизуализации показано, что после ЛЧМТ в мозге длительное время сохраняются структурные и функциональные изменения, отражающие дисфункцию интегративных структур лобной и височной долей. Эти расстройства могут регрессировать в течение нескольких месяцев, хотя у некоторых могут становиться постоянными [4, 7]. В целом среди процессов, происходящих в головном мозге после травм, можно выделить первичное повреждение, разрушающее ткань мозга; вторичное повреждение, приводящее к образованию в большом количестве лактата, глутамата, свободных радикалов, интерлейкинов и повышению внутриклеточной концентрации ионов кальция, снижению содержания фосфолипидов, что нарушает работу натрий-калиевого насоса и приводит к развитию внутриклеточного отека, который усугубляет сосудистый отек, вызванный повреждением гематоэнцефалического барьера; воспалительный
ответ, усугубляющий дегенеративные нарушения; восстановление и репарацию, которые ведут к частичному восстановлению и регенерации нейронов. В ранние сроки после травмы на первичное повреждение могут наслаиваться эпизоды ишемии. Первичное повреждение мозга запускает отсроченные вторичные процессы, обусловленные рядом молекулярных механизмов. Отсроченность и обратимость вторичных повреждений предоставляют возможность терапевтического вмешательства до развития повышения внутричерепного давления и необратимых дегенеративных нарушений.
В настоящее время не существует средств, которые бы доказательно ускоряли восстановление функций при ЧМТ. Вместе с тем пациенты этой группы широко применяют ноотропные препараты (пирацетам,
фенотропил, мемантин, пиритинол, Кортексин, Церебролизин, Актовегин и др.), противоастенические средства (ацетиламиноянтарная кислота, этилтиобензимидазол, цитруллин), антидепрессанты, антагонисты кальция, β-адреноблокаторы, миорелаксанты, нестероидные противовоспалительные
средства, вальпроевую кислоту.
В связи с этим представляется возможным применение отечественного препарата Мексидол в комплексной терапии посттравматических нарушений у пациентов с ЛЧМТ. Мексидол имеет многофакторный механизм действия. Как антигипоксант этот препарат улучшает энергетический обмен клетки, активируя энергосинтезирующую функцию митохондрий, поставляет убстрат сукцинат в цикл Кребса, является прямым энергетиком, обеспечивая синтез АТФ с рациональным потреблением кислорода. Антиоксидантное действие Мексидола проявляется через ингибирование свободнорадиакального окисления, перекисного окисления липидов, снижение уровня NO, повышение активности антиоксидантных ферментов. Анксиолитический эффект препарата опосредуется влиянием на ГАМКбензодиазепиновый рецепторный комплекс, что оптимизирует фунционирование хлорного канала. Мексидол обладает также ноотропным действием, улучшая процессы обучения и памяти за счет стабилизации мембран, образования взаимосвязанных мембранных комплексов нейронов и активации синаптических процессов. Как мембранопротектор Мексидол увеличивает содержание фосфолипидов в клеточных мембранах, модулирует ионные потоки в результате уменьшения избыточного выброса возбуждающих нейротрансмиттерных аминокислот (глутамата и аспартата), вызывая торможение феномена “эсайтотоксичности” [3].
Целью исследования стало изучение эффективности препарата Мексидол в коррекции вегетативных и астенических расстройств у пациентов, перенесших ЛЧМТ.
Материал и методы
Обследованы 34 пациента (25 мужчин и 9 женщин), перенесших ЛЧМТ, сотрясение головного мозга. Возраст больных варьировался в пределах от 21 до 48 лет, средний возраст составил 35,3 года. Возрастная группа от 21 до 39 лет составила 70,6 %, от 40 до 48 лет – 29,4 %. Пациенты были поделены на 3 группы: 10 человек в составе комплексной терапии получали Мексидол по 125 мг 3 раза в сутки в течение 30 дней; препарат был назначен при первичном обращении в поликлинику в течение первых 3 дней от момента травмы (больные наблюдались амбулаторно в связи с отказом от госпитализации – 1-я группа); 12 человек получали стандартную терапию, рекомендуемую при данном
состоянии (вазоактивные препараты, ноотропы, антагонисты возбуждающих аминокислот, нейрометаболические средства), без включения Мексидола в схему лечения (2-я группа); 12 человек получали Мексидол в составе комплексной терапии с 7–8-го дня от момента травмы – после выписки из отделения нейрохирургии на дальнейшее амбулаторное лечение (3-я группа).
При проведении исследования применялись следующие методы оценкиэффективности лечения:
• Шкала оценки вегетативных расстройств, оценивающая 11 признаков вегетативной дистонии [2, 5].
• Визуальная аналоговая шкала (ВАШ) астении. Балл 0 соответствовал отсутствию утомляемости, в 10
баллов оценивалась максимальная утомляемость.
• Госпитальная шкала тревоги и депрессии (HADS) [6].
• Анкета нарушения ночного сна из 6 пунктов, оценивающая время засыпания, продолжительность сна, ночные пробуждения, сновидения, качество сна, качество пробуждения. Каждый пункт может иметь от 5 (отсутствие нарушений) до 1 (наибольшие нарушения) балла. Сумма баллов более 22 оценивается как отсутствие расстройств сна; от 22 до 18 – умеренные нарушения сна, менее 18 – выраженные нарушения сна.
• Анкета дневной сонливости Epworth.
• Шкала оценки посттравматических
нарушений при ЛЧМТ.
• Визуальная аналоговая шкала боли для оценки головной боли.
Обследование пациентов проводилось в 4 этапа: до начала терапии, на 7–8-й день лечения, на 14–16-й и на 28–30-й дни. Все пациенты помимо невролога были осмотрены окулистом, травматологом, отоларингологом, также им были выполнены краниография, ЭХО-энцефалография, электроэнцефалография (ЭЭГ). У 5 пациентов (14,7 %) был выявлен перелом костей носа без смещения, у 2 (5,9 %) – со смещением. В исследование не были включены больные с серьезными сопутствующими заболеваниями сердечно-сосудистой системы; тяжелыми ЧМТ в анамнезе; нарушениями со стороны нейро-психологической сферы и вегетативной нервной системы, выявленными до перенесенной ЧМТ; лекарственной, алкогольной или иной зависимостью; принимающие психотропные или другие психостимулирующие вещества, включая антидепрессанты, до ЧМТ.
Результаты исследования
Динамика основных проявлений посттравматических расстройств выглядела следующим образом.
Цефалгический синдром до начала лечения имел место во всех трех группах у 100 % пострадавших, причем по шкале ВАШ в первой группе средний балл равнялся 7,8, во второй – 6,8; в третьей – 7,2 балла. К 7–8-му дню терапии он сохранялся у всех пациентов, и его тяжесть по шкале ВАШ составляла в первой группе 4,2 балла, во второй – 5,2, в третьей – 4,8. На 14–16-й день лечения головная боль
сохранялась в первой группе у 2 пациентов (20 %), баллы по ВАШ – 2,0 и 1,5 соответственно; во второй группе – у 4, средний балл по ВАШ – 3,4; в третьей группе – у 3 пациентов, средний балл
по ВАШ – 2,5. На 2–30-й день лечения цефалгический синдром в первой группе сохранялся у 1 пациента по типу головной боли напряжения (1,0–1,5 балла по ВАШ), во второй – у 4 (в среднем 2,8 балла по ВАШ), в третьей – у 2 (1,5 балла по ВАШ).
Головокружение, до начала лечения имевшее место у 6 (60 %) пациентов первой группы, 7 (58,3 %) – второй и 8 (66,7 %) – третьей, через 7–8 дней сохранялось в первой группе у 3 (30 %) человек, во второй – у 5 (41,7 %) и в третьей – у 4 (33,3 %). К 14–16-му дню в первой группе головокружение было
отмечено у 1 (10 %) пациента, во второй – у 4 (33,3 %), в третьей – у 2 (16,7 %). К 28–30-му дню терапии головокружение оставалось во второй группе у 2 человек, в остальных группах не наблюдалось.
Расстройства сна после ЧМТ были отмечены в первой группе в 80 % (8 человек) случаев, во второй – у 9 (75 %) пациентов, в третьей – у 8 (66,7 %) человек. В основном они проявлялись в виде нарушений засыпания и качества сна, а также дневной сонливости. Выраженность и динамика нарушений
ночного сна представлены в табл. 1.
Таблица 1. Динамика числа больных (%) с нарушениями ночного сна по группам.
Таблица 2. Динамика числа больных (%) с дневной сонливостью.
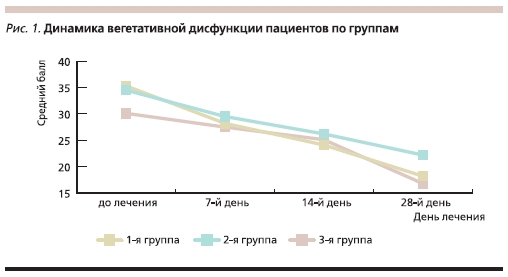
При оценке дневной сонливости отмечены главным образом умеренные и легкие нарушения. Динамика выраженности дневной сонливости представлена в табл. 2. Умеренные нарушения сна сохранялись к 28–30-му дню лечения в первой группе у 30 % пациентов, по второй – у 41,7 %, в третьей – у 25 %; выраженные нарушения сна к 28–30-му дню ни в одной из групп выявлены не были. Более значительная динамика нарушений сна имела место в первой и второй группах. При анализе вегетативной дисфункции выявлены перманентные полисистемные нарушения. Динамика вегетативной дисфункции по группам представлена в табл. 3.
Таблица 3. Динамика вегетативной дисфункции по данным опросника вегетативных изменений (в баллах).
Среди пациентов, перенесших ЧМТ, достаточно часто наблюдаются тревожно-депрессивные нарушения, что связано со стрессовой ситуацией, зачастую сопровождающей травму. Более выраженная тревога и депрессивные нарушения отмечены среди женщин: в 100 % случаев – от субклинических до легкой степени, у мужчин они имели место в 64 % случаев и в основном носили субклинический характер. В первой группе тревожно-депрессивными расстройствами страдали 60 % пациентов, во второй – 75 %, в третьей – 66,7 %; до начала лечения в первой группе средний балл по тревоге составил 7,6, по депрессии – 6,2, во второй – 7,5 и 7,2; в третьей – 6,8 и 6,3 соответственно. В целом на фоне лечения тревожно-депрессивные расстройства купировались к 28–30-му дню, но при включении в терапию Мексидола выраженная положительная динамика была отмечена уже на 14–16 день лечения. Динамика тревоги и депрессии по шкале HADS госпитальной шкалы представлена в табл. 4.
Таблица 4. Динамика тревоги и депрессии по шкале HADS.
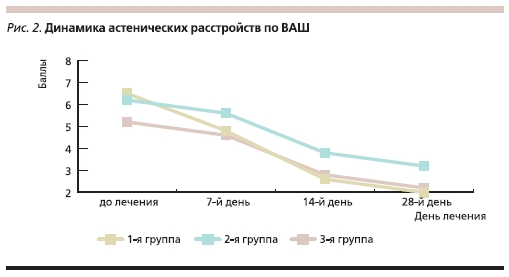
Степень выраженности астенических расстройств по ВАШ до начала лечения составила в первой группе в среднем 6,5 балла, во второй и третьей – 6,2 и 5,2 балла соответственно. Динамика астенических расстройств представлена в табл. 5.
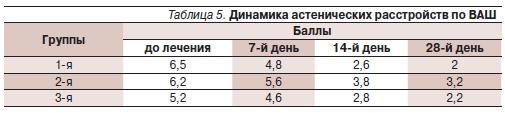
На ЭЭГ у пациентов всех групп выявлены умеренные и легкие изменения биоэлектрической активности головного мозга с ирритацией гипоталамических и мезэнцефальных структур.
Всего нетрудоспособность по ЧМТ в первой группе составила 167 дней (в среднем 16,7 дня), во второй – 220 (в среднем 18,3 дня), в третьей – 212 дней (в среднем 17,6 дня).
Обсуждение
В ходе исследования автор столкнулся со следующими сложностями: во-первых, при обследовании пациентов с ЛЧМТ оказалось достаточно сложно выделить абсолютно однородные группы пациентов, т. к. спектр симптомов и степень их выраженности у больных всех трех групп отличались значительной вариабельностью; во-вторых, на сегодняшний день нет достаточно четких алгоритмов терапии данного состояния – пациенты, перенесшие ЛЧМТ, применяют различные препараты разных фармакологических групп; в-третьих, комплексность терапии, что не позволяет в достаточной степени оценить эффективность каждого препарата в отдельности;в-четвертых, сложности разграничения эффекта применяемых препаратов со спонтанным восстановлением функции. Несмотря на это, результаты данного исследования и личный опыт автора свидетельствуют, что Мексидол обладает многофакторным механизмом действия и его применение в составе комплексной терапии посттравматических нарушений способствует улучшению результатов лечения. Вегетостабилизирующий эффект препарата позволяет значительно снижать выраженность вегетативной дисфункции уже на 7-й день терапии, к 28–30-му дню лечения наблюдается более выраженный эффект по сравнению с группой, не применявшей Мексидол в комплексной терапии
(рис. 1). При этом к 28–30-му дню лечения не выявлено выраженных различий в между 1-й и 3-й группами, отличающихся временем назначения Мексидола от момента травмы. В группах пациентов, получавших Мексидол, быстрее купировались такие симптомы, как головная боль, головокружение, при этом лучшие показатели отмечены в группе, в которой этот препарат был назначен в первые 3 дня
после травмы. На фоне применения Мексидола также отмечается меньшая выраженность астенических и тревожно-депрессивных расстройств, значительно ухудшающих общее состояние пациента и дальнейшее восстановление трудоспособности, что объясняется наличием у препарата анксиолитического эффекта (рис. 2).
В группе, не применявшей Мексидол, состоялась более поздняя нормализация цикла сон–бодрствование, тогда как в 1-й и 3-й группах число пациентов с нормальным сном значительно преобладало над числом больных, с умеренными нарушениями, уже на 14-й день лечения, во второй группе подобная динамика была выявлена только к 28-му дню лечения (табл. 2, рис. 3).
Рисунок 3. Динамика числа больных (в %) с нарушениями ночного сна.
Выводы
1. Использование Мексидола в составе комплексной терапии для коррекции посттравматических
астено-вегетативных расстройств у больных, перенесших ЛЧМТ и сотрясение головного мозга, позволило улучшить результаты лечения по сравнению с контрольной группой пациентов, не получавших Мексидол. Назначение препарата предпочтительно в более ранние сроки от момента ЧМТ. Отчетливый терапевтический эффект был получен при применении Мексидола в суточной дозе 375 мг в таблетированной форме в течение 28–30 дней в остром и промежуточном периодах ЛЧМТ. Побочных эффектов и осложнений при проведении терапии не наблюдалось ни в одной группе. Мексидол может быть использован в комплексном лечении ЛЧМТ, сотрясения головного мозга и коррекции посткоммоционного синдрома. Целесообразно дальнейшее изучение применения данного препарата в качестве монотерапии вышеуказанных состояний.
2. Необходима разработка лечебно-диагностического алгоритма для пациентов с ЛЧМТ и сотрясением
головного мозга с использованием различных нейропсихологических тестов и шкал, что позволит
повысить выявление пациентов, которым необходима коррекция посттравматических нарушений,
когнитивной функции, астении, депрессии и тревоги, улучшить прогноз в отношении дальнейшей трудоспособности указанной категории больных, а также осуществить объективный контроль за
состоянием пациентов на протяжении всего времени амбулаторного лечения.


