Хроническая боль, связанная с поражением суставов и позвоночника, – основное проявление ревматических заболеваний (РЗ) [1]. Несмотря на успехи медицинской науки, разработку новых патогенетических средств, позволяющих в существенной степени влиять на прогрессирование РЗ,
симптоматическая обезболивающая терапия не теряет своего значения как важнейший компонент противоревматической терапии.
Хроническая боль (ХБ) – не просто неприятный симптом, а самостоятельный клинический синдром,
в наибольшей степени определяющий нарушения функции и снижение социального статуса пациента. При этом от успеха обезболивания во многом зависит жизненный прогноз. Ведь боль сопровождается активной реакцией симпатоадреналовой системы, которая приводит к повышению артериального давления (АД), частоты сердечных сокращений и активации тромбоцитов. В конеч-
ном счете это определяет значительное повышение риска угрожающих жизни кардиоваскулярных осложнений [2, 3].
В настоящее время имеются четкие данные, что такие нозологические формы, как остеоартроз (ОА) и дорсалгия, не сопровождающиеся висцеральной патологией, но характеризующиеся выраженной ХБ, значительно повышают риск прогрессирования сердечно-сосудистых заболеваний. Доказательством стала работа швейцарских исследователей: E. Nüesch и соавт. сравнили частоту летальных исходов в когорте 1163 больных ОА и общей популяции при сроке наблюдения около 5 лет. Оказалось, что
риск гибели вследствие осложнений со стороны сердечно-сосудистой системы для пациентов, страдающих этим “несмертельным” заболеванием, в 1,7 раза выше. В ходе последующего анализа ученые выявили единственный фактор, который у пациентов с ОА четко ассоциировался с риском гибели, –серьезное нарушение функции суставов, препятствующее нормальному движению. Среди умерших такие нарушения отмечались в 35 % случаев, в то время как среди выживших – лишь у 17 %
(p < 0,001) [4]. Близкие результаты были представлены японскими учеными M. Tsuboi и соавт., которые
в течение 10 лет изучали динамику состояния когорты из 944 пациентов с различными РЗ. Они также выявили значительное повышение риска гибели для больных гонартрозом из-за кардиоваскулярных катастроф (отношение шансов [ОШ] = 2,32) [5].Ученые из Австралии K. Zhu и соавт. в течение 5 лет наблюдали группу из 1484 пожилых женщин (старше 70 лет), страдавших хронической болью
в нижней части спины (БНЧС). Среди них 21,7 % исходно и 26,9 % в конце периода наблюдения испытывали болевые ощущения ежедневно. В этой подгруппе риск гибели от кардиоваскулярных осложнений оказался выше более чем в 2 раза – относительный риск [ОР] = 2,13
(1,35–3,34), по сравнению с пациентками, испытывавшими боль реже [6].
Имеется еще один важный практический аспект, определяющий значение анальгетической терапии.
Пациенты в первую очередь обращаются к врачу, для того чтобы облегчить свои страдания, а уже после этого – узнать точный диагноз своей болезни. Поэтому максимально полное купирование основных симптомов следует считать наиболее действенным способом завоевания доверия пациента. Напротив, чрезмерное увлечение диагностическими мероприятиями и ”базисными” средствами в ущерб простым и эффективным методам контроля боли может вызывать негативное отношение пациента
к лечащему врачу и отвращать его от методов классической медицины [3].
Следует рассматривать удовлетворенность пациента в качестве одного из центральных критериев успеха лечения. К сожалению, добиться этого достаточно сложно. Например, в 2003 г. испанские ученые L. Arboleya и соавт. оценили мнение о результатах терапии 897 пациентов с ОА, не
менее 6 месяцев получавших анальгетики, наиболее часто – нестероидные противовоспалительные средства (НПВС) диклофенак, ацеклофенак и пироксикам. Согласно полученным результатам, почти половина (46 %) опрошенных были недовольны эффективностью принимаемых препаратов, а полностью удовлетворенным результатом обезболивающей терапии считал себя лишь 1 больной из 6 (!) [7].
Весьма наглядны данные, представленные в 2012 г. британскими исследователями M. Gore и соавт.,
которые оценили практику применения анальгетиков (парацетамола, НПВС, трамадола, “слабых” и
“сильных” опиоидов) среди пациентов с ОА и БНЧС. Оказалось, что в течение первого месяца лечения
назначенные лекарства из-за неэффективности, побочных эффектов и др. отменялись примерно 90 %
больных, от 30 до 60 % составляли случаи замены терапии, до 15 % – ее усиление (использование различных комбинаций). Таким образом, в большинстве (не менее 2/3) случаев изначально рекомендованный врачом анальгетический препарат не оправдал возложенных на него надежд [8].
Развитие боли является сложным, многокомпонентным патологическим процессом, что определяет
значительные трудности при индивидуальном подборе схемы обезболивающей терапии. Поэтому лечение каким-либо одним лекарством (даже наиболее “сильным”) далеко не всегда обеспечивает существенное облегчение страданий. Примером сложного патогенеза ХБ при РЗ является ОА – заболевание, которое является одной из наиболее частых причин стойких страданий и инвалидизации
в современном обществе.
Главной ”мишенью” болезни при ОА считается суставной хрящ, в обычном состоянии не имеющий
собственных болевых рецепторов. Поэтому появление боли определяется другими механизмами – повышением внутрикостного давления и микропереломами субхондральной кости, сдавлением остеофитами нервных окончаний, спазмом периартикулярных мышц, нарушениями микроциркуляции [3, 9]. При этом даже в отсутствие явных клинических признаков синовита при ОА присутствует субклиническое суставное воспаление, которое сопровождается выбросом цитокинов (интерлейкина-1 – ИЛ-1, ИЛ-6, фактора некроза опухоли – ФНО), медиаторов боли и воспаления (простагландина Е2,
субстанции Р). Прогрессирование ОА неизбежно сопровождают биомеханические расстройства, которые приводят к растяжению и травматизации связочного аппарата и околосуставных структур (околосуставных сумок, синовиальных влагалищ мышц), с последующим развитием воспаления в области прикрепления связок (энтезопатия), бурситов, тендинитов и тендовагинитов [3, 9].
Важным элементом патогенеза ХБ становятся нарушения в нейроэмоциональной сфере, такие как депрессия и тревожность. Длительное и непрерывное возбуждение ноцицепторов способно вызывать стойкие изменения в периферической и центральной нервной системе. Их обусловливают механизмы, хорошо известные в качестве ведущих звеньев патогенеза синдрома ХБ, – феномен центральной сенситизации, “истощение” антиноцицептивной системы, формирование деструктивной поведенческой реакции. Поэтому 20–30 % пациентов с ОА отмечают “невропатическую окраску” боли (жжение, зуд, онемение, покалывание, “удары током”) [3].
Лечение ХБ складывается из последовательного подавление основных элементов ее патогенеза. Первым шагом является быстрое и максимально полное купирование острой боли. Ведь именно неэффективное лечение на этом этапе создает предпосылки к последующей хронизации боли и превращению ее из защитного механизма в самостоятельный, угрожающий здоровью и жизни пациентов синдром [3]. Основная роль в купировании ноцицептивной боли принадлежит, без всяких сомнений, НПВС. Главным преимуществом этих препаратов перед другими анальгетиками является сочетание обезболивающего и противовоспалительного эффектов. Появление боли (повышение чувствительности и стимуляция периферических болевых рецепторов), как и развитие воспаления, тесно связаны с продукцией провоспалительных медиаторов, центральное место среди которых занимают простагландины (ПГ). Резкое нарастание концентрации ПГ в области тканевого повреждения происходит благодаря активности фермента циклооксигеназы-2 (ЦОГ-2), ответственного за синтез их предшественника – ПГН2. Именно этот процесс является основной фармакологической “мишенью” НПВС, которые по своей природе являются селективными или неселективными ингибиторами ЦОГ-2 [1–3].
Нужно заметить, что эффект НПВС не ограничивается снижением активности периферических
болевых рецепторов. Большое значение для развития анальгетического действия НПВС может иметь их влияние на центральные механизмы формирования болевых ощущений. Прохождение мощного афферентного болевого импульса и стойкая активация нейронов, расположенных в задних рогах спинного мозга, вызывают реакцию со стороны глиальных клеток, сопровождающуюся выбросом провоспалительных субстанций, прежде всего ПГЕ2. С этим фактом связан феномен “взвинчивания” – нарастающее повышение чувствительности спинальных нейронов, один из основных механизмов
формирования ХБ. Синтез ПГЕ2 в центральной нервной системе (ЦНС) является ЦОГ-2-зависимым процессом и, следовательно, подавляется НПВС [3].
Имеются веские данные, что НПВС (в частности, широко используемый в России нимесулид) способны достаточно легко проникать в ткань ЦНС [10–12]. Как показали исследования на здоровых добровольцах, концентрация НПВС в ликворе после перорального приема или парентерального введения близка соответствующей концентрации в плазме и вполне достаточна для развития фармакологического эффекта, связанного с подавлением активности ЦОГ-2 [13].
Выбор НПВС всегда непрост: идеального препарата не существует. Нужное лекарство подбирается индивидуально для конкретного пациента и конкретной клинической задачи. Тем не менее существуют определенные критерии оценки того или иного препарата – наличие быстрого анальгетического и противовоспалительного действия, благоприятная переносимость и низкий риск серьезных осложнений. Немаловажно, чтобы препарат был недорогим и его можно было назначать широкому кругу пациентов, в т. ч. людям с невысоким доходом (пенсионерам, инвалидам) [14].
Такими качествами обладает один из наиболее востребованных в нашей стране препаратов группы НПВС – нимесулид. О его популярности в России можно судить по объему продаж: с 2006 по 2010 г. они выросли с 7 до 18 млн упаковок в год. Сегодня по уровню использования нимесулид уступает лишь диклофенаку и ибупрофену [15]. Достоинства этого препарата отмечают многие эксперты, как российские, так и зарубежные. В 2010 г. был опубликован обзор итальянских ученых C. Mattia и
соавт., посвященный 25-летию начала применения нимесулида в Италии. Авторы отмечают преобладание положительных качеств этого лекарства (эффективность, быстродействие, преимущественная селективность в отношении ЦОГ-2, существенно повышающая его желудочно-кишечную переносимость) над его недостатками [16].
Нимесулид – мощный инструмент в борьбе с острой болью. Он имеет высокую биодоступность;
уже через 30 минут после перорального приема в крови достигается его значимая концентрация, составляющая не менее 25 % от максимальной. Полный обезболивающий и противовоспалительный эффект нимесулида отмечается через 1–3 часа после приема [17–19].
Основные фармакологические эффекты НПВС определяются блокадой ЦОГ-2, а осложнения со стороны
желудочно-кишечного тракта (ЖКТ) в бóльшей степени связаны с подавлением активности ЦОГ-1 в слизистой оболочке ЖКТ. Однако ЦОГ-1 также принимает участие в развитии воспаления, и поэтому локальное снижение ее активности в области повреждения следует рассматривать как положительный фактор. Таким действием обладает нимесулид – он лишь в небольшой степени влияет на “структурную” ЦОГ-1 слизистой оболочки желудка, но существенно снижает эффекты этого фермента в области воспаления [1–19].
По данным лабораторных исследований, нимесулид демонстрирует ряд фармакологических эффектов, не зависимых от класс-специфического действия на ЦОГ-2. Он способен снижать продукцию провоспалительных цитокинов (ИЛ-6, ФНО-α) и подавлять активность металлопротеиназ (ответственных, в частности, за разрушение гликопротеинового комплекса хрящевой ткани при ОА),
обладает антигистаминным действием. Необходимо отметить также способность нимесулида блокировать фермент фосфодиэстеразу IV, тем самым снижая активность макрофагов и нейтрофилов, играющих ключевую роль в патогенезе острой воспалительной реакции [17–19].
Успешное применение нимесулида в качестве анальгетика доказано во многих клинических исследованиях. Наверное, нет такой области медицины, в которой этот препарат не прошел бы серьезной апробации. Он доказал свою эффективность при различных заболеваниях ревматической природы: ОА, ревматоидном артрите, анкилозирующем спондилоартрите, псориатическом артрите,
подагре, ревматическом воспалении околосуставных мягких тканей (энтезитах, бурситах и тендинитах), а также дорсалгии [16–19].
Одним из лучших качеств нимесулида является хорошая переносимость со стороны ЖКТ. Ведь именно
развитие класс-специфической патологии пищеварительной системы является одним из главных параметров, определяющих для НПВС соотношение риска и пользы.
Среди работ, в которых оценивалась безопасность применения нимесулида, следует выделить исследование ирландского ученого F. Bradbury. Он сравнил частоту ЖКТ-осложнений при использовании диклофенака (n = 3553), нимесулида (n = 3807) и ибупрофена (n = 1470), в реальной клинической практике. Общая частота этой патологии на фоне приема нимесулида была значительно ниже по сравнению с диклофенаком – 12,1 %, но не отличалась от таковой ибупрофена – 8,1 и 8,6 % соответственно [20].
Относительно низкий риск ЖКТ-осложнений при использовании нимесулида был также показан в
работе итальянского эпидемиолога A. Conforti и соавт., которые провели анализ 10 608 спонтанных сообщений о серьезных побочных эффектах (1988–2000), связанных с приемом различных НПВС. Нимесулид становился причиной развития тех или иных осложнений со стороны ЖКТ в 2 раза реже по сравнению с другими НПВС. Число спонтанных сообщений о проблемах, связанных с этим
препаратом, составило лишь 10,4 % от их общего числа. Отличие от других популярных НПВС было очевидным: доля сообщений о проблемах при применении диклофенака достигла 21,2 %, кетопрофена 21,7 %, пироксикама – 18,6 % [21].
В эпидемиологическом исследовании J. Laporte и соавт. изучали ОР ЖКТ-кровотечений при использовании различных НПВС. Материал составили 2813 эпизодов этого осложнения и 7193 пациентов в качестве контроля. Согласно проведенному анализу, нимесулид оказался менее опасным, чем многие другие НПВС, популярные в Европе, – ОР кровотечения для нимесулида составил 3,2, для диклофенака – 3,7, мелоксикама – 5,7, а рофекоксиба – 7,2 [22].
Риск развития кардиоваскулярных катастроф при использовании нимесулида, по всей видимости, оценивался лишь в одной крупной работе, проведенной финскими учеными. В ходе этого масштабного исследования было проанализировано 33 309 эпизодов инфаркта миокарда, при этом группу контроля, сопоставимую по полу и возрасту, составили 138 949 лиц. Согласно полученным результатам, ОР инфаркта для нимесулида составил 1,69. Это значение было близким соответствующему показателю, определенному для мелоксикама, набуметона, этодолака и других неселективных НПВС (н-НВПС)
[23].
За последние 15 лет в России накоплен собственный и весьма серьезный опыт применения нимесулида. В 2011 г. мы провели обзор отечественных клинических исследований, в которых определялись сравнительная эффективность и риск осложнений при использовании этого препарата. С 1995 по 2009 г. в нашей стране было проведено 21 испытание (n = 1590), в котором нимесулид назначали в
дозах от 200 до 400 мг/сут на срок от 7 дней до 12 месяцев. Причем помимо пациентов с РЗ здесь были и другие – с острыми травмами, после стоматологических операций и страдающие урологической патологией. Активным контролем являлись лица (n = 526), которые получали другие НПВС (в основном диклофенак), парацетамол, трамадол и гомеопатический препарат артрофоон [24]. По результатам проведенного анализа, нимесулид превосходил или по крайней мере не уступал препаратам сравнения. Число больных, отметивших улучшение > 50 %, оказалось не менее 40–50 % от общего числа опрошенных.
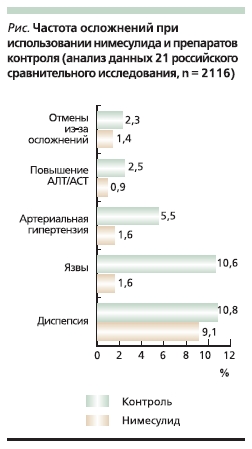
Переносимость нимесулида может также быть оценена как хорошая (см. рисунок). Так, доля пациентов с диспепсией при использовании нимесулида составила 9,1 %, препаратов сравнения – 10, 8 %; язвы ЖКТ развились у 1,6 и 10,6 % соответственно (p < 0,001); повышение АД – у 1,6 и 5,5 % (p < 0,001); повышение уровня аланинаминотрансферазы (АЛТ) – у 0,9 и 2,5 % (p < 0,05); потребовалась отмена в 1,4 и 2,5 % случаев (p < 0,05). Отеки и кожные аллергические реакции отмечались в единичных случаях [24]. Можно сказать, что переносимость нимесулида не была идеальной (побочные эффекты все же возника-
ли), но она была однозначно лучше, чем у диклофенака, который наиболее часто применяли в качестве препарата активного контроля.
В 2009 г. мы провели ретроспективный анализ частоты осложнений со стороны ЖКТ, кардиоваскуляр-
ной системы и печени 322 больных РЗ, находившихся на стационарном лечении в клинике НИИР
РАМН в 2007–2008 гг. и не менее 12 месяцев до поступления принимавших нимесулид в дозе 200 мг/
сут. Всем пациентам была выполнена гастроскопия, оценивалась динамика АД и биохимических показателей крови (с особым вниманием к показателям функции печени) [25]. Опасная патология ЖКТ – кровотечение или перфорация язвы, не развились ни у одного из этих больных. Язвы желудка и двенадцатиперстной кишки были обнаружены у 13,3 % обследованных пациентов. Это было примерно на треть меньше, чем число язв, возникающих на фоне приема н-НПВС. Так, по данным более раннего исследования (всего был обследован 4931 больной, получавший н-НПВС, преимущественно диклофенак), у 18,1 % из них были обнаружены язвы верхних отделов ЖКТ [26].
Хотя у многих больных присутствовал серьезный коморбидный фон по заболеваниям сердечно-сосудистой системы, за 12-месячный период приема нимесулида инфаркт миокарда был зафиксирован лишь у 1 больного – страдавшего РА мужчины в возрасте 68 лет, у которого в течение многих лет наблюдали ишемическую болезнь сердца и артериальную гипертензию. Еще у двух пациенток на фоне приема нимесулида была отмечена отрицательная динамика электрокардиограммы, описанная кардиологом как “постинфарктный кардиосклероз”. Стойкое повышение АД в период госпитализации было отмечено у 11,5 % больных. Среди лиц, исходно имевших эту патологию, частота дестабилизации артериальной гипертензии была существенно выше, чем в целом по группе, и
составила 26,8 %.
Не было ни одного случая развития клинически выраженной патологии печени – желтухи, гепатомегалии, симптомов печеночной недостаточности. Существенное повышение уровня
печеночных ферментов (более чем в 2 раза по сравнению с нормой) возникло лишь у 7 (2,2 %) больных. Эти пациенты страдали РА и помимо нимесулида получали потенциально гепатотоксические препараты – метотрексат и лефлуномид [26].
Как видно, нимесулид является действенным инструментом контроля боли; его рациональное использо-
вание позволяет существенно облегчать страдания пациентов. Расчет возможного риска осложнений и применение эффективных методов профилактики позволяют снижать вероятность побочных эффектов до минимума.
Но, как было указано выше, назначение НПВС – лишь первый шаг в подборе индивидуальной схемы обезболивания. К сожалению, монотерапия НПВС обеспечивает значимое улучшение далеко не всем больным. И этот факт заставляет искать дополнительные средства, которые в комбинации с НПВС позволили бы добиться более высокого уровня анальгезии [27].
Удачной комбинацией анальгетиков является сочетание НПВС и парацетамола [3], который сам по
себе достаточно слабый анальгетик, однако его сочетание с другими обезболивающими препаратами существенно повышает эффективность лечения. Подтверждением является работа C. Ong и соавт., представляющая собой мета-анализ 21 рандомизированного клинического исследования – РКИ (n = 1909), в котором оценивалось обезболивающее действие различных НПВС в виде монотерапии и в комбинации с парацетамолом. Согласно проведенной оценке, уменьшение интенсивности боли
и снижение потребности в дополнительных анальгетиках при совместном применении этих лекарств оказались более чем на 30 % больше, чем при монотерапии парацетамолом или НПВС [28].
Традиционно наиболее мощными обезболивающими средствами считаются опиодные анальгетики.
Однако монотерапия этими препаратами, как показывает опыт большого числа клинических исследований, не позволяет полностью контролировать боль при мышечно-скелетных заболеваниях. По своей эффективности опиоиды не превосходят НПВС и при этом достаточно часто вызывают неприятные побочные эффекты (головокружение, нарушение сна, тошноту и др.) [29, 30]. Поэтому опиоиды следует рассматривать как средство “второй линии” и использовать в случае неэффективности НПВС или невозможности их применения из-за высокого риска кардиоваскулярных осложнений [31].
Гораздо перспективнее в плане повышения эффективности анальгезии совместное использование
НПВС и опиоидных анальгетиков, в частности единственного реально доступного в России препарата из этой лекарственной группы трамадола. Подтверждением успеха такой комбинации может служить масштабное исследование R. Emkey и соавт., которые оценивали эффективность комбинированной терапии с-НПВС и коммерческого препарата трамадол 37,5 мг/парацетамол 325 мг.
Исследуемая группа была представлена 306 больными ОА, регулярно принимавшими целекоксиб (> 200
мг) или рофекоксиб (> 25 мг), тем не менее страдавшими от сохранявшейся интенсивной боли в суставах, оцененной > 50 мм по визуальной аналоговой шкале. Согласно плану исследования, на фоне продолжения приема НПВС, половина больных дополнительно получали препарат трамадол/парацетамол от 4 до 8 таблеток в сутки, а половина – плацебо. Активная терапия позволила добиться значимого успеха по многим параметрам, таким как суммарное облегчение боли, функциональный статус (по WOMAC – Western Ontario and McMaster Universities Arthritis Index)
и SF-36 (Short Form-36). Так, среднее значение боли на фоне комбинированной терапии снизилось до 41,5 мм, а на фоне монотерапии НПВС – до 48,3 (различие небольшое, но статистически значимое, р = 0,025) [32].
Очень интересным компонентом при комплексном обезболивающем лечении РЗ считаются миорелаксанты [33]. Сами по себе эти препараты, как показывает опыт ряда клинических исследований, так же как центральные анальгетики неопиоидной природы и нейромодуляторы, при РЗ
довольно малоэффективны [34–36]. Однако их совместное применение с НПВС может существенно повышать лечебный потенциал последних.
Единственным заболеванием из круга ревматологической патологии, при котором эффективность миорелаксантов четко определена, является люмбалгия. Это подтверждает мета-анализ M. van Tulder и соавт., оценивших результаты 30 РКИ, в которых сравнивалась эффективность различных препаратов данной лекарственной группы при БНЧС. Согласно полученным данным, небензодиазипиновые миорелаксанты при кратковременном применении достоверно снижали выраженность боли и улучшали общее самочувствие по сравнению с плацебо: ОР 0,8 и 0,49 соответственно. Правда, риск развития побочных эффектов был выше в 1,5 раза (а в отношении побочных эффектов со стороны ЦНС – в 2,04) [37]. Ярким представителем этой лекарственной группы является тизанидин. Серия хорошо организованных исследований показала, что комбинация этого препарата и НПВС более эффективна в отношении купирования острой БНЧС, чем монотерапия НПВС.
Британские ученые H. Berry и D. Hutchinson провели два многоцентровых РКИ, в которых изучался
этот вопрос. Первое из них представляет 7-дневное сравнение лечебного действия тизанидина в дозе 4 мг 3 раза в сутки и плацебо (n = 112), причем больные в качестве дополнительного анальгетика могли принимать аспирин в дозе 300 мг “по требованию”. Положительный эффект терапии был отмечен в обеих группах, однако на фоне приема тизанидина облечение наступало быстрее; имелось преимущество и еще по ряду параметров – таких, как уменьшение боли в покое и ночью. Во втором
РКИ (n = 105) сравнивали действие ибупрофена 1200 мг/сут в комбинации с тизанидином 12 мг/сут и
монотерапии ибупрофеном 1200 мг/сут. Комбинированная терапия оказалась достоверно эффективнее. При этом число осложнений со стороны ЖКТ было значительно выше в контрольной группе: 20 и 6 % соответственно (р = 0,02), хотя число больных, у которых возникли побочные эффекты со стороны ЦНС, было достоверно выше в группе комбинированной терапии (р = 0,025) [38, 39].
Вероятно, самым большим исследованием эффективности комбинации тизанидина и НПВС при
острой БНЧС является работа ученых 6 азиатских стран, представляющая собой 8-дневное
многоцентровое РКИ (n = 361). В его ходе пациенты принимали диклофенак 50 мг и тизанидин 2 мг 2 раза/сут или только диклофенак 50 мг 2 раза/сут. Комбинированная терапия была однозначно более действенной – так, боль в покое (оценивалась по шкале от 0 до 3 баллов) снизилась к 8-му дню с 1,98 до 0,53 в основной группе, и с 1,87 до 0,92 в контрольной (р < 0,05). При этом побочные эффекты со стороны ЖКТ были отмечены у 12 и 32 % больных (p < 0,001), а ЦНС – 18 и 10 % (р < 0,05) соответственно [40].
В 2009 г. индийские ученые A. Pareek, и соавт. опубликовали данные 7-дневного исследования, в
котором сравнивали лечебное действие комбинации ацеклофенака 100 мг и тизанидина 2 мг 2 раза/
сут и монотерапии ацеклофенаком 100 мг 2 раза/сут пациентов с острой БНЧС (n = 197). Как и в предыдущих работах, комбинированная терапия продемонстрировала очевидное преимущество, обеспечив более выраженное и быстрое уменьшение болевого синдрома. Серьезных осложнений, потребовавших отмены терапии, не было отмечено в обеих группах [41].
В заключение можно сказать, что врач, занимающийся лечением пациентов с РЗ, располагает сегодня действенными и разнообразными инструментами контроля острой и хронической боли (см. таблицу).
Таблица. Благоприятные сочетания анальгетиков (уровень доказательности А).
В качестве средства первой линии следует рассматривать НПВС, сочетающие анальгетический, противовоспалительный и жаропонижающий
эффекты. Среди них преимущество имеют препараты с хорошей переносимостью, такие как нимесулид. Усилить анальгетический эффект НПВС можно при сочетании их с трамадолом и парацетамолом. Если в патогенезе острой и хронической боли очевидную роль играет клинически выраженный мышечный спазм, это является показанием к применению миорелаксантов (например,
тизанидина), обладающих собственным анальгетическим эффектом и способных усиливать обезболивающее действие других анальгетиков.



