Успешное лечение онкологических заболеваний – одна из наиболее острых и актуальных медико-социальных проблем. Так, в 2010 г. в РФ выявлено 516 874 случая злокачественных новообразований, а
показатель заболеваемости на 100 тыс. населения России составил 364,2, что на 2,4 % выше уровня 2009 г. и на 17,8 % выше уровня 2000 г. [1].
В настоящее время приоритетными задачами фундаментальной и клинической медицины являются поиск и разработка новых подходов и усовершенствование традиционных способов терапии для увеличения эффективности лечения злокачественных новообразований. Методы борьбы с онкологическими заболеваниями на сегодняшний день основаны на трех основных способах лечения – хирургическом вмешательстве, радио- и химиотерапии (ХТ). Последняя занимает одно из центральных мест в лечении опухолевых заболеваний. В настоящее время выделяют следующие виды ХТ: адъювантную, неоадъювантную, индукционную и лечебную. Адъювантная (“дополнительная”) ХТ направлена на скрытые метастазы, которые могут иметь место, и проводится сразу после хирургического вмешательства во избежание рецидива. Неоадъювантная ХТ — аналог адъювантной, но осуществляется перед оперативным лечением, позволяя уменьшать опухоль до размеров, когда можно выполнять органосохраняющую операцию и выяснять чувствительность опухоли к ХТ. Индукционная ХТ назначается при неоперабельном процессе с целью приведения его к операбельному состоянию. Лечебная ХТ проводится при наличии опухолевого очага [2, 3].
Классификации противоопухолевых средств (ПОС) носят условный характер, поскольку многие препараты, объединенные в одну группу, имеют уникальные механизмы действия и эффективны в отношении совершенно разных нозологических форм злокачественных новообразований (более
того, многие авторы относят одни и те же препараты к разным группам). Тем не менее эти классификации представляют определенный практический интерес – минимум в качестве упорядоченного перечня препаратов. Так, согласно анатомо-терапевтическохимической (АТХ) классификации лекарственных средств [4], выделяют следующие группы ПОС: алкилирующие агенты, антиметаболиты, противоопухолевые антибиотитики, алкалоиды растительного происхождения и
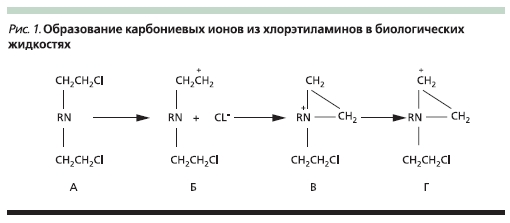
проч. К алкилирующим агентам относятся сарколизин, циклофосфамид, хлорамбуцил, новоэмбихин. Действие алкилирующих агентов, схематично представленное на рис. 1 на примере хлорэтиламинов (А), основано на том, что в растворах и биологических жидкостях они отщепляют ионы хлора с
образованием электрофильного карбониевого иона (Б), который переходит в этиленимоний (В). Последний также образует функционально активный карбониевый ион (Г), взаимодействующий с нуклеофильными структурами ДНК (гуанин, фосфатные группы и др.) [5].
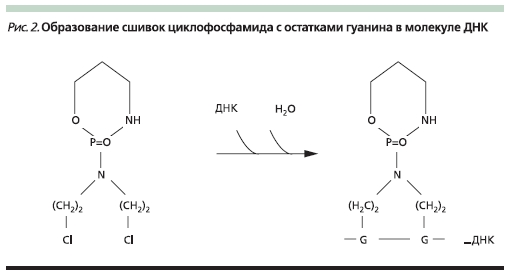
Взаимодействие алкилирующих веществ с ДНК (рис. 2), в т. ч. поперечное связывание молекул ДНК, нарушает ее стабильность, вязкость и впоследствии целостность. Все это приводит к резкому угнетению жизнедеятельности клеток, их способность к делению подавляется, и многие из них гибнут.
Алкилирующие вещества действуют на клетки в интерфазе. Особенно выражено их цитостатическое действие в отношении быстропролиферирующих клеток.
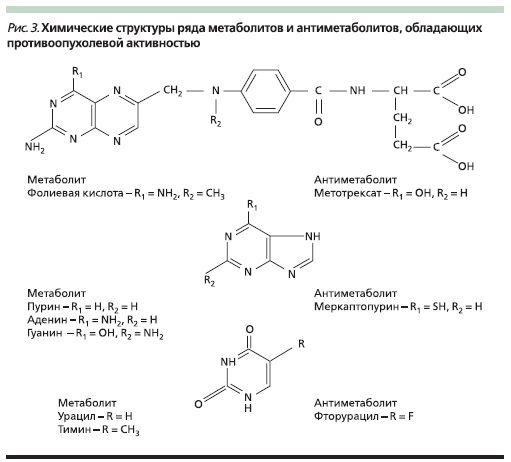
Антиметаболиты, являясь антагонистами естественных метаболитов (рис. 3), вмешиваются в синтез ДНК и РНК, что также приводит к угнетению деления клеток и их гибели. Действие проявляется на разных этапах синтеза нуклеиновых кислот и зависит от того, антагонистом какого метаболита является данный препарат. Например, метотрексат – антагонист фолиевой кислоты, нарушает образование пуринов и тимидина. Меркаптопурин и тиогуанин угнетают включение пуринов в полинуклеотиды; фторурацил, тегафур и цитарабин являются антагонистами пиримидина, нарушают синтез нуклеотидов и их включение в ДНК [6].
Антибиотики антрациклинового ряда, к которым относятся доксорубицин, даунорубицин, идарубицин,
митоксантрон, оказывают многоплановое действие на структуру и синтез ДНК: инициируют частичное расщепление двойной спирали, способствуют образованию одно- и двухцепочечных разрывов. Кроме того, они генерируют свободные радикалы, которые увеличивают число разрывов в молекуле ДНК.
К алкалоидам растительного происхождения относятся винка-алкалоиды, выделяемые из барвинка розового (Vinca rosea); алкалоиды тисового дерева (Taxus brevifolia) – таксаны (доцетаксел, паклитаксел); подофиллотоксины (этопозид, тенипозид), выделяемые из подофилла щитовидного (Podophyllum peltatum). Цитостатический эффект винка-алкалоидов обусловлен деполимеризацией тубулина – белка, входящего в состав микротрубочек веретена митотического деления. Процесс
клеточного деления останавливается в фазе митоза. Небольшие дозы винкаалкалоидов могут вызывать обратимую остановку митозов с последующим восстановлением клеточного цикла. Это наблюдение обусловило многочисленные попытки интеграции цитостатиков этой группы в схемы ХТ с целью “синхронизации” клеточного цикла. Таксаны также воздействуют на механизм образования микротрубочек, но несколько иначе – эти препараты способствуют полимеризации тубулина, вызывая образование дефектных микротрубочек и необратимую остановку клеточного деления. Подофиллотоксины воздействуют на клеточное деление посредством ингибирования топоизомеразы II – фермента, ответственного за изменение формы (“раскручивание” и “скручивание”) спирали ДНК, происходящее в процессе репликации. Следствием такого ингибирования является блокирование клеточного цикла в фазе G2, т. е. торможение их вступления в митоз [7].
Успешность лечения онкозаболеваний с помощью ХТ связана с чувствительностью опухолевых клеток
к ПОС. Результат лечения отражает компромисс между эффективностью в отношении опухоли и токсичностью для здоровых тканей. Одним из лимитирующих моментов в лекарственном лечении злокачественных новообразований является привыкание опухолевых клеток к ПОС. Процесс привыкания можно до определенной степени замедлять путем комбинированного применения препаратов с разной структурой и различным механизмом действия. Существенным недостатком
большинства современных ПОС является также малая избирательность действия в отношении опухолевых клеток. Обычно применение цитотоксических средств сопровождается серьезными
побочными токсическими эффектами. При этом особенно сильно страдают активно пролиферирующие ткани (костный мозг, слизистая оболочка кишечника). Ряд противоопухолевых антибиотиков (доксорубицин, даунорубицин) обладает кардиотоксическим эффектом. У препаратов платины
выражено нефротоксическое действие. Практически всегда проведение ХТ сопровождается тошнотой, рвотой, потерей аппетита, алопецией. Одной из характерных особенностей многих ПОС является их иммуносупрессивное действие, сопровождающееся развитием инфекционных осложнений.
Все эти эффекты обусловлены малой избирательностью цитотоксических средств в отношении опухолевых клеток. Увеличение же дозировки ПОС не только сопровождается развитием побочных эффектов, но и зачастую представляет опасность для жизни пациента [6].
В последние десятилетия активно разрабатываются новые способы противоопухолевой терапии. Одной из перспективных разработок в этой области являются транспортные системы селективной доставки лекарственных веществ (ЛВ). В качестве носителей широко используются полимерные
соединения, способные изменять фармакокинетику ЛВ, увеличивая время циркулирования в крови благодаря высоким значениям молекулярной массы (ММ) и за счет этого усиливая процесс захвата (эндоцитоз) полимерных производных опухолевыми клетками. Кроме того, многие первичные
и метастатические опухоли имеют прерывистую и высокопроницаемую систему сосудов, что также определяет повышенный уровень поглощения ЛВ на полимерных носителях в опухолевых тканях [8, 9].
Наиболее распространенными полимерами для доставки лекарственных средств являются поли(мет)акриловая кислота, поли(мет)акриламид, поливиниловый спирт, поливинилпирролидон, поли-N-(2-гидроксипропил)(мет) акриламид, полиэтиленимин, полиэтиленгликоль, полиаминокислоты
(поли-L-лизин, поли- L-глутаминовая кислота, полиаспартамид), полиамиды, полиэфиры, полилактиды.
Полимеры-носители должны удовлетворять ряду требований: хорошо растворяться в воде и иметь ММ не выше 40000, т. к. вещества с более высокой ММ не фильтруются почками и оседают в ретикуло-эндотелиальной системе, накапливаясь в организме и вызывая токсические эффекты. С другой
стороны, чем выше ММ полимера, тем выше его способность к эндоцитозу клетками. Полимер также не должен взаимодействовать с кровью, вызывать токсические эффекты и быть антигенным. Для обеспечения оптимальных фармакокинетических параметров полимер-носитель должен иметь узкое
молекулярно-массовое распределение и высокую степень композиционной однородности [10, 11]. Кроме того, полимеры обладают собственной физиологической активностью. Под этим термином обычно понимают активность, связанную с полимерным состоянием и не свойственную низкомолекулярным аналогам. Механизмы проявления собственной физиологической активности полимеров могут быть обусловлены физическими эффектами, связанными с большой ММ, осмотическим давлением, конформационными перестройками и др., или определяются межмолекулярными взаимодействиями с биополимерами организма. По структуре полимеры, используемые для транспортной доставки ЛВ, можно разделить на следующие группы: нейтральные полимеры, поликатионы и полианионы.
Нейтральные полимеры не обладают специфической активностью в отношении конкретных структур организма. Важным свойством таких полимеров является незначительное взаимодействие с клеточными мембранами и биополимерами. Это наиболее хорошо изученная группа полимеров, используемых в медицине. К ним относятся поливинилпирролидон (Неогемодез, Повидон), декстран (Полиглюкин,
Реополиглюкин) и поливиниловый спирт.
Физиологическая активность поликатионов связана главным образом с их полиэлектролитной природой. Многие биополимеры организма являются полианионами (белки, нуклеиновые кислоты), биомембраны также имеют суммарный отрицательный заряд. Поликатионы активно взаимодействую с биополимерами с образованием полиэлектролитных комплексов и сильно связываются поверхностью
клеток. Поликатионы могут вызывать фазовые переходы в липидах, образовывать сшивки областей клеточных мембран. Значительная сорбция поликатионов на клеточных мембранах, отличающая этот класс полимеров,
зависит от величины отрицательного заряда мембран. Поэтому поликатионы селективно взаимодействуют с опухолевыми клетками, имеющими больший отрицательный заряд по сравнению с нормальными клетками. К поликатионам относятся поли(мет) акриламиды, полимеры аминокислот
(поли-L-лизин). Биологическая активность поликатионов весьма разнообразна. Отмечены противоопухолевое, противовирусное, иммуномодулирующее, интерфероногенное и другие виды действия. Для практических целей наиболее существенно ингибирующее действие поликатионов на
митоз, поэтому их можно рассматривать как потенциальные противоопухолевые средства.
Использование полианионов в качестве лекарственных средств сдерживается их высокой токсичностью. Такие эффекты, как развитие анемии, индукция лейкоцитоза и сенсибилизация организма к эндотоксинам, обычны для большинства полианионов. Их токсичность можно понижать применением узких фракций с низкой ММ. Важнейшим эффектом при взаимодействии полианионов с клетками является кратковременное местное повышение проницаемости их мембран. Это связано с тем, что отрицательно заряженные в целом клеточные мембраны имеют изолированные поликатионные области, на которых и сорбируются полианионы. В результате в липидном бислое образуются дефекты, повышающие проницаемость мембраны. Образование дефектов в клеточных мембранах представляет собой второй (наряду с эндоцитозом) специфический для полиэлектролитов
механизм проникновения полимеров в клетку.
Для транспортной доставки ПОС используют такие методы, как:
1) формирование полимерных наногелей, способных обратимо реагировать на небольшие внешние
воздействия (температура, ионная сила, рН, электрическое поле и др.), а также включать в свой объем и контролируемо высвобождать действующие ЛВ [12];
2) получение мицелл амфифильных полимеров, в ядро которых заключается ЛВ [13–24], которое затем
высвобождается в зависимости от условий внутри клетки;
3) химическая прививка ЛВ к полимеру-носителю с образованием физиологически активного полимера [25–35], высвобождающего ЛВ при гидролизе.
Системы мицеллярного типа позволяют включать в ядро мицеллы, образуемой полимером при концентрации выше критической концентрации мицеллобразования, гидрофобные ЛВ (доксорубицин, фторурацил, паклитаксел и др.), как схематично представлено на рис. 4.
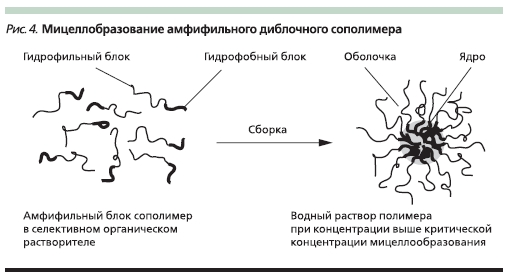
Положительной стороной использования этого метода является отсутствие химической модификации ЛВ. Действующее вещество высвобождается при разрушении мицеллы в результате изменения температуры и рН окружающей среды, которое в кровяном русле составляет в среднем 7,4, а во внутриклеточном пространстве, куда полимерная система попадает в результате эндоцитоза,
равно 5,5–6,0 (в эндосомах) и 4,5–5,0 (в лизосомах).
Полимерные системы прививочного типа представлены классической моделью Рингсдорфа (рис. 5), суть которой состоит в том, что ее составные части объединены в единое целое посредством химических связей [36].
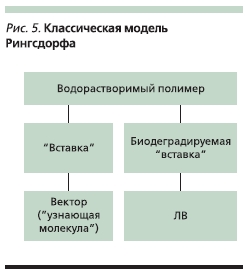
Полимер определяет в основном физико-химические характеристики системы. ЛВ присоединяется к
полимеру-носителю либо непосредственно, либо через “вставку” (спейсер, линкер). Конструкция блока, связывающего ЛВ с полимером-носителем, имеет решающее значение для реализации предполагаемого механизма действия. Спейсер между полимером и действующим веществом может иметь различную гидролитическую устойчивость, в т. ч. к воздействию ферментов in vivo, и следовательно, различную структуру. Поскольку во внутриклеточном пространстве среда кислая, а в
кровяном русле слабощелочная, связь между ЛВ и полимером-носителем олжна быть устойчивой в щелочной среде и гидролизоваться в кислой. Это, например, гидразоновая связь, образуемая между гидразидным производным полимера-носителя и ЛВ (доксорубицином). Для соединения противоопухолевого вещества с полимеромносителем широко применяются пептидные “вставки”. Пептидные связи являются гидролитически устойчивыми, но внутри клетки они подвергаются ферментативному гидролизу.
Одним из путей достижения высокого уровня селективности действия ПОС является конструирование сложных полимерных систем, содержащих “узнающие” компоненты (векторы), связанные с полимером-носителем. В качестве вектора могут быть использованы факторы роста и онкофетальные белки, рецепторы которых имеются преимущественно на опухолевых клетках. В основе механизма действия
таких систем лежит перенос ЛВ в опухолевую клетку в процессе рецепторопосредованного эндоцитоза, индуцируемого связыванием рецептора с его лигандом. Среди неспецифических векторов, рецепторы к которым локализуются преимущественно на опухолевых клетках различных злокачественных новообразований, широко используются фолиевая кислота, трансферрин и интегрин. В последние годы разрабатываются конъюгаты ПОС с опухоль-специфическими антителами (каждая опухоль продуцирует определенные антигены, которые связываются только с одним типом
антител). Такие системы позволяют полностью избегать контакта ПОС с нормальными клетками и достигать 100 %-ной селективности в распределении ЛВ между клетками. Однако применение антител в качестве векторов для транспортной доставки ЛВ связано со значительным риском развития побочных эффектов со стороны иммунной системы (аллергические реакции), что может даже угрожать жизни пациента. Использование антител для селективной доставки ЛВ требует дополнительных исследований in vitro и in vivo. Кроме того, работа с антителами связана со значительными экономическими затратами, что ограничивает более детальное изучение данного способа фармакотерапии.
В общем виде механизм действия полимерных производных противоопухолевых средств можно представить следующим образом. Система “полимер–ЛВ” связывается с клетками в соответствии со своими суммарным зарядом и гидрофильно-липофильным балансом, а также с помощью биоспецифического лиганда (вектора), если он есть, после чего подвергается эндоцитозу. Внутри клетки (в лизосомах) под действием условий окружающей среды ЛВ высвобождается в результате либо разрушения полимерной мицеллы, либо ферментативного или кислотного гидролиза внутри лизосом
полимерной системы “прививочного” типа, вызывая гибель клетки.
Таким образом, переход от традиционных противоопухолевых препаратов к их полимерным производным обеспечивает дополнительный положительный эффект даже без учета специфического транспорта, поскольку полимеры, обладая высокой ММ, эффективнее захватываются опухолевыми клетками, обладающими повышенной способностью к эндоцитозу по сравнению с нормальными клетками. Данное направление особенно актуально в связи с растущей частотой онкологических заболеваний и отсутствием малотоксичных низкомолекулярных лекарственных средств в клинической практике.


