В связи с широкой распространенностью сердечно-сосудистых заболеваний у больных сахарным диабетом 2 типа (СД2) большое внимание уделяется кардиопротективным особенностям сахароснижающих препаратов. В статье представлены данные о влиянии инновационного препарата вилдаглиптина, относящегося к инкретинонаправленной терапии, на функциональное состояние миокарда у больных СД2 в сочетании с ишемической болезнью сердца (ИБС). Терапия вилдаглиптином сопровождается лучшим гликемическим контролем, снижением уровня гликозилированного гемоглобина, способствует повышению толерантности к физической нагрузке, повышению ее пороговой мощности, уменьшению суммарного времени ишемии миокарда, уменьшению площади и выраженности дефекта перфузии миокарда левого желудочка.
Сахарный диабет (СД) является одной из серьезнейших медико-социальных проблем в связи с высокой распространенностью, стремительным ростом заболеваемости, высокой частотой инвалидизации
и сохраняющейся высокой летальностью. В 2010 г. в мире насчитывалось 284 млн больных СД, и на основании нынешних темпов заболеваемости предполагается, что к 2030 г. это число возрастет до 440 млн. Ежегодно в мире регистрируется 7 млн новых случаев СД (IDF Diabetes Atlas, 2010).
Ишемическая болезнь сердца (ИБС) – одна из ведущих причин смерти во всех странах мира. Несмотря
на снижение смертности от сердечно-сосудистых заболеваний (ССЗ), которое было достигнуто благодаря активной первичной и вторичной профилактике факторов риска, смертность от ССЗ среди больных СД существенно выше, чем в остальной популяции: в 2 раза – среди мужчин и в 4–5 – среди
женщин [1, 2]. Клиническая практика последних десятилетий свидетельствует, что СД 2 типа (СД2) является одной из ведущих причин развития ССЗ [3–5].
Американская диабетическая ассоциация (ADA) опубликовала данные, согласно которым более чем в 60 % случаев продолжительность жизни больных СД2 сокращается в связи с ранним развитием ИБС, а согласно рекомендациям АТР III (Adult Treatment Panel III, 2001), СД является эквивалентом ИБС.
Хорошо известна прямая зависимость между уровнем гликемии, ее колебаниями и риском развития диабетических осложнений, подтвержденная в многочисленных широкомасштабных исследованиях (DCCT, UKPDS, DECODE). Поэтому достижение и поддержание адекватного гликемического контроля являются приоритетным направлением в лечении СД2.
В последние годы арсенал медикаментозных средств лечения СД2 пополнился новыми препаратами,
относящимися к группе инкретиномиметиков, – ингибиторами дипептидилпептидазы-4 (ДПП-4). Механизмом их действия является увеличение длительности действия эндогенных инкретинов (глюкагоноподобного пептида-1 [ГПП-1]), т. е. мобилизация собственных резервов организма для борьбы с гипергликемией [6]. Одним из ингибиторов ДПП-4 является вилдаглиптин. В многочисленных исследованиях показаны выраженный сахароснижающий эффект этого препарата, ассоциирующийся с низким риском гипогликемий [7–11], способность влиять на липидный обмен [12, 13], снижать уровень артериального давления [14], позитивно воздействовать на эндотелиальную дисфункцию [15].
В экспериментальных исследованиях на животных установлена способность ингибиторов ДПП-4 (опосредованно – через повышение ГПП-1) повышать сердечный выброс, уменьшать размер инфаркта миокарда, влиять на NO-зависимую вазодилатацию коронарных сосудов и как следствие – улучшать кровоснабжение сердечной мышцы [16, 17].
С учетом высокой распространенности ССЗ у больных СД2 в настоящее время большое внимание уделяется кардиопротективным эффектам сахароснижающих препаратов. С этой точки зрения значительный интерес представляет дальнейшее изучение влияния ДПП-4, в частности вилдаглиптина, на состояние сердечно-сосудистой системы, а именно на показатели сократительной функции
миокарда у больных СД2 в сочетании с ИБС, и целесообразности их использования данной категорией пациентов.
Целью настоящего исследования явилось изучение влияния вилдаглиптина на сократительную функцию миокарда левого желудочка (ЛЖ) у больных СД2 в сочетании с ИБС.
Материал и методы
В исследование были включены 60 пациентов с СД2 в сочетании с ИБС, в т. ч. 44 (73,4 %) женщины (средний возраст – 63,0 [61,5; 65,5] года) и 16 (26,6 %) мужчин (средний возраст –63,5 [60; 71,5] года). Все больные имели избыточную массу тела (индекс массы тела [ИМТ] – 33,0 более 25 кг/м2).
В зависимости от назначенной сахароснижающей терапии больные были разделены на 3 равные группы по 20 человек: 1-я группа – пациенты с впервые выявленным СД2 в возрасте от 60 до 69 лет, которым был назначен вилдаглиптин (Галвус, Новартис) в дозе 100 мг/сут; 2-я – пациенты с СД2 (медиана длительности заболевания – 2 года) в возрасте от 59 до 73 лет, которым к терапии метформином был добавлен вилдаглиптин в дозе 100 мг/сут (препарат Галвус Мет, Новартис); 3-я группа – пациенты с впервые выявленным СД2 в возрасте от 61 до 73 лет, которым был назначен метформин в дозе от 1000 до 2550 мг/сут. Длительность наблюдения составила 24 недели. Как следует из табл. 1, группы больных были достаточно однородны и достоверно не различались по профилю ССЗ.
Таблица 1.
Клиническая характеристика обследованных групп пациентов.
Диагноз ИБС ставился на основании анамнеза, наличия стенокардии напряжения и/или покоя и результатов дополнительных методов исследования (ЭКГ, ЭХО-КГ, стресс-ЭХО-КГ, холтеровское мониторирование). Функциональный класс (ФК) стенокардии определен по классификации Канадской ассоциации кардиологов. Исходно и через 24 недели терапии пациентам проводилось общеклиническое обследование, в частности определены показатели углеводного (гликемия натощак, постпрандиальная гликемия, гликозилированный гемоглобин [HbA1c]) и липидного обмена.
Пациентам было выполнено инструментальное обследование до и после назначения сахароснижающей терапии: ЭКГ; суточное мониторирование, с помощью которого оценивали количество эпизодов ишемии миокарда (болевых и безболевых); среднюю продолжительность одного эпизода ишемии и общее время ишемии за сутки. ЭХО-КГ проведена на аппарате Logiq ТМ-400 (США) с использованием трансторакальных датчиков с частотой импульсов 3,5/2,7 МГц и глубиной эхолокации 7 см. Проба с дозированной физической нагрузкой выполнена на велоэргометре “Meditronic” (Hellige, Германия) и “Sicard” (Siemens, Германия). Пробу начали с предварительной регистрации ЭКГ в 12 стандартных отведениях. Во время пробы ЭКГ регистрировали после каждой ступени нагрузки, сразу после ее окончания и в восстановительном периоде. Нагрузку увеличивали на 25 Вт каждые 3 минуты (исходная нагрузка составила 25–50 Вт). В зависимости от максимальной нагрузки оценивали толерантность к физической нагрузке: ≤ 50 Вт – низкая, 75–125 Вт – средняя, ≥ 150 Вт – высокая. Пробу считали положительной при возникновении приступа стенокардии и/или появлении горизонтальной или косонисходящей депрессии или подъема сегмента ST на 1,5 мм и более длительностью не менее 0,08 секунды от точки J.
Пациентам с инфарктом миокарда в анамнезе для оценки перфузии ЛЖ назначали один из современных радионуклидных методов исследования миокарда: однофотонную эмиссионную компьютерную томографию (ОФЭКТ) с 99mТс-технетрилом. Исследование выполнялось на двудетекторной гамма-камере VERTEX фирмы ADAC (США) по стандартному однодневному протоколу нагрузка–покой. 99mТс-технетрил вводился внутривенно, болюсно на пике физической (фармакологической) нагрузки (активностью 8–10 мКи) и повторно в покое (20–25 мКи) с интервалом
3–4 часа. Полученные данные были оценены визуально (по срезам) и полуколичественно с использованием 20-сегментных полярных диаграмм. Миокардиальный сегмент расценивался как гипоперфузируемый, если поглощение радиофармацевтического препарата (РФП) в нем отличалось
более чем на 2 стандартных отклонения от “базы нормы”.
Сегменты ЛЖ с низким накоплением РФП на фоне нагрузки и полной или частичной нормализацией накопления в покое рассматривались как обратимые или частично обратимые дефекты перфузии (ДП) и соответствовали зонам ишемии миокарда. Сегменты с необратимыми ДП (в равной степени сниженное включение РФП при нагрузке и в покое) соответствовали зонам очагово-рубцового поражения миокарда. При анализе использовались и такие величины, как площадь ДП (процентная доля от общей площади ЛЖ) и суммарная выраженность ДП, рассчитанная как сумма значений
стандартных отклонений во всех гипоперфузируемых сегментах.
Статистический анализ проводился с использованием программы Biostatica. Математический анализ
полученных данных был выполнен с применением непараметрических статистических критериев. Достоверность различий между двумя группами оценивали с помощью критерия Манна– Уитни, изменение признака во времени – критерия Вилкоксона. Данные в тексте и таблицах представлены в виде Ме (25; 75), где Ме – медиана 25 и 75 – 1-й и 3-й квартили. Критический уровень значимости при проверке нулевой гипотезы составил ≤ 0,05.
Результаты
На фоне терапии во всех группах отмечено сопоставимое достоверное улучшение гликемического контроля. Так в 1-й группе (вилдаглиптин) в конце наблюдения уровень HbA1c снизился на 0,9 % и составил 6,3 % (6,2; 6,7) (р < 0,02), во 2-й группе (вилдаглиптин + метформин) уровень HbA1c упал до 6,7 % (6,1; 7,1) (уменьшился на 0,8 %; р < 0,018), в 3-й группе (метформин) содержание HbA1c снизилось на 0,7 %, достигнув 6,3 % (6,2; 6,75) (р < 0,016). При анализе показателей тощакового и постпрандиального уровней гликемии также было выявлено сопоставимое достоверное снижение данных параметров.
Анализ липидного профиля показал, что у большинства пациентов показатели не достигали целевых значений: только у 18 (30 %) больных уровень холестерина (ХС) был ниже 4,5 ммоль/л, у 36,7 % пациентов уровень триглицеридов превышал норму. В 1-й группе (вилдаглиптин) к концу наблюдения отмечено достоверное снижение только уровня ХС липопротеидов низкой плотности (ЛПНП) в среднем
на 19,7 % (р < 0,05), во 2-й группе (вилдаглиптин + метформин) выявлено достоверное снижение уровня ХС ЛПНП на 12, 8 % (р < 0,05), в 3-й группе (метформин) наблюдали достоверное снижение концентрации триглицеридов на 40 % и повышение уровня ХС липопротеидов высокой плотности на 26,7 % (р < 0,05).
ЭХО-КГ в покое была проведена всем больным. Нами проанализированы основные параметры сократительной способности миокарда ЛЖ. У 70,7 % пациентов выявлена картина гипертрофии миокарда. Назначение различных сахароснижающих режимов не привело к достоверным изменениям основных структурно-функциональных параметров миокарда, отмечена тенденция к уменьшению конечно-диастолических и конечно-систолических объемов и размеров ЛЖ во всех группах. К концу исследования фракция выброса ЛЖ достоверно не изменилась, ее медиана составила 56 % (53,5; 56,5) (p > 0,05).
Поскольку одной из основных функций миокарда является сократительная, обеспечивающая нагнетание крови в сосудистое русло, было проведено изучение данной функции при помощи стресс-ЭХО-КГ с велоэргометрией (ВЭМ). Последняя была проведена 19 (95 %) больным в 1-й группе, 18 (90 %) – во 2-й и 18 (90 %) – в 3-й. Остальным пациентам проба не выполнялась из-за исходной тяжести
состояния (постинфарктная аневризма ЛЖ, низкая фракция выброса, желудочковые аритмии высокой градации). Безболевая ишемия, подтвержденная ВЭМ, выявлена у 2 больных 1-й группы, у 3 – 2-й и у 2 больных 3-й.
Исходно у пациентов 1-й группы до начала лечения ВЭМ-проба была положительной в 19 (100 %) случаях. Через 24 недели терапии в 13 (68,4%) случаях проба оставалась положительной и в 6 (31,6%) она трактовалась как отрицательная. Во 2-й и 3-й группах исходно ВЭМ-проба также была положительной у всех больных. Через 24 недели наблюдения она становилась отрицательной у 5 (27,8 %) и 1 (5,55 %) пациента соответственно. Таким образом, в группах, в которых пациенты принимали вилдаглиптин (1-я и 2-я) в монотерапии или в комбинации с метформином были выявлены более зна-
чимые изменения в конечных результатах ВЭМ-пробы (табл. 2).
Таблица 2.
Динамика результатов ВЭМ-пробы у больных СД2 на фоне проводимой сахароснижающей терапии, n (%).
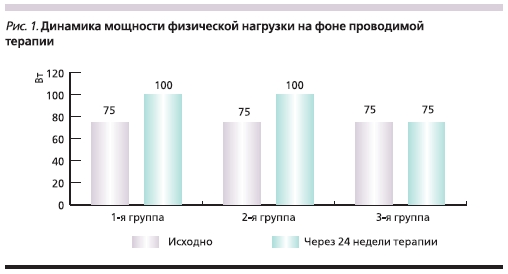
При оценке порога толерантности к физической нагрузке было выявлено его повышение в 1-й и 2-й группах. Так, в 1-й группе к концу наблюдения медиана мощности физической нагрузки увеличился на 33 % по отношению к исходным уровню, составив 100 (75; 100) Вт. Во 2-й группе произошли аналогичные изменения: прирост уровня пороговой мощности физической активности составил 33 %,
что соответствует 100 (93,75; 100) Вт.
В 3-й группе медиана пороговой мощности физической активности осталась без изменений – 75 (75; 100) Вт (рис. 1).
Двумерная ЭХО-КГ является адекватным методом предсказания локализации нарушений проходимости
коронарных артерий по визуализируемым участкам нарушения сократимости миокарда. Проведение нагрузочных проб способствует лучшей оценке степени поражения артерий. Качественный анализ сегментарной сократимости по данным стресс-ЭХО-КГ показал, что в совокупности количество асинергичных сегментов в 1-й группе составило 87 (25,4 %), во 2-й – 87 (26,9 %) и в 3-й – 82 (25,3 %). Через 24 недели терапии было зафиксировано снижение числа асинергичных сегментов. Так, в 1-й группе количество сегментов с нарушенной сократимостью уменьшилось на 18 (р < 0,05),
во 2-й – на 15 (р < 0,05) и в 3-й – на 4 (р > 0,05), что произошло за счет участков, находившихся в состоянии гипокинеза.
В результате количество сегментов с нарушенной сократимостью у одного больного достоверно (р < 0,05) уменьшилось в 1-й и 2-й группах на 20 %, составив 4 (3; 6) и 4 (3; 4,5) соответственно, тогда как в 3-й группе медиана числа таких сегментов достоверно не изменилась, составив 5 (4; 5,75).
Соответственно, у пациентов 1-й и 2-й групп достоверно (р < 0,05) уменьшился показатель суммы баллов сократимости: до 20 (18,5; 22) и 9,5 (19; 21) ЕД. У больных 3-й группы не было выявлено достоверных изменений суммы баллов сократимости, к концу исследования составившей 21 (20,5; 21,75) ЕД.
С целью выявления эпизодов ишемии всем пациентам до и после терапии проводился суточный мониторинг ЭКГ. При первичном проведении исследования, по данным холтеровского мониторирования, ишемические изменения миокарда (депрессия ST > 1 мм) были констатированы у 8 (40 %), 6 (30 %) и 9 (45 %) больных 1-й, 2-й и 3-й групп соответственно. Эпизоды ишемии носили характер как болевых, так и безболевых. Назначение вилдаглиптина пациентам 1-й и 2-й групп
привело к статистически значимому уменьшению длительности ишемических эпизодов и времени суммарной ишемии (ВСИ) миокарда. У пациентов 1-й группы к концу наблюдения ВСИ снизилось на 32,3 % и составило 4,2 (2,6; 5,67) мин/сут (р < 0,05). У пациентов 2-й группы ВСИ упало до 3,29 (2,24;
5,2) мин/сут, что было ниже исходного значения на 26,1 % (р < 0,05). Медиана ВСИ у пациентов 3-й группы уменьшилась только на 7,1 % – до 4,55 (2,5; 6,3) мин/сут, не достигнув статистической достоверности (р > 0,05).
Из 6 пациентов, которым проведена перфузионная ОФЭКТ, 3 были обследованы в покое и при нагрузке, 3 – только в покое в связи с тяжестью состояния (ХСН, физическая детренированность, отказ пациента). Исходно у всех 6 больных отмечены нарушения перфузии в покое, причем размер ДП
колебался от 7 до 40 % площади ЛЖ, суммарная выраженность ДП составила от 5 до 51,6. В условиях нагрузки у 1 из 3 пациентов отмечены признаки стресс-индуцированной ишемии миокарда. В двух других случаях выявлены стабильные, преимущественно выраженные ДП, без значимого нарастания
перфузионных нарушений при стрессе. В обоих случаях отмечены высокие показатели суммарной выраженности ДП (34 и 35). Данные изменения расценены как обширные трансмуральные постинфарктные повреждения миокарда. Через 24 недели после начала терапии нарушения перфузии в покое сохранились у 5 пациентов: слабоположительная динамика в плане уменьшения площади и выраженности ДП отмечена у 1 больного, отрицательная динамика – у 1, у 3 пациентов имелась тенденция к улучшению перфузии в покое (рис. 2). У одного больного прослеживалась практически полная нормализация миокардиального кровотока в покое и уменьшение ДП на нагрузке с 11 до 6 % площади ЛЖ. Следует отметить, что у этого единственного пациента со значимой положительной динамикой в покое и при нагрузке исходно отмечены минимальные отклонениями от нормы по данным
ОФЭКТ. Еще у 2 пациентов, выполнивших нагрузочные пробы, прослежена слабоположительная динамика показателей ОФЭКТ: площадь ДП нагрузки уменьшилась в одном случае с 38 до 33 %, в другом – с 43 до 42 % (рис. 2).
Рисунок 2.
Площадь и выраженность дефекта перфузии миокарда ЛЖ по данным ОФЭКТ с99mТс-технетрилом до и после лечения.
Только у одного пациента из шести было выявлено нарастание перфузионных нарушений. Увеличение ДП в покое с 15 до 23 % площади ЛЖ сопровождалось обострением течения ИБС у больной с множественными поражениями коронарного русла и расценено как повторное рубцовое повреждение
миокарда (рис. 3).
Рисунок 3.
Однофотонная эмиссионная компьютерная томография миокарда пациентки Д. 70 лет.
Оценка перфузии миокарда по данным однофотонной эмиссионной компьютерной томографии до и после лечения вилдаглиптином (рис. 3). При исследовании пациентки Д. 70 лет в покое исходно отмечен дефект перфузии в области верхушки и передней стенки левого желудочкa. При контрольном исследовании прослеживается уменьшение объема и выраженности зоны гипоперфузии миокарда.
Для более точной оценки самочувствия пациентов в данной работе использован опросник качества жизни SF-36v2, который включает шкалы, анализирующие физическое и ментальное здоровье больных. Полученные результаты показали, что у обследованных больных всех групп до лечения наблюдалось достоверное снижение показателей качества жизни по большинству шкал. Снижение показателей физического здоровья было более выраженным, чем ментального. Терапия вилдаглиптином (1-я и 2-я группы) привела к достоверному улучшению (р < 0,05) показателей качества жизни по шкалам PF (физическое функционирование), Р (болевая шкала), GH (общее состояние здоровья), VT (жизнеспособность) более существенно, чем терапия метформином.
Обсуждение результатов
В 2011 г. Совет экспертов Российской ассоциации эндокринологов (РАЭ) разработал новый (5-й)
выпуск алгоритмов специализированной медицинской помощи больным сахарным диабетом с положениями о сахароснижающей терапии СД2 типа, где препаратами первого ряда для старта терапии наряду с метформином являются ингибиторы ДПП-4. Данная позиция обоснована огромной доказательной базой по безопасности и эффективности применения данных лекарственных средств.
Сахароснижающий эффект как метформина, так и ингибиторов ДПП-4 был подтвержден многочисленными исследованиями. В то же время наличие у ингибиторов ДПП-4 ряда плейотропных свойств, в частности кардиопротективных эффектов, является крайне привлекательным для их применения пациентами с сопутствующей ИБС.
В нормальных физиологических условиях утилизация жирных кислот и углеводов кардиомиоцитами абсолютно сбалансированна и зависит от доступности каждого из этих субстратов. Поэтому поломки на каком-либо этапе этой последовательной цепи приводят к метаболическим нарушениям со стороны миокарда. Считается, что при СД нарушения захвата и утилизации глюкозы кардиомиоцитами являются начальным событием в патогенезе диабетической кардиомиопатии [18], связанной с низкой скоростью транспорта субстрата через саркоплазматическую мембрану в результате уменьшения запасов клеточных транспортеров глюкозы GLUT-1 и GLUT-4 [19], а также вследствие сниженной скорости фосфорилирования глюкозы внутри клетки [20]. С другой стороны, нарушения энергетического обмена обусловлены инсулиновой недостаточностью. В условиях этого дефекта усиливается липолиз жировой ткани, в результате чего огромный пул свободных жирных кислот поступает в миокард и подвергается β-окислению. По сути этот процесс становится основным источником энергии в кардиомиоцитах, что ведет к кислородозатратному типу энергообмена, приводя к дефициту кислорода.
В условиях ограничения поступления кислорода в миокард (гемодинамически значимые стенозы коронарных артерий) снижается поступление жирных кислот, но при этом резко увеличивается захват клетками глюкозы из крови и ее образование из гликогена [21, 22]. Анаэробный гликолиз, при котором используются запасы гликогена, может обеспечить некоторое количество АТФ в составе пула, который может использоваться клеткой, однако снижение утилизации глюкозы клеткой при СД2 приводит к уменьшению продукции АТФ, а значит – к энергометаболическим нарушениям со стороны кардиомиоцита.
Опираясь на экспериментальные исследования, проведенные на животных, в которых было выявлено, что ГПП-1 и его метаболиты способны улучшать сократительную функцию миокарда после транзиторной окклюзии коронарной артерии путем усиления поглощения глюкозы кардиомиоцитами, уменьшать размер инфаркта, вызывать NO-зависимую вазодилатацию коронарных сосудов и как след-
ствие – улучшать кровоснабжение сердечной мышцы [16, 23], мы можем предположить аналогичное влияние вилдаглиптина на сердечную мышцу, опосредованное повышением уровня ГПП-1. Данный препарат улучшает поглощение глюкозы кардиомиоцитами, вследствие чего усиливается синтез АТФ, улучшается энергетический метаболизм миокарда, что приводит к улучшению сократительной активности его ЛЖ [24–26].
Полученные в работе результаты не расходятся с мировыми данными. Так, назначение вилдаглиптина в монотерапии или в сочетании в метформином способствовало уменьшению длительности ишемических эпизодов и времени суммарной ишемии миокарда (по данным суточного мониторирования ЭКГ), снижению количества сегментов с нарушением сократимости и показателя степени расстройств
локальной сократимости, повышению порога и толерантности к физической нагрузке (по данным стресс-ЭХО-КГ).
Улучшение сократительной функции миокарда при применении вилдаглиптина связано, с одной стороны, с улучшением углеводного обмена, с другой – объясняется улучшением метаболизма кардиомиоцита за счет повышения утилизации глюкозы. Еще одним возможным механизмом является
повышение экспрессии эндотелиальной NO-синтазы [17]. Образующийся при этом NO усиливает коронарный кровоток и доставку кислорода к миокарду. Выдвигается гипотеза о натрийуретическом или диуретическом действии ГПП-1 [17], которое приводит к уменьшению преднагрузки на сердце. Таким образом, увеличение уровня ГПП-1 способствует уменьшению объема циркулирующей крови, конечно-диастолического объема ЛЖ, диастолического стресса на эндокард ЛЖ. В результате уменьшается отек кардиомиоцитов и улучшается коллатеральный кровоток.
На фоне применения вилдаглиптина наметилась тенденция к уменьшению выраженности ДП как в покое, так и при нагрузке (по данным сцинтиграфии миокарда), а также площади ДП (у 3 из 6 пациентов). Однако обнаружить значимую динамику изменений перфузии по данным ОФЭКТ на фоне
обширных очагово-рубцовых изменений гораздо сложнее, чем у пациентов с небольшими нарушениями перфузии, что хорошо прослеживалось в нашей группе больных. Поэтому для более глубокой оценки состояния перфузии миокарда при применении вилдаглиптина необходима бóльшая
выборка пациентов с менее выраженными нарушениями перфузии.
Таким образом, включение вилдаглиптина в основную сахароснижающую схему больных СД2 в сочетании с ИБС будет способствовать улучшению течения коронарной болезни и повышению качества жизни пациентов.
Выводы
1. Назначение вилдаглиптина больным СД2 в сочетании с ИБС, по данным стресс ЭхоКГ с ВЭМ, приводит к повышению толерантности к физическим нагрузкам, достоверно увеличивая пороговую мощность нагрузки.
2. Назначение вилдаглиптина не приводит к ухудшению перфузии миокарда, по данным ОФЭКТ, у
больных СД2. У отдельных больных отмечается тенденция к уменьшению площади и выраженности
дефекта перфузии, более выраженная в отсутствие трансмуральных рубцовых изменений миокарда ЛЖ.
3. Применение вилдаглиптина, по данным холтеровского мониторирования, приводит к статистически
достоверному снижению времени суммарной ишемии миокарда за счет уменьшения общего количества
эпизодов ишемии и их средней продолжительности.
4. Терапия пациентов с СД2 вилдаглиптином, метфомином и их комбинацией сопровождается достоверным и сопоставимым улучшением тощаковой, постпрандиальной гликемии и уровня HbA1c (гликозилированного гемоглобина).
5. Гиполипидемический эффект вилдаглиптина проявляется достоверным снижением ХС ЛПНП, а
метформина – снижением уровня триглицеридов и повышением ХС ЛНВП. Комбинация вилдаглиптина
и метформина способствует многогранному влиянию на липидный обмен у больных СД2.
6. Назначение вилдаглиптина больным СД2 в сочетании с ИБС приводит к достоверному улучшению показателей качества жизни по шкалам PF, Р, GN, VT.