не менее значимы, чем последствия инсультов. В зависимости от степени недостаточности мозгового кровообращения и выраженности неврологического дефицита выделяют три стадии заболевания. При I стадии ДЭ жалобы и диагностические критерии аналогичны таковым при начальных проявлениях недостаточности мозгового кровообращения. Дополнением является наличие диффузной микроочаговой неврологической симптоматики в виде анизорефлексии, недостаточности конвергенции, негрубых рефлексов орального автоматизма. ДЭ II стадии характеризуется нарастанием неврологической симптоматики с формированием доминирующего синдрома, а
также признаками снижения профессиональной и социальной адаптации. ДЭ III стадии определяется наличием одного или нескольких неврологических синдромов; снижением критики к своему состоянию; нарастанием социальной, профессиональной, возможно и бытовой дезадаптации.
получения изображения и усовершенствованным программным обеспечением. Совершенствование технологий сканирования и обработки информации способствовало широкому распространению методики ПКТ.
высочайшее качество, отсутствие артефактов от костных структур, возможность получения бесконтрастного изображения от движущихся жидкостей, а также то, что МРТ более чувствительна
при выявлении мелких глубоких очагов и инфарктов в структурах задней черепной ямки. Однако этот метод исследования менее чувствителен по сравнению с КТ при выявлении кровоизлияний в первые часы развития инсульта, что принципиально влияет на тактику ведения пациента [6]. Вместе с тем для применения МРТ есть противопоказания – наличие металлических инородных тел, наружного водителя ритма, выраженной клаустрофобии, а также у тяжелых больных, находящихся на искусственной
вентиляции легких, что требует специального парамагнитного оборудования. Осложняет применение МРТ-исследования его длительность (30–60 минут), в течение этого времени пациент должен находиться в неподвижном состоянии.
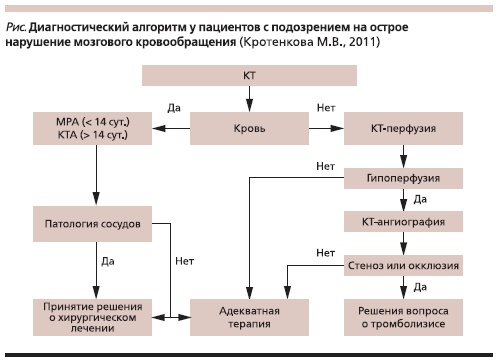
вать достоинства каждой из методик. Компьютерная томография головного мозга выполняется всем пациентам при подозрении на острое НМК, т. к. этот метод быстр в исполнении и не имеет абсолютных противопоказаний, при этом имеет достаточно высокую информативность. Нативная КТ прежде всего используется для экстренной диагностики субарахноидальных и внутримозговых кровоизлияний,
т. к. зона повышенной плотности на КТ, соответствующей кровоизлиянию, выявляется тотчас. В острой
стадии кровоизлияния точность КТ-диагностики достигает 99 %, тогда как при постановке диагноза инфаркта мозга – 78 % [5]. При исключении кровоизлияния внутривенно вводят йодистое контрастное вещество и проводят перфузионную КТ головного мозга, а при выявлении очага гипоперфузии – КТ-ангиографию (см. рисунок).
на поддержание всех жизненно важных функций организма. Она включает контроль дыхательных функций, сердечно-сосудистой деятельности, профилактику вторичных соматических осложнений, купирование пароксизмальных состояний, поддержание кислотно-основного и осмолярного гомеостаза, водно-электролитного баланса, профилактику и лечение внутричерепной гипертензии и отека мозга, вегетативно-трофических расстройств [4].
вплоть до нескольких часов после дебюта инсульта. Восстановление кровотока в окклюзированной артерии в этот временнóй интервал (период “терапевтического окна”) может позволить сохранить жизнеспособность обратимо поврежденной мозговой ткани и, таким образом, способствовать сохранению жизни и дееспособности пациента. Реперфузия пораженного бассейна может быть достигнута за счет растворения, разрушения или удаления тромба (тромбоэмбола), обтурирующего
просвет церебральной артерии. В этих случаях наиболее современным методом лечения является тромболизис. В зависимости от пути введения тромболитика различают внутривенный и внутриартериальный тромболизис.
ткани мозга. В настоящее время описано два основных пути клеточной смерти: активный и пассивный. Некроз – это процесс, который может быть вызван почти всеми патологическими воздействиями (включая физические, химические и биологические). Последовательность патологических событий при некрозе всегда сходна: осмолизис, вызванный клеточным отеком, приводит к пассивной смерти поврежденной клетки. Некроз поражает не только нервную клетку. Одним из вторичных его эффектов является воспаление, которое вызывается высвобождаемым клеточным содержимым и сопровождается выработкой цитокинов. Другим механизмом клеточной смерти является апоптоз, в который вовлечена АТФ в отличие от некроза.
часов. К препаратам этого ряда относятся антагонисты потенциалзависимых кальциевых каналов (дигидропиридины – например, нимодипин), антагонисты глутаматных рецепторов (например, широко применяемая магнезия является неконкурентным антагонистом NMDA-рецепторов), ингибиторы синтеза и пресинаптического высвобождения глутамата (производные гамма-аминомасляной кислоты –
ГАМК, глицин) и др.
В процессе выздоровления отмечается постепенное и зачастую неравномерное восстановление нейромедиаторных систем. Эти процессы определяют клиническую картину подкоркового уровня.
При преимущественном угнетении функции левого полушария симптомы чаще всего связаны с относительной холинергической недостаточностью, при угнетении правого полушария механизмы нарушений менее специфичны, иногда их можно объяснить ГАМКергической недостаточностью [1].
Глицерилфосфорилхолин содержит 40 % холина и трансформируется в организме в активный метаболит фосфорил-холин, активирующий биосинтез ацетилхолина в пресинаптических мембранах холинергических нейронов [3].
химической структуре рибозу, цитозин, пирофосфат и холин; его формула –2-окси-4-аминопиримидин. CDP-холин – необходимое промежуточное вещество в синтезе структурных фосфолипидов клеточных мембран. Основной компонент цитиколина холин хорошо всасывается в кишечнике и проникает через гематоэнцефалический барьер. Являясь предшественником ацетилхолина, цитиколин обеспечивает усиление синтеза и высвобождение ацетилхолина с повышением активности холинэргической
системы. Согласно экспериментальным данным, препарат оказывает мультимодальное нейропротективное действие: восстанавливает активность Na+/K+-АТФазы клеточной мембраны, снижает активность фосфолипазы A2 и участвует в синтезе фосфатидилхолина, т. е. оказывает
антиоксидантный и мембраностабилизирующий эффекты. Кроме того, цитиколин ингибирует глутаматиндуцированный апоптоз и усиливает механизмы нейропластичности. Таким образом, в целом цитиколин обеспечивает защиту и восстановление поврежденных клеточных мембран. Безопасность препарата была продемонстрирована в исследованиях на животных [15]. Эффективность цитиколина была доказана экспериментально: в исследовании транзиторной ишемии у крыс отмечалось уменьшение размера инфаркта, тенденция к уменьшению выраженности отека мозга и смертности [14]. Кроме того, в эксперименте цитиколин оказывал благоприятный эффект при реперфузионном повреждении мозговой ткани, что было показано с помощью уменьшения размера инфаркта у крыс при применении цитиколина в комбинации с тромболитической терапией [7].
эффективностью. Уже в первых контролируемых исследованиях, проведенных в конце 1990-х гг., у пациентов с острым ишемическим инсультом была продемонстрирована эффективность цитиколина в широком диапазоне доз (500–2000 мг в сутки) как при пероральном приеме так и при внутривенном введении [9–11]. Подтверждение эффективности препарата было получено и при анализе данных нейровизуализации: отмечено уменьшение размера инфаркта по результатам МРТ в режиме диффузионно-взвешенного изображения в группе цитиколина [16]. Результаты, полученные в разных клинических исследованиях, были проанализорованы и представлены медицинской общественности в 2002 г. [13]. Анализ проводился на выборке из 1372 пациентов, удовлетворявших установленным
критериям: тяжесть инсульта (исходно по шкале NIH ≥ 8), предшествующий функциональный статус (модифицированная шкала Рэнкина ≤ 1), терапевтическое окно не более 24 часов и применение соответствующих методов нейровизуализации. В качестве критерия эффективности была выбрана
частота общего восстановления через 3 месяца по трем анализируемым шкалам (шкала Рэнкина ≤ 1 + шкала NIH ≤ 1 + индекс Бартеля ≥ 95), с помощью описанного ранее метода общих оценочных уравнений (GEE). В этой группе из 1372 пациентов 583 получали плацебо и 789 – цитиколин (264 пациента получали 500 мг, 40 – 1000 мг и 485 пациентов – 2000 мг препарата в сутки). Общее восстановление через 3 месяца было достигнуто у 25,2 % пациентов, получавших цитиколин, и 20,2 % пациентов в группе плацебо (ОР: 1,33; 95 % ДИ: 1,10–1,62; p = 0,003); наиболее эффективная доза
составила 2000 мг в сутки. Эта доза привела к полному восстановлению через 3 месяца 27,9 % пациентов, получавших препарат (ОР: 1,38; 95 % ДИ: 1,10–1,72; p = 0,004). В дополнение к этому безопасность цитиколина была такой же, как и в группе плацебо [13].
по модифицированнои шкале Рэнкина значительно снизилось). Эти результаты согласуются с результатами ранее описанного мета-анализа [16]. Что касается безопасности, в 2009 г. в Южной Корее было проведено исследование, которое включило 4191 пациента с острым инсультом, получавшего цитиколин. При перральном приеме цитиколин улучшил неврологический, функциональный и глобальный статус пациентов с острым ишемическим инсультом и не вызывал серьезных проблем с безопасностью [17].
пациентов.


