Введение
Акромегалия представляет собой сравнительно редкое тяжелое инвалидизирующее заболевание, развивающееся в результате возникновения опухоли (аденомы) гипофиза, и сопровождается гиперпродукцией гормона роста (ГР) и инсулиноподобного фактора роста 1 (ИФР-1), которые являются биохимическими маркерами заболевания и формируют характерный фенотип заболевания, способствуя развитию типичных осложнений и вторичных проявлений [1]. Современные подходы к терапии акромегалии нацелены на уменьшение симптомов, снижение уровня биохимических маркеров заболевания в сыворотке крови, уменьшение размера опухоли и активности коморбидного фона, сохранение питуитарной функции, минимизацию побочных эффектов и уровня смертности [2]. В настоящее время имеется определенный спектр методов лечения, включающий хирургическое, медикаментозное (депо-формы синтетических аналогов человеческого соматостатина и антагонисты соматостатиновых рецепторов), лучевое и/или комбинированное [3].
Несмотря на то что акромегалия известна с глубокой древности, основная эволюция в лечении заболевания приходится на вторую половину ХХ столетия и продолжается в настоящее время. Первые систематические исследования эпидемиологии и клинических особенностей течения акромегалии относятся к первой половине ХХ в. [4]. При подведении итогов почти 100-летних наблюдений можно сказать, что в течение одного столетия постепенно меняются представления о патоморфозе акромегалии, диагностических и лечебных подходах.
Выбор лечебной стратегии
Главным показателем эффективности лечения акромегалии является уровень заболеваемости вторичными заболеваниями, ассоциированными с гиперпродукцией ГР и ИФР-1, и смертности в рассматриваемой популяции [5]. Уровень смертности был оценен в отношении применения радиотерапии и хирургического лечения [6]. Долговременное (в ряде случаев пожизненное) медикаментозное лечение требуется 75 % пациентов из всей популяции, поскольку после хирургического лечения полная клиническая и биохимическая ремиссия достигается лишь у 25 % больных [7]. Интересен тот факт, что до сих пор нет опубликованных данных в отношении оценки взаимосвязи долговременной медикаментозной терапии и уровня смертности в популяции пациентов с акромегалией. Логично предположить, что снижение уровня смертности может быть достигнуто посредством применения любой терапии, способной эффективно нормализовать уровни ГР и ИФР-1 в сыворотке крови больных [8]. Гормональное медикаментозное лечение представляет собой основу долговременной терапии, поскольку его эффективность в отношении снижения уровня биохимических маркеров заболевания в сыворотке крови пациентов доказана во многих исследованиях. Препаратом первого выбора являются депо-формы синтетических аналогов соматостатина (АС; октреотид и ланреотид), имеющие сродство к соматостатиновым рецепторам на поверхности клеток аденомы 2-го и 5-го подтипов. В целом депо-формы АС обладают сходной эффективностью в отношении контроля клинических и биохимических маркеров заболевания [9] и позволяют достигать полной ремиссии приблизительно среди 50 % пациентов [10].
Парадигма лечения акромегалии представляет собой последовательность выбора лечебной стратегии, в которой просматриваются как однозначные, так и недостаточно уточненные этапы (рис. 1) [11]. Наиболее неясным с клинической точки зрения является определение “неконтролируемых” по результатам медикаментозного лечения пациентов. Одной из форм “неконтролируемости” заболевания является понятие частичной резистентности к терапии АС. Фактор полной “неконтролируемости” заболевания в отношении октреотида или ланреотида устанавливается сравнительно просто: если после 4–6 регулярных инъекций максимальных зарегистрированных дозировок препаратов с интервалом 1 раз в 28 дней уровни ГР и ИФР-1 существенно не отличаются от долечебных значений или превышают их, значит, речь идет о первичной нечувствительности к данному виду терапии. Если же в результате указанного лечения происходит значимое снижение уровней ГР и ИФР-1, но значения маркеров не достигают пределов нормы, имеет место клиническая ситуация, которую обозначают как частичную резистентность к терапии АС.
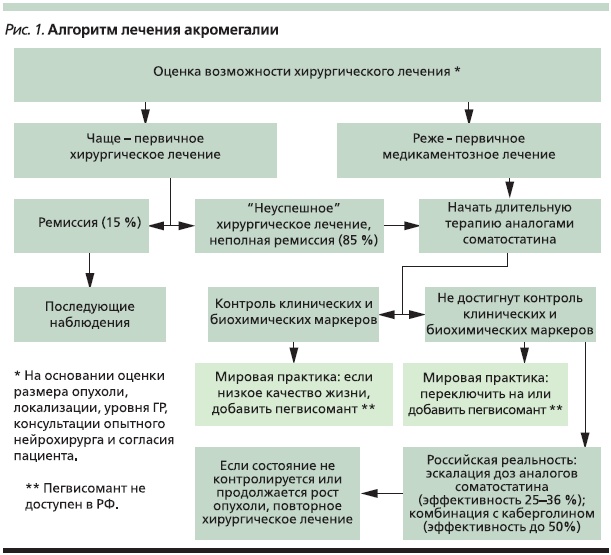
Частичная резистентность к терапии АС представляет собой серьезную проблему, в которой можно выделить клиническую и организационную составляющие. Если рассматривать ее клинический аспект, то следует особо выделить возможность существования первичной частичной резистентности к терапии АС. Он отражает своеобразие морфологического строения опухоли и сравнительно низкий уровень экспрессии рецепторов 2-го и 5-го подтипов, а также риск формирования вторичной частичной резистентности по мере увеличения “стажа” заболевания и продолжительности терапии АС за счет снижения чувствительности рецепторов к лекарственным препаратам.
Попытки найти решение данной проблемы велись по трем параллельным направлениям. С одной стороны, был проведен ряд небольших исследований по оценке эффективности увеличения доз октреотида выше предельных зарегистрированных. Кроме того, имеется несколько наблюдений аналогичного подхода к применению ланреотида [12]. С другой стороны, определена возможность эффективного лечения резистентных или частично резистентных к терапии АС пациентов аналогом человеческого ГР (пегвисомантом). Пегвисомант является антагонистом рецепторов ГР и зарекомендовал себя как эффективное средство второй линии медикаментозной терапии [13]. Имеются результаты клинического исследования эффективности комбинации АС и пегвисоманта среди пациентов, частично резистентных к монотерапии АС [14]. В настоящее время препарат находится в стадии регистрации в РФ. Третье направление исследований было посвящено изучению эффектов агонистов дофамина (бромокриптина и каберголина) среди пациентов рассматриваемой популяции, включая анализ эффективности комбинации каберголина с АС [15].
Организационная составляющая проблемы заключается в том, что АС являются относительно дорогостоящими препаратами, а все пациенты в РФ, имеющие инвалидность по акромегалии, получают их в рамках программы льготного лекарственного обеспечения.
Для того чтобы сделать вывод об адекватности выбора тактики лекарственной терапии, следует подробнее остановиться на трех вышеупомянутых клинических подходах к лечению пациентов с частичной резистентностью к АС.
Увеличение доз АС
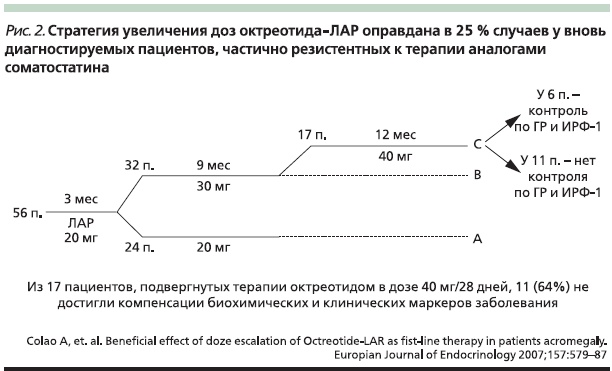
Как упоминалось выше, последовательное повышение доз АС (октреотида) изучено в четырех небольших исследованиях. В одном из них участвовали 56 вновь диагностированных пациентов с акромегалией, которые к моменту включения в исследование 3 месяца получали октреотид ЛАР в дозе 20 мг/раз в 28 дней [16]. В результате лечения 24 пациента достигли компенсации на этой дозировке; 32 пациентам потребовалось повысить дозу через 9 месяцев до 30 мг/28 дней. Из 32 пациентов, получавших дозу 30 мг в течение 9 месяцев, 17 не достигли компенсации на дозе 30 мг и были переведены на дозу 40 мг/28 дней (30 %). Из 17 пациентов, получавших октреотид ЛАР 40 мг в течение 12 месяцев, только 6 достигли контроля заболевания по уровню ИРФ-1 и ГР (рис. 2). Результаты данного исследования свидетельствуют, что стратегия увеличения доз октреотида ЛАР оправданна только в 25 % случаев у вновь диагностированных пациентов, частично резистентных к терапии АС.
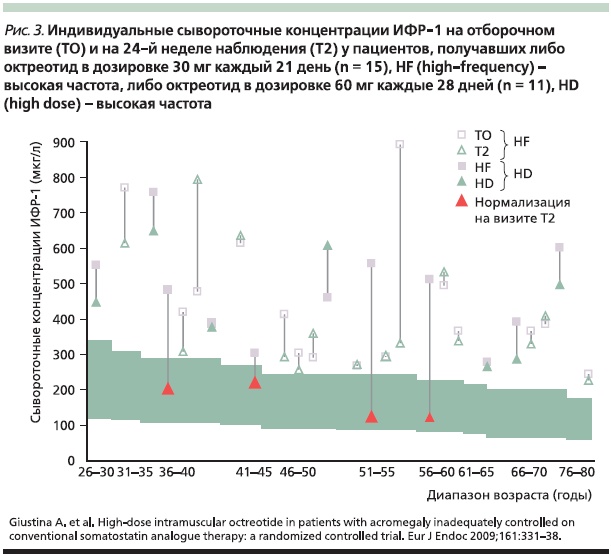
В другом рандомизированном открытом многоцентровом исследовании сравнивали эффективность и безопасность лечения больных неконтролируемой акромегалией октреотидом в дозах 30 мг 1 раз в 21 день и 60 мг 1 раз в 28 дней в течение 6 месяцев [17]. Из 28 включенных в исследование пациентов 26 завершили исследование.
Критерии включения:
• снижение уровней ГР на 50 % и более;
• превышение возрастных и половых значений ИФР-1 при лечении октреотидом ЛАР (30 мг 1 раз в 28 дней) или ланреотидом Аутожель (120 мг 1 раз в 28 дней) в течение 6 месяцев.
Следует также отметить сравнительную малочисленность выборки пациентов, у которых наблюдалось уменьшение опухоли более чем на 20 %. Данные опросников качества жизни продемонстрировали небольшие различия в отношении подшкалы физического состояния в пользу дозировки 30 мг/21 день и очень слабое различие в отношении психического статуса в пользу дозировки 60 мг/28 дней. С точки зрения воздействия на основные маркеры заболевания (ГР и ИФР-1) обнаружено, что лечение октреотидом ЛАР в высоких дозах (60 мг/28 дней) нормализует уровень ИФР-1 у 4 (36 %) из 11 пациентов, не поддающихся контролю максимальными рутинными дозировками октреотида или ланреотида, а ГР – у 3 (27 %) из 11. Ключевой находкой исследования стало значимое снижение уровней ИФР-1 у 90 % пациентов из группы, получавшей октреотид 60 мг/28 дней, по сравнению с его значениями на предыдущей дозе октреотида ЛАР или ланреотида (рис. 3). Однако в этой группе не было отмечено эффекта в плане достижения первичной цели лечения в отношении уровня ГР, при том что именно его значение выше 2,5 ммоль/л является фактором, ассоциированным с увеличением смертности в популяции пациентов с некомпенсированной акромегалией [18].
Следует отметить, что на сегодняшний день в РФ для препаратов октреотида максимальной зарегистрированой дозой является 30 мг/28 дней. Назначение препарата в больших дозировках является своего рода “терапией отчаяния”. Опыт применения ланреотида в дозах, превышающих 120 мг, с интервалом введения 1 раз в 3 недели сводится к ограниченному числу описанных клинических случаев. У двух пациентов с акромегалией, имевших противопоказания к хирургическому лечению, доза ланреотида была последовательно повышена до 180 мг каждые 3–4 недели в течение 3–6 месяцев [19]. У этих пациентов наблюдалось уменьшение объема опухоли без увеличения числа нежелательных побочных эффектов. Клиническое использование высоких доз ланреотида Аутожеля было описано также у 6 пациентов, которым доза препарата была доведена до 180 мг в месяц в двух других клинических исследованиях [20, 21].
Завершая обзор этого лечебного подхода, следует подчеркнуть, что потенциал длительного применения АС в дозировках, превышающих максимальные зарегистрированные, еще не был системно оценен в формате проспективного рандомизированного исследования в отношении контроля уровня ГР, эффекта уменьшения объема опухоли и профиля безопасности лечения [12]. Важно оценить и соотношение “затраты–эффективность” по сравнению с другими вариантами медикаментозной терапии (например, комбинированного лечения) [12].
Применение пегвисоманта и комбинации АС с пегвисомантом пациентами, частично резистентными к монотерапии АС
Второе направление исследований посвящено изучению эффектов препарата второй линии – антагониста ГР (пегвисоманта) и комбинации АС с этим препаратом. Доказано, что препарат эффективен в качестве монотерапии (ежедневные инъекции в средней дозе до 20 мг). При этом нормализация уровня ИФР-1 была достигнута 87 (97 %) из 90 пациентов в течение 12 и более месяцев лечения [13]. Обнадеживающие результаты получены при исследовании эффективности комбинации АС с пегвисомантом среди пациентов, частично резистентных к монотерапии АС, получавших ежемесячные инъекции октреотида ЛАР или ланреотида Аутожеля в максимальных зарегистрированных дозах. Исследована эффективность схемы АС (1 раз в месяц) + пегвисомант (1–2 инъекции в неделю ~ 60 мг) [22]. В результате другого исследования обнаружено, что нормализация уровня ИФР-1 у 18 (95%) из 19 пациентов достигается через 42 недели. При продолжении терапии в течение 2,5 лет контроль заболевания был достигнут среди 100 % пациентов [25].
Агонисты дофамина (АД): бромокриптин или каберголин в комбинации с АС
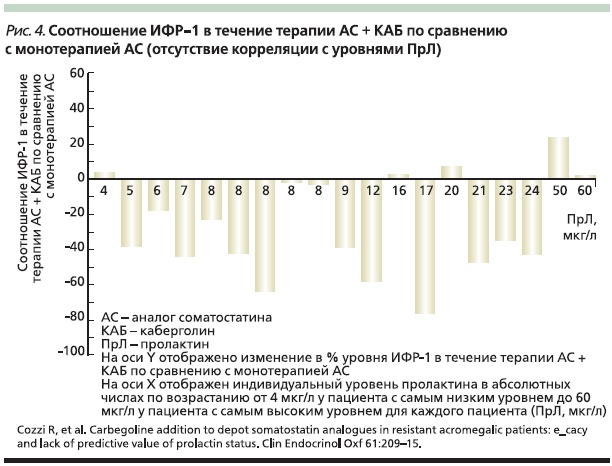
Установлено, что монотерапия АД производит выраженный эффект, если аденома гипофиза экспрессирует также пролактин. В качестве монотерапии каберголин в недельной дозировке 1–3 мг нормализует уровень ИФР-1 у 20–30 % пациентов и способствует уменьшению объема опухоли [24]. Эффективность комбинации каберголина с АС изучена в ряде клинических исследований. Например, в открытом проспективном исследовании участвовали 19 пациентов с акромегалией, резистентных к терапии АС. На фоне проводимого лечения частично снижались уровни ГР и ИФР-1, но “безопасный” уровень ГР и нормальный уровень ИФР-1 все же не были достигнуты. У 8 пациентов пролактин был выше 15 мкг/л. Всем больным в дополнение к терапии АС был назначен каберголин [25]. В результате комбинированной терапии ГР снизился < 2,5 мкг/л у 4 (21 %) человек, ИФР-1 нормализовался у 8 (42 %) пациентов. Снижение уровней как ГР, так и ИФР-1 было отмечено у 9 (47 %), уменьшение одного из параметров – у 6 (32 %) пациентов, без изменений – у 2 и ухудшение также у 2 больных. Было подчеркнуто, что результаты не зависели от уровня пролактина перед началом лечения. Индивидуальные изменения уровня ИФР-1 в результате комбинированной терапии (в процентах к значениям при монотерапии АС) представлены на рис. 4. На основании результатов исследования был сделан вывод, что добавление каберголина к лечению депоформами АС позволяет достигать нормализации уровня ИФР-1 среди 42 % пациентов из всей исследованной группы. С учетом бoльшей доступности (в т. ч. и с точки зрения затратности) каберголина по сравнению с пегвисомантомкомбинированный алгоритм лечения может быть рассмотрен в качестве эффективного решения для пациентов, частично или существенно резистентных к монотерапии АС.
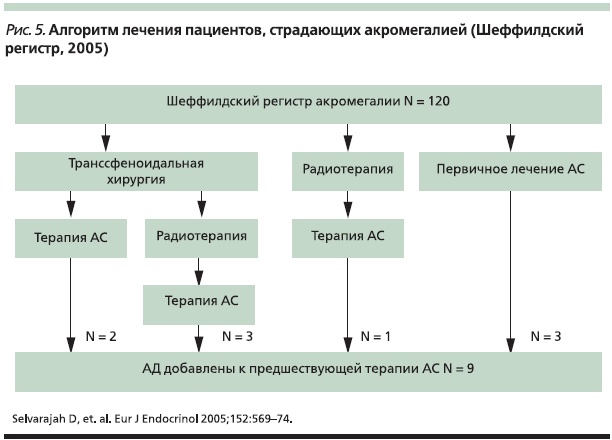
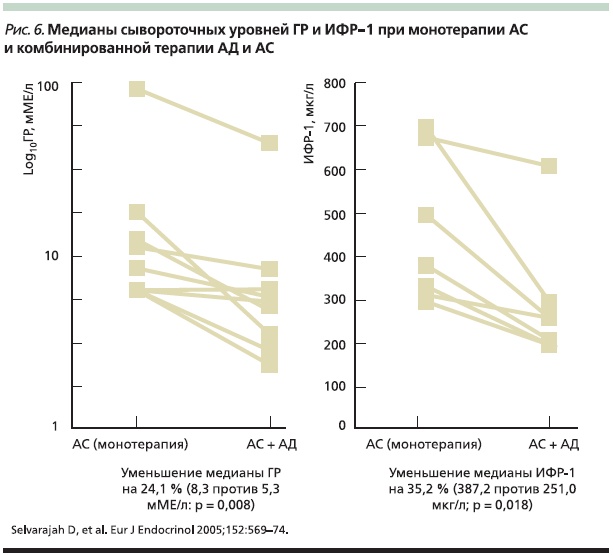
Эффективность добавления АД к АС пролонгированного действия также оценена в ретроспективном обзоре Шеффилдского регистра акромегалии [26]. При этом с целью выявления возможных взаимосвязей были исследованы следующие критерии: распределение пациентов, дата постановки диагноза, подробности хирургической операции и лучевой терапии, начало/ прекращение лечения, средний уровень ГР (среднее значение из 5 образцов крови в течение дня), ИФР-1 и пролактина. В результате анализа перечисленных данных 9 пациентов были переведены на комбинированную терапию АД + АС (рис. 5). Сравнение медиан ГР и ИФР-1 показало, что добавление АД к терапии АС позволяет достигать снижения ГР на 24 %; а уровня ИФР-1 – на 35 % (рис. 6).
Поиск исследований по монотерапии каберголином и добавлению каберголина к терапии АС при акромегалии, опубликованных на ресурсах Pubmed, Pascal, Embase, Google Scholar, позволил выбрать 15 работ (11 – проспективных) с участием 237 пациентов [27]. В 9 исследованиях изучали эффективность каберголина в качестве монотерапии: 51 (34 %) из 149 пациентов достигли нормализации уровня ИФР-1. В пяти исследованиях оценивали эффективность комбинации каберголина и АС: 40 (52 %) пациентов достигли нормализации уровня ИФР-1. Также было подчеркнуто, что эффект поддерживался среди пациентов с нормопролактинемией. Общий вывод сводится к тому, что комбинация АД и АС в терапии частично резистентных к монотерапии АС пациентов позволяет эффективно контролировать заболевание у 50 % больных.
На базе Эндокринологического диспансера Департамента здравоохранения Москвы и Первого МГМУ им. И.М. Сеченова с 2003 г. функционирует Московский регистр больных акромегалией, который позволяет оптимизировать процесс динамического наблюдения за пациентами ипроводить систематический мониторинг назначаемого лечения. В настоящее время регистр включает 364 больных акромегалией и гипофизарным гигантизмом. Всем пациентам проводится длительное лечение с активным динамическим контролем. Популяция больных, частично резистентных к терапии АС, составляет 85 человек. Все эти пациенты по медицинским показаниям получали препараты АС с постепенным увеличением дозы октреотида ЛАР до 40 мг в месяц. При этом оценка профиля ИФР-1 позволила констатировать отсутствие контроля заболевания у большинства из них и его прогрессирование у ряда пациентов даже на фоне повышения дозировки препарата. Достижение “безопасных” уровней ИФР-1 наблюдалось лишь для 7 (18 %) больных этой группы.
Выбор тактики лечения при первично существующей или сформировавшейся с течением времени частичной резистентности к терапии АС должен быть обусловлен рядом факторов, в первую очередь клинической эффективностью и экономической рентабельностью. Представляет значительный клинический интерес сравнительная оценка эффективности комбинации различных АС с каберголином в рамках проспективного исследования с участием российских пациентов.
Интересную терапевтическую возможность с точки зрения клинического эффекта может представлять перевод пациентов, не достигших клинического и биохимического улучшения на фоне длительного лечения сверхмаксимальными дозами октреотида (Сандостатин ЛАР, Октреотид-депо), на максимальную дозировку ланреотида (Соматулин Аутожель) в комбинации с каберголином (Достинекс). Комбинация ланреотида и каберголина позволит, согласно имеющимся данным, снизить затраты на лечение и достигнуть эффективного контроля заболевания у бoльшего числа пациентов (не менее 50 %) [27], чем при изолированном увеличении доз АС (не более 30 %) [12]. Таким образом, можно предположить, что комбинация ланреотида с каберголином (Соматулин Аутожель + Достинекс) может быть более приемлемой по соотношению “затраты–эффективность”.
В настоящее время представленная популяция пациентов с акромегалией из Московского регистра переведена с препарата Сандостатин ЛАР в дозировке 40 мг/28 дней на Соматулин Аутожель в дозе 120 мг/28 дней в комбинации с каберголином 2–3 мг в неделю. Проводится наблюдение за больными с регистрацией динамики клинических симптомов и биохимических маркеров заболевания.
Принимая во внимание тот факт, что ланреотид (Соматулин Аутожель) имеет линейный фармакокинетический профиль [28], а минимальная терапевтическая концентрация в сыворотке крови устанавливается после 4 последовательных инъекций с интервалом в 28 дней [29], максимального клинического эффекта следует ожидать по прошествии этого времени (через 4–6 месяцев). Согласно опубликованным результатам клинических исследований, эффективность лечения может увеличиваться в течение последующих месяцев, достигая максимальных значений через год после начала лечения ланреотидом [30].
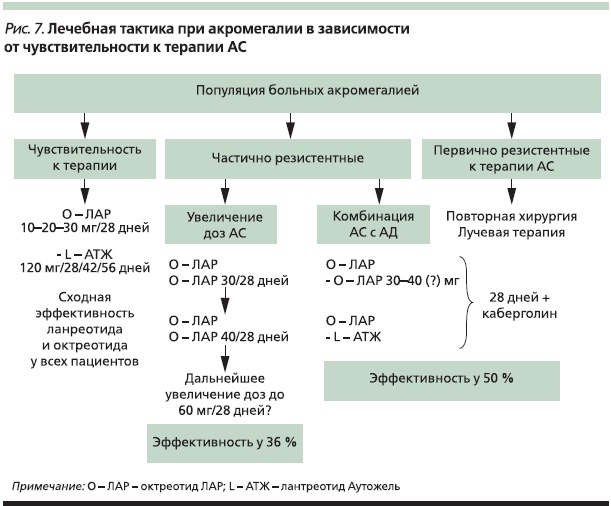
Таким образом, использование регистра дает возможность проведения ретроспективного анализа московской популяции пациентов с акромегалией, частично резистентных к терапии АС. Это очень важно, особенно для того чтобы оценить динамику прогрессирования заболевания, выявить закономерности его течения, наметить пути повышения эффективности лечения. Данные проспективного наблюдения также будут иметь определенную ценность в плане разработки алгоритма эффективного лечения пациентов, частично резистентных к монотерапии АС. В плане повышения эффективности медикаментозного лечения этой категории больных может быть предложена комбинация максимальной зарегистрированной дозировки АС и АД (рис. 7).
Информация об авторе:
Анциферов Михаил Борисович – доктор медицинских наук, профессор, главный врач Эндокринологическогодиспансера Департамента здравоохранения Москвы. E-mail: antsiferov@rambler.ru
Пронин Вячеслав Сергеевич – кандидат медицинских наук, доцент кафедры эндокринологии ГОУ ВПО “Первый МГМУ им. И.М. Сеченова”
Алексеева Татьяна Марковна – врач-эндокринолог, заведующая отделением эндокринологии Московского городского диспансера


