Актуальность проблемы
Рак предстательной железы (РПЖ) в настоящее время считается одной из самых серьезных проблем мужского населения. В Европе РПЖ является наиболее распространенной злокачественной опухолью, заболеваемость которой составляет 214 случаев на 100 тыс. мужчин [1]. В РФ первичная заболеваемость РПЖ в последнее время стремительно возрастает. В 2012 г. было зарегистрировано 29 082 новых случая при приросте заболеваемости 157,78% за 10 лет [2].
Эпидемиологическая ситуация осложняется тем, что более половины впервые выявленных случаев РПЖ диагностируются уже на стадии местнораспространенного – 35,3% – и метастатического рака – 17,8% [3, 4].
Андрогенная депривационная терапия (АДТ) – один из основных методов консервативного лечения распространенных форм РПЖ и более чем 80% больных позволяет стабилизировать процесс [5]. Однако в течение 2 лет у таких пациентов может развиваться резистентность к гормональным методам воздействия в форме кастрационно-резистентного рака предстательной железы (КРРПЖ) [6–8]. Ответ на АДТ продолжается в среднем 18–24 месяцев, после чего отмечается переход болезни в стадию кастрационной резистентности.
К одним из перспективных и недостаточно изученных направлений в лечении КРРПЖ относится назначение комбинированной терапии аналогами соматостатина длительного действия (октреотид) и дексаметазоном на фоне АДТ [9].
Соматостатин – ингибирующий пептид с экзокринной, эндокринной, паракринной и аутокринной активностью (выделен в 1973 г.), включает группу пептидов, содержащих 14 и 28 аминокислот. В настоящее время идентифицировано не менее 5 типов соматостатиновых рецепторов (SSTR 1–5), располагающихся на плазматической мембране клеток. Клетки ряда опухолей и их метастазы экспрессируют рецепторы соматостатина с высокой плотностью, существенно превышающей их плотность на клетках нормальных тканей. Наибольшая экспрессия соматостатиновых рецепторов (2-го и 5-го типов) наблюдается в нейроэндокринных клетках КРРПЖ. Нейроэндокринные клетки присутствуют в нормальной ткани предстательной железы, и их находят на всех стадиях РПЖ. Рецепторы соматостатина и его аналогов служат потенциальными мишенями при лечении РПЖ. Аналоги соматостатина, например октреотид, ингибируют рост рака простаты в эксперименте, оказывая непрямой антигормональный (за счет обратной связи) и прямой антимитотический эффекты, связанные с ингибированием соматостатиновых рецепторов [10, 11].
Потенциальный противоопухолевый эффект аналогов соматостатина может быть связан с торможением клеточного роста и ангиогенеза в опухоли, а также с увеличением интенсивности апоптоза опухолевых клеток. Ингибирующие эффекты на клеточном опухолевом уровне предположительно основаны на прямом действии, зависящем от экспрессии опухолью рецепторов к соматостатину и непрямом, имеющем значение в регуляции нормальных клеток, экспрессирующих рецепторы к соматостатину.
Имеется ряд клинических исследований, показывающих эффективность и безопасность применения аналогов соматостатина с дексаметазоном, на фоне АДТ у больных КРРПЖ [12, 13].
Цель исследования
Целью исследования была оценка эффективности препарата октреотид в пролонгированной форме выпуска в зависимости от применяемой дозы (20 или 30 мг) путем изучения динамики уровня простатического специфического антигена (ПСА), оценки влияния препарата на статус активности пациентов, уровня болевого синдрома и метаболических изменений, оценки эффективности в зависимости от гистологического типа опухоли и количества костных метастазов, проведения мониторинга побочных эффектов.
Материалы и методы
С января 2010 по декабрь 2014 г. на базе Городской больницы № 57 проведено исследование, которое включило 92 пациента с КРРПЖ, получавших лечение аналогом соматостатина октреотидом (пролонгированная форма выпуска) в комбинации с дексаметазоном на фоне хирургической или медикаментозной кастрации.
Средний возраст больных составил 67,4 года (от 51 до 81 года). Пациенты были распределены на 2 группы в зависимости от дозировки октреотида: 1-я группа –37 больных, которым проводилась терапия октреотидом 20 мг в комбинации с дексаметазоном; 2-я группа – 55 больных, получавших октреотид 30 мг в комбинации с дексаметазоном. Пациенты обеих групп получали препарат октреотид в пролонгированной форме внутримышечно 1 раз в 28 дней в сочетании с пероральным применением дексаметазона: 4 мг/сут в течение первого месяца, 2 мг/сут в течение следующих 2 недель терапии, затем 1 мг/сут в качестве поддерживающей дозы до конца курса лечения.
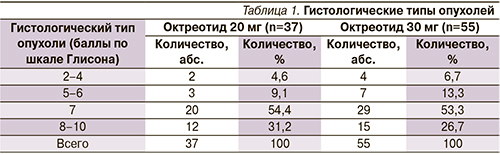
Среднее время от момента установленного диагноза до формирования гормонрезистентной фазы заболевания составило 22 месяца в 1-й группе, 24,3 месяца – во 2-й. При гистологической верификации диагноза преобладали умеренно- и низкодифференцированные формы РПЖ (табл. 1).
Среди пациентов 1-й группы местно-распространенный РПЖ (Т3–4N0M0) был диагностирован у 3 (9,1%), лимфогенно-диссеминированный (N1–M0) – у 5 (13,6%) и метастатический (N0–1M1) – у 28 (75%) пациентов. Во 2-й группе стадия Т3–4N0M0 верифицирована у 4 (6,7%) больных, N1M0 – у 7 (13,3%) и N0–1M1 – у 44 (80%). Средний уровень ПСА в 1-й группе составил 127,5 ± 240,6, во 2-й – 145,5 ± 359,5 нг/мл. Данные представлены в табл. 2.
Группы были однородными по возрасту больных и клинической стадии процесса; наблюдались достоверные различия по уровню ПСА. Перед началом лечения всем пациентам определены статус активности по шкале Карновского и оценка болевого синдрома по шкале ВОЗ. Шестьдесят девять больных были включены со статусом активности 80–100%, 16 со статусом активности 60–70% и 7 со статусом активности 50–60%. Данные по статусу активности представлены в табл. 3.

Большинство больных страдали болевым синдромом, 28 пациентов не нуждались в обезболивании. Нерегулярно принимали ненаркотические анальгетики 42 (45,7%) пациента, 18 (19,6%) больных нуждались в постоянном приеме ненаркотических анальгетиков и 4 (4,3%) периодически принимали наркотические анальгетики для снижения болевого синдрома. Данные представлены в табл. 4.
Эффективность лекарственного лечения оценивали после каждого курса комбинированной терапии, осуществляя гематологический контроль, определение уровня ПСА сыворотки крови, оценку качества жизни и уровня болевого синдрома, а также контроль метаболических изменений по модели IDF (от 2005 г.).
При положительном ответе на лечение комбинированную терапию продолжали до момента наступления прогрессирования (увеличение размеров и количества метастатических очагов или появление новых или 3 последовательных повышения уровня ПСА).
К положительному эффекту относили снижение или стабилизацию уровня ПСА сыворотки крови, положительную динамику показателей общего и биохимического анализа крови, снижение уровня болевого синдрома и улучшение качества жизни пациента.
Результаты и обсуждение
Результаты исследования показали, что в группе больных, получавших октреотид 20 мг, количество курсов варьировалось от 2 до 12 (среднее 6,2±3,3). Во 2-й группе количество циклов было от 3 до 13 (среднее – 7,7± 3,4). Медиана времени до появления признаков прогрессирования составила 5 (2–13) и 7 (1 –10) месяцев в группах соответственно. По завершении исследования проведен мониторинг количества циклов введения препаратов в зависимости от гистологического типа опухоли и от количества костных метастазов (табл. 5 и 6).
Снижение уровня ПСА >50 % от исходного уровня в 1-й группе отмечено у 15 (40,7%) и у 28 (51,1%) больных во 2-й соответственно. У 5 (14,4%) пациентов, получавших октреотид 20 мг, и у 8 (15,6%) на фоне приема октреотида 30 мг отмечено снижение уровня ПСА >80 %. Стабилизация заболевания отмечена у 8 (22,2%) больных в 1-й группе и 11 (20%) – во 2-й (табл. 7).
При оценке градации боли число пациентов, не требующих приема анальгетических препаратов, в 1-й группе увеличилось на 4,5%, во 2-й – на 10% на фоне проводимой терапии. В то же время полностью отказаться от приема наркотических препаратов с целью обезболивания никто не смог. В целом следует отметить снижение градации болевого синдрома у 16,2% (6 из 37) во 2-й группе против 9,1% (5 из 55) пациентов в 1-й.
Положительная динамика наблюдалась также и в изменении статуса активности больных. Изменение статуса активности в положительную сторону произошло у 3 (9%) пациентов 1-й группы и у 7 (13,3%) в группе октреотида 30 мг. Данные отражены в табл. 8.

При оценке метаболических изменений каких-либо значимых отклонений не наблюдалось у больных обеих групп, за исключением гипергликемии, наблюдавшейся у 6 (16,2%) пациентов 1-й группы и у 13 (23,6%) 2-й. Коррекция углеводного обмена у этих пациентов достигнута использованием диетического стола № 9 и лишь у 2 (5,4%) больных 1-й группы и 4 (7,2%) во 2-й – дополнительным применением пероральных сахароснижающих препаратов.
Следует отметить, что повышение ПСА в течение первых двух месяцев не более чем на 50% (при ПСА <20 нг/мл) и не более чем на 25% (при ПСА >20 нг/мл) не служит поводом для отмены препаратов. Уменьшение боли в костях, улучшение качества жизни и статуса активности пациента – критерии продолжения лечения. Результаты нашего исследования свидетельствуют о том, что уровень ПСА является прогностическим фактором, но не может служить достаточным основанием для отказа от намеченноголечения.
При проведении исследования нами опробована схема ступенчатой терапии, а именно перевод ряда больных с 20 на 30 мг октреотида. Такой переход осуществлялся на разных сроках лечения в случае отсутствия или недостаточного эффекта от использования дозировки 20 мг. Данная методика позволила пролонгировать курс применения октреотида пациентам, но уже в увеличенной дозе.
Лечение больных октреотидом в пролонгированной форме как в 1-й, так и во 2-й группах не сопровождалось какими-либо серьезными специфическими побочными токсическими реакциями.
Выводы
Применение аналога соматостатина октреотида, его пролонгированной формы, на фоне андрогенной абляции приводит к достижению объективного эффекта, позволяя отодвинуть сроки начала химиотерапии или иных дорогостоящих методов лечения КРРПЖ.
В ходе исследования отмечена большая эффективность октреотида в дозировке 30 мг – положительный ответ на лечение (снижение или стабилизация ПСА, симптоматический эффект) отмечен почти у 80% больных.
Применение октреотида 30 мг имеет удовлетворительный профиль переносимости, что немаловажно при использовании препарата пожилыми и ослабленными пациентами.



