По данным FDA (Food and Drug Administration), непрямые антикоагулянты (НАК) входят в десятку препаратов, наиболее часто вызывающих осложнения. При этом кровотечения – пожалуй, самое частое и опасное из них. Частота их развития в различных клинических исследованиях с применением НАК составляла примерно 2,0 % (от 1,0 до 7,4 %).
Все кровотечения, осложняющие терапию НАК, принято разделять на три категории:
1) смертельные;
2) тяжелые (требующие для их остановки хирургического вмешательства, переливания эритроцитарной массы или сопровождающиеся снижением систолического артериального давления (АД) ниже 90 мм рт. ст. с олигурией или падением уровня гемоглобина более чем на 2 г/л);
3) нетяжелые кровотечения (все остальные).
Внутричерепные кровоизлияния (ВЧК) – наиболее опасные из всех геморрагических осложнений терапии НАК. Считается, что прием варфарина увеличивает риск ВЧК в 8–10 раз [1, 2]. Их частота, по данным разных авторов, составляет около 0,3–1,0 % в год, а доля среди всех ВЧК – от 6 до 24 % [3–5]. На внутримозговые кровоизлияния приходится 70 % от всех варфарин-ассоциированных ВЧК, оставшиеся 30 % – это субдуральные и субарахноидальные кровоизлияния [1]. Хотя риск возрастает с увеличением международного нормализованного отношения (МНО), большая часть варфарин-ассоциированных ВЧК отмечается в период, когда МНО находится в пределах терапевтического диапазона [6–9]. ВЧК на фоне терапии варфарином встречаются несколько чаще и при меньшей степени гипокоагуляции у азиатов, африканцев и испанцев, чем у лиц белой расы [10, 11].
При варфарин-ассоциированных ВЧК смертность достигает 67 %, что приблизительно в 2 раза выше, чем у больных, у которых кровоизлияние возникло без участия антикоагулянтов [1, 9, 12]. На варфарин-ассоциированные ВЧК приходится до 90 % смертности от всех варфарин-ассоциированных кровотечений. M.C. Fang и соавт. [13] проанализировали данные 13 559 взрослых пациентов с мерцательной аритмией (МА) неревматического генеза. Было выявлено 72 случая ВЧК и 98 тяжелых экстракраниальных кровотечений. На момент выписки 76 % больных ВЧК имели тяжелую степень инвалидности или умерли.
Оценка риска развития ВЧК
Следует помнить, что риск геморрагических осложнений при лечении НАК есть у всех больных, но также совершенно очевидно, что степень риска у них различна. И самое сложное – это учет всех фактов ‘за” и “против” назначения НАК, т. е. принятие в конечном счете решения по поводу соотношения риска и пользы лечения. Для решения вопроса о целесообразности и безопасности терапии антикоагулянтами для конкретного больного необходимо оценить риск геморрагических осложнений. В настоящее время наиболее часто используются шкалы HEMORR2HAGES и HASBLED (табл. 1, 2).
Примечание. АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ВГН – верхняя граница нормы, НПВС – нестероидные противовоспалительные средства, АГ – артериальная гипертензия.
Примечание. АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ВГН – верхняя граница нормы; ЩФ – щелочная фосфатаза, АГ – артериальная гипертензия.
Шкала HEMORR2HAGES предложена коллективом из Вашингтонского университета для оценки риска тяжелых кровотечений [14]. Она составлена на основании анализа результатов NRAF (National Registiy of Atrial Fibrillation). В анализ вошли результаты обследования 3971 больного МА. За год наблюдения тяжелые кровотечения возникли у 162 из 3138 больных, из них у 67,3 % отмечены желудочно-кишечные, у 15,4 % – ВЧК и у 17,3 % – кровотечения другой локализации. В шкалу HEMORR2HAGES помимо используемых ранее факторов риска были добавлены генетические факторы. Риск геморрагических осложнений существенно возрастал при увеличении числа баллов всего на одну единицу: 1 балл – 2,2 % в год, 2 балла – 4,4 %, 5 баллов и более – 12,3 %. Сравнение с предлагавшимися ранее шкалами оценки риска геморрагических осложнений показало преимущество шкалы HEMORR2HAGES.
Позднее на основании анализа данных того же регистра больных (NRAF) разработана еще одна шкала оценки риска геморрагических осложнений у больных, получающих антитромботическую терапию по поводу мерцательной аритмии, – HAS-BLED [15]. Данная шкала выгодно отличается от HEMORR2HAGES своей простотой. Каждый фактор дает 1 балл, за исключением некоторых. Максимальная сумма баллов – 9. Согласно шкале HAS-BLED, так же как и HEMORR2HAGES, риск геморрагических осложнений существенно возрастает при увеличении числа баллов: 1 балл – 1,02 % в год, 2 балла – 1,88 %, 3 балла – 3,74 %, 4 балла – 8,70 %, 5 баллов и более – 12,5 %. Предсказательная ценность этих двух шкал у больных, принимающих НАК, оказалась сходной. Шкала HAS-BLED вошла в официальные рекомендации Европейского общества кардиологов по ведению больных мерцательной аритмией в качестве основной для оценки риска развития геморрагических осложнений на фоне терапии антикоагулянтами [16].
Расчет риска кровотечения при помощи описанных шкал и сравнение его с риском тромбоэмболических осложнений (ТЭО) позволяют принимать взвешенное решение о целесообразности назначения антикоагулянтов каждому конкретному больному. К сожалению, специфических шкал для оценки риска именно ВЧК на фоне терапии варфарином или другими НАК в настоящее время не существует.
Диагноз ВЧК
Появление у больного, получающего НАК, резкой головной боли преимущественно в затылочной области, тошноты, рвоты, не приносящей облегчения, несистемного головокружения, а также оглушенного сознания является основанием для немедленного исключения диагноза ВЧК. Симптомы кровоизлияния обычно развиваются внезапно [3, 7, 17–19], причем в первую очередь могут развиться менингеальный синдром и субфебрилитет. Уже в первые часы признаки ВЧК можно определить с помощью компьютерной или магнитно-резонансной томографии (МРТ). Высокочувствительной методикой является МРТ с использованием градиентного эхо [1, 20, 21].
Патофизиология
R.G. Hart и соавт. [22] высказали гипотезу о том, что использование НАК всего лишь демаскирует ВЧК, которые в другом случае остались бы бессимптомными, особенно у больных АГ или цереброваскулярной болезнью; несколько обсервационных исследований подтверждают это предположение. Во-первых, МРТ в режиме градиентного эхо показывает, что микрокровоизлияния, являющиеся одним из факторов риска ВЧК на фоне применения антитромботических препаратов [23, 24], могут выявляться даже у лиц без острой неврологической симптоматики – как правило, пожилых и страдающих АГ [25].
Во-вторых, церебральная амилоидная ангиопатия, которая наиболее часто обнаруживается у людей старше 65 лет, наряду с возрастом является одним из факторов риска и спонтанных, и варфарин-ассоциированных ВЧК [26, 27].
В-третьих, данные исследований SPIRIT (Stroke Prevention in Reversible Ischemia Trial) и EAFT (European Atrial Fibrillation Trial) показывают, что пациенты с уже имеющейся цереброваскулярной болезнью имеют значительно более высокий риск варфарин-ассоциированных ВЧК [28, 29], а наличие очаговых или диффузных гиподенсивных изменений в глубоких слоях белого вещества (т. н. лейкоареозис) является независимым предиктором варфарин-ассоциированных ВЧК [30]. Кроме того, локализация спонтанных и варфарин-ассоциированных ВЧК совпадает [4, 12]. Таким образом, причины, лежащие в основе обоих вариантов кровоизлияний, могут бытьодними и теми же, а использование НАК действует лишь как усугубляющий фактор.
По данным J.J. Flibotte и соавт. [19], связи между исходным размером гематомы и приемом варфарина не обнаружено. Предикторами большего исходного объема гематомы являются гипергликемия (p < 0,0001) и лобарная локализация кровоизлияния (p < 0,0001).
Известно, что почти у половины больных со спонтанными ВЧК происходит медленное увеличение размеров гематомы в течение первых 12–14 часов, что сопровождается усугублением неврологического дефицита [3, 7, 18, 19, 31–33]. Считается, что рост гематомы может быть результатом продолжающегося кровотечения, рецидива кровотечения или вторичного кровотечения вокруг первичного очага.
Особенности лечения больных ВЧК, развившимся на фоне приема НАК
Рандомизированных исследований по оценке клинических исходов лечения ВЧК, развившихся на фоне лечения варфарином, нет, а рекомендации базируются главным образом на данных обсервационных исследований и соглашении экспертов. Краеугольным камнем в лечении таких больных считается коррекция гипокоагуляции. Согласно данным ретроспективных исследований, чем быстрее удается снизить уровень МНО, тем лучше исход заболевания. Оптимально, если гемостатическая терапия начата в первые 4 часа от развития кровоизлияния [10, 34–36]. Для коррекции гипокоагуляции в настоящее время используют фитоменадион или менадион, свежезамороженную плазму (СЗП) и концентрат протромбинового комплекса (КПК). Рекомендуется снижение МНО до уровня 1,2 или ниже [37–39].
Фитоменадион (витамин K1) следует назначать всем больным с целью поддержания эндогенного синтеза факторов свертывания. Нормализация уровня МНО после приема фитоменадиона происходит через 6–24 часа. Начальная доза составляет 10 мг внутривенно (в/в). В дальнейшем каждые 12 часов можно повторно вводить 5–10 мг препарата до достижения суммарной дозы 25 мг [18]. Скорость введения составляет 1 мг/мин. Подкожное введение может быть более безопасным, но эффект наступает еще медленнее и он менее предсказуем [40–42]. К сожалению, в России фитоменадион в настоящий момент не зарегистрирован, на данный момент доступны лишь таблетированная и парентеральная формы менадиона (витамин K3). Хотя не существует общепринятых рекомендаций по замене фитоменадиона на менадион, в наших условиях его применение, вероятно, может быть оправданным. Менадион назначают в дозе 15–30 мг/сут внутрь или 10–15 мг/сут внутримышечно (в/м).
СЗП содержит все факторы свертывания в неконцентрированном виде и широко используется для коррекции факторов свертывания. Объем СЗП, требуемый для полного устранения гипокоагуляции, достаточно высок (чаще всего 2–4 л, особенно при значительном увеличении МНО) и является главным ограничивающим фактором. Кроме того, для значимого повышения уровня факторов свертывания крови в плазме больного ее необходимо вводить с большой скоростью, что увеличивает риск объемной перегрузки [42, 43]. Расчет объема СЗП (в мл), требуемого для прекращения действия варфарина, основывается на исходном МНО, целевом МНО и на массе тела больного [44, 45]. Сопоставление уровня МНО и предполагаемого содержания факторов протромбинового комплекса (ФПК) приведено в табл. 3. Расчет объема СЗП, которую необходимо перелить, проводится по следующей формуле [44–46]:
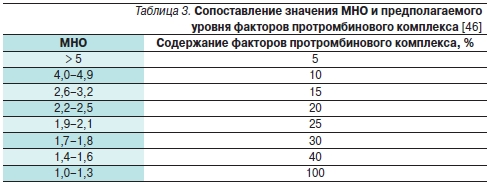
Объем СЗП мл = ФПКцел. % × ФПКисх. % × масса тела кг, где
ФПКисх. – исходная концентрация факторов протромбинового комплекса в плазме больного, ФПКцел. – целевая концентрация факторов протромбинового комплекса.
В Европе для лечения ВЧК, связанных с варфарином, КПК используют более 10 лет [47]. Он содержит факторы II (протромбин), VII, IX, X, ПрC, ПрS и ПрZ. МНО нормализуется уже через 15 минут после 10–60-минутной инфузии [46]. На фармацевтическом рынке известно несколько препаратов: Profilnine HT (Grifols), Konyne 80 (Bayer), Proplex T (Baxter), Bebulin (Baxter). В России на момент написания обзора зарегистрирован только один препарат – Протромплекс 600 (Baxter). Сравнение действия препаратов КПК в рандомизированных исследованиях крайне затруднительно вследствие разного содержания в них компонентов свертывания [46]. Сообщалось об увеличении частоты развития тромбозов при лечении КПК [38, 47], но истинный риск этого осложнения трудно оценить вследствие ретроспективного характера исследований, использования препаратов различных фирм и в разных дозах, с разной степенью коррекции МНО. Так, в 8 исследованиях, в общей сложности включивших 107 больных ВЧК на фоне терапии варфарином, тромбоз был зарегистрирован у 4 (7 %) из 57 больных, смертность в ранние сроки составила 24 % (15 из 64) [18, 38, 48]. Однако, по другим данным, применение КПК при варфарин-ассоциированных ВЧК может быть относительно безопасным [49].
Дозу КПК рассчитывают на основании массы тела, исходного и целевого МНО. Обычно доза составляет от 25 до 50 МЕ/кг. Наиболее простым методом определения дозы является следующий: при МНО 2–3 – 25 МЕ/кг, при МНО 4–6 – 35 МЕ/кг, при МНО > 6 – 50 МЕ/кг [50]. После начальной в/в инфузии 500–1000 МЕ со скоростью 100 МЕ/мин ее продолжают со скоростью 25 МЕ/мин или ниже. МНО необходимо измерить через 30 минут после начала инфузии, чтобы убедиться, что оно нормализовалось; в противном случае должен быть рассмотрен вопрос о продлении инфузии. Фитоменадион (10 мг в/в) должен применяться одновременно с КПК [34, 44, 47]. В отсутствие фитоменадиона вводят менадион (викасол) 15 мг в/м.
Некоторые авторы рекомендуют одновременно использовать низкие дозы нефракционированного гепарина или низкомолекулярных гепаринов для снижения риска тромбозов [38]. Эптаког альфа (активированный; рекомбинантный фактор VIIa – rVIIa), одобренный для лечения геморрагических осложнений у больных гемофилией, в отдельных случаях может также использоваться для лечения больных ВЧК, связанными с варфарином [51–55]. В нашей стране rVIIa зарегистрирован как Коагил-VII (Лекко) и НовоСэвен (Ново Нордиск). Быстрая коррекция МНО продемонстрирована в двух небольших наблюдениях, включивших семь человек с варфарин-ассоциированными ВЧК, которые одновременно получали rVIIa, СЗП и фитоменадион [53, 54].
Остается неясным, насколько точно уровень МНО отражает коагуляционный статус после введения рекомбинантного фактора VIIa. Дело в том, что фактор VIIa временно корректирует дефицит только фактора VII, но не возмещает дефицит других витамин-K-зависимых факторов свертывания. Повторное введение rVIIа необходимо, если одновременно не вводят препараты витамина K или СЗП. В настоящее время Американское общество гематологов (American Society of Hematology) не рекомендует рутинно использовать rVIIа для устранения эффектов варфарина [56]. Кроме того, следует помнить, что редкими, но серьезными осложнениями терапии rVIIа также являются тромбоэмболии [34] и этот факт может осложнять его применение у больных высокого риска ТЭО.
D.K. Nishijima и соавт. [57] сравнивали прогноз у больных, постоянно принимавших варфарин и поступивших в отделение неотложной помощи в связи с травматическим ВЧК, в зависимости от факта применения rFVIIa (n = 40, по 20 в каждой группе). Формально статистически значимых различий в частоте развития ТЭО не было, однако в группе стандартного лечения был зарегистрирован 1 (5,0 %) тромбоэмболический эпизод на 20 больных, а в rVIIа – 4 (20,0 %). Время до нормализации МНО было меньше в группе rFVIIa (4,8 против 17,5 часа в группе стандартного лечения, p < 0,001), что немаловажно для возможности более раннего проведения хирургического вмешательства.
Мониторинг параметров гемостаза
Для мониторинга уровня антикоагуляции традиционно определяют уровень МНО. Однако данный показатель чувствителен к изменению уровней факторов VII, X и протромбина, но не в отношении фактора IX [48, 58–61]. Следовательно, даже при нормализации МНО может сохраняться высокий риск кровотечений. Так, М. Makris и соавт. [58] обнаружили, что применение 800 мл СЗП снижало среднее МНО с 6,73 до 2,38, в то время как средние уровни фактора IX, по сути, оставались неизмененными (исходный уровень – 26,45 МЕ/дл, после лечения – 27,36 МЕ/дл). Использование МНО для мониторинга степени гипокоагуляции у больных, получающих терапию rVIIa, также проблематично. Фармакологические дозы rVIIa всегда буду снижать МНО вне зависимости от уровней других факторов свертывания [59, 61]. В данной ситуации более приемлемым может быть метод тромбоэластографии. В этом случае регистрируется профиль формирования тромба в цельной крови, что дает более полное представление о состоянии свертывающей системы [53, 62, 63].
Хирургическое лечение и коррекция АД
Роль нейрохирургической эвакуации гематомы у пациентов с варфарин-ассоциированными ВЧК в достаточной мере не определена, и большинство нейрохирургов неохотно оперируют в условиях нарушенного гемостаза. Однако с учетом высокой смертности в этой группе больных вопрос о хирургическом лечении после коррекции уровня коагуляции может быть рассмотрен [48].
У госпитализированных больных ВЧК часто наблюдается повышенный уровень АД. Однако существуют значительные разногласия по следующим вопросам: способствует ли высокое АД продолжению кровотечения, может ли снижение АД быть причиной ишемии ткани мозга вокруг гематомы или увеличения ее размеров [64]? Считается, что при спонтанных ВЧК, если систолическое АД > 200 мм рт. ст. или среднее АД > 150 мм рт. ст., обоснованно агрессивное снижение АД путем в/в инфузии антигипертензивных препаратов с частым (каждые 5 минут) мониторированием уровня АД. Если систолическое АД > 180 мм рт. ст. или среднее АД > 130 мм рт. ст. и есть вероятность повышенного внутричерепного давления, рекомендуется мониторинг внутричерепного давления и снижение АД с использованием прерывистой или постоянной в/в инфузии антигипертензивных препаратов для поддержания церебрального перфузионного давления на уровне ≥ 60 мм рт. ст. Если внутричерепное давление не повышено, рекомендуется более медленное снижение АД (цель – АД 160/90 мм рт. ст. или среднее АД 110 мм рт. ст.) [39].
Прогноз при ВЧК
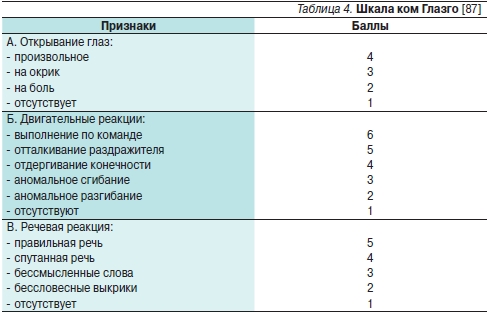
Чем выше уровень МНО в момент госпитализации, тем больше вероятность увеличения размера гематомы, остаточного неврологического дефицита и смерти [3, 17, 46, 65, 66]. Летальный исход отмечается у 2/3 больных ВЧК, если МНО в момент госпитализации превышает 3 [65]. С плохим прогнозом также ассоциируются большой объем гематомы (> 50 мл), распространение кровоизлияния в желудочке (intraventricular extension), а также смещение срединных структур мозга [3, 6, 7]. По данным A.Y. Zubkov и соавт. [67], прогностически неблагоприятными факторами являются низкая сумма баллов по шкале Глазго (табл. 4) в момент поступления и большой изначальный объем гематомы. Развитие неврологического дефицита никак не зависит от уровня МНО при поступлении.
Возобновление антикоагулянтной терапии
Описанные выше меры по коррекции уровня коагуляции могут быть весьма эффективными, но как только кровотечение остановлено, на первое место вновь выходит вопрос риска развития тромбоэмболий. Мнения экспертов о том, когда следует возобновлять антикоагулянтную терапию и следует ли ее возобновлять вообще, расходятся.
Риск повторного ВЧК в течение первых 3 месяцев составляет 1 %, а в дальнейшем – 2–4 % в год, но у больных, продолжающих получать варфарин, риск, вероятно, выше [68–71]. Несколько небольших работ было посвящено риску ТЭО и повторных ВЧК в случае возобновления или полной отмены варфарина [3, 72–76].
По-видимому, решение о возобновлении приема НАК должно основываться на индивидуальной оценке соотношения риска ТЭО и повторных кровоизлияний. Наличие церебральной амилоидной ангиопатии и признаков микрокровоизлияний (по данным МРТ) увеличивает риск повторных геморрагических эпизодов [77].
В случае применения варфарина с целью первичной профилактики ишемического инсульта у пожилых пациентов с МА риск повторных ВЧК может превысить пользу, поэтому мнение больного является немаловажным фактором в принятии решения о продолжении антикоагулянтной терапии. У больных с исходно низким риском ТЭО, которым не требуется возобновления антикоагулянтной терапии, после перенесенного ВЧК рекомендуется ношение эластичных чулок или перемежающаяся пневматическая компрессия ног [39, 78].
У больных с высоким риском ТЭО (протезированные клапаны сердца, МА, ишемический инсульт в анамнезе и др.) риск ТЭО без антикоагулянтной терапии гораздо выше, поэтому лечение НАК следует возобновлять. После нормализации МНО на фоне лечения КПК многие эксперты для профилактики тромбоза глубоких вен нижних конечностей предлагают начинать подкожное введение низких доз нефракционированного гепарина (5000 МЕ 2 раза в сутки) либо низкомолекулярных гепаринов (эноксапарин 40 мг 1 раз в сутки или дальтепарин 5000 МЕ 1 раз в сутки) уже через 48 часов после развития ВЧК, а через несколько дней увеличивать дозу прямых антикоагулянтов до лечебной [77]. Европейский комитет по инсульту рекомендует больным со строгими показаниями к антикоагулянтной терапии возобновлять прием варфарина через 10–14 дней [79], а Американская кардиологическая ассоциация допускает возобновление его приема у лиц с очень высоким риском тромбоэмболий уже через 7–10 дней от развития кровоизлияния [71, 80].
Однако ряд экспертов считают неоправданным использование антикоагулянтного мостика, аргументируя это тем, что ежедневный риск ТЭО у лиц с протезированными клапанами непосредственно после ВЧК достаточно низок – 0,016 % [75].
При особенно высоком риске повторных ВЧК у лиц с МА неклапанного генеза альтернативой может быть прием антиагрегантов [81]. Использование их в сочетании с варфарином вероятнее всего увеличивает риск повторных ВЧК, и эту комбинацию не следует назначать рутинно [82–84].
Интересным представляется анализ, выполненный А. Majeed и соавт. [85]. Проведена оценка истории болезней 2869 пациентов, последовательно госпитализированных в связи с ВЧК. С использованием модели Кокса был подсчитан ежедневный суммарный риск ВЧК и ишемического инсульта при возобновлении терапии варфарином и отказе от него. Отношение шансов развития повторных ВЧК при возобновлении приема варфарина составило 5,6 (95 % доверительный интервал [ДИ] – 1,8–17,2), для ишемического инсульта – 0,11 (95 % ДИ – 0,014–0,890). Суммарный риск обоих состояний был наиболее низким, если прием варфарина возобновляли в период между 10-й и 30-й неделями от перенесенного ВЧК.
Таким образом, в настоящее время трудно говорить о наличии четких рекомендаций по возобновлению терапии варфарином после ВЧК. Слишком много факторов может определять индивидуальный риск повторных кровотечений или тромбоэмболий, и не все они хорошо изучены. Представляется, что все-таки большая часть больных высокого риска по развитию ТЭО получит большую пользу от возобновления терапии варфарином, чем наоборот.


